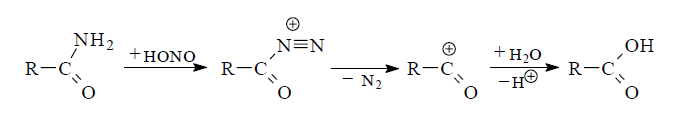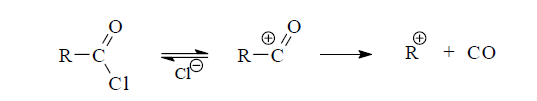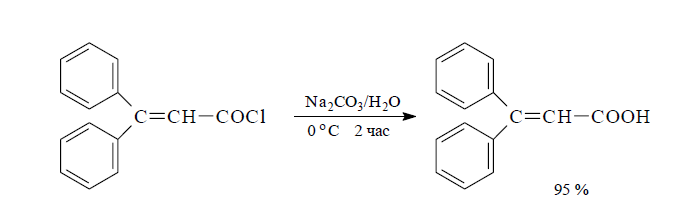производные карбоновых кислот
В табл. 15 приведены соединения пяти различных классов – производные карбоновых кислот.
- Производные карбоновых кислот
- Химические свойства производных карбоновых кислот
- Ответы на упражнения к теме 2
- Урок 29
- Сложные эфиры: способы получения и свойства
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
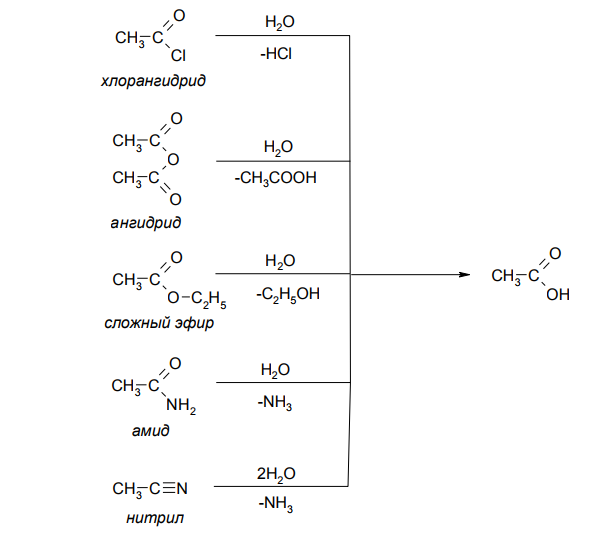
- Гидролиз производных карбоновых кислот
- 🔍 Видео
Производные карбоновых кислот
| Сложные эфиры |
|---|
кислот
кислот
кислот
кислот











Химические свойства производных карбоновых кислот
1. Гидролиз производных карбоновых кислот дает карбоновые кислоты:
2. Ангидриды и хлорангидриды кислот реагируют со спиртами с образованием сложных эфиров:
Задача 1. Какое производное кислоты:
а) быстро образует белый осадок, нерастворимый в НNO3, при добавлении спиртового раствора нитрата серебра;
б) реагирует с кипящим водным раствором NaOH, в результате реакции выделяется газ, окрашивающий бумажку красного лакмуса в синий цвет;
в) быстро реагирует с холодным раствором NaOH, высвобождая газ, который изменяет красную окраску лакмуса на синюю;
г) при гидролизе дает только карбоновую кислоту;
д) образует спирт при нагревании с кислотой или основанием?
Решение
а) Осадок со спиртовым растворов AgNO3 дают хлорангидриды кислот:
б) Газ, изменяющий красную окраску влажной лакмусовой бумажки на синюю, – это аммиак. С кипящим водным раствором NaOH выделяют газ аммиак азотсодержащие производные карбоновых кислот трех классов: 1) аммонийные соли RCOONH4; 2) амиды RC(O)NH2; 3) нитрилы RC
Уравнения реакций:
в) С холодным раствором NaOH быстро реагируют аммонийные соли карбоновых кислот (см. уравнение реакции б1).
г) Вещества, которые при гидролизе дают только карбоновые кислоты, – это ангидриды кислот:
д) Сложные эфиры RCOOR’ при нагревании с водной кислотой или основанием образуют спирты R’ОН:
 | |||||||||||||||||||||||
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Классификация сложных эфиров
Видео:Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Видео:КИСЛОТНЫЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Видео:Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать

Получение сложных эфиров
Видео:Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Видео:Самое понятное объяснение скорости химической реакции | Задание 18 | Химия ЕГЭ УМСКУЛСкачать

Гидролиз производных карбоновых кислот
Гидролиз производных карбоновых кислот. Все производные карбоновых кислот гидролизуются до карбоновых кислот в условиях кислотного или основного катализа:
ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ МЕТОДОМ ГИДРОЛИЗА
Среди производных карбоновых кислот чаще других в синтезе кислот используются галогенангидриды, ангидриды, сложные эфиры, амиды и нитрилы. Характерным свойством этих соединений является склонность к гидролизу, в результате которого образуется карбоновая кислота. Несмотря на то, что механизмы гидролитического расщепления сложноэфирной, амидной или нитрильной группы принципиальных различий не имеют, электронный характер, и свойства различных производных кислот требуют для успешного перехода к кислоте в каждом случае специального подбора условий гидролиза.
Образование карбоновых кислот из их функциональных производных представляется как взаимодействие воды с ацилирующим реагентом, то есть, как реакция нуклеофильного замещения при карбоксильном атоме углерода. Легкость гидролиза определяется величиной эффективного положительного заряда на углеродном атоме ацильной группы. Вероятны два механизма, по которым может идти превращение, — бимолекулярный и мономолекулярный.
Обычный ряд, в который располагаются производные кислот по убыванию ацилирующей способности — галогенангидрид > ангидрид > сложный эфир > амид (нитрил) справедлив и для соотнесения их активности в реакции гидролиза по механизму SN2, который реализуется чаще диссоциативного.
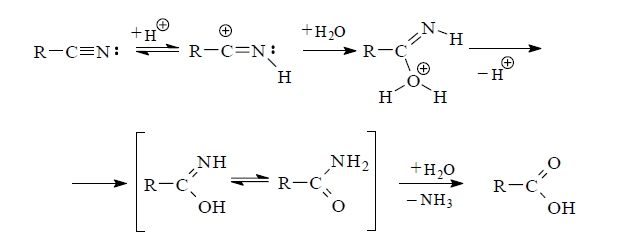
Несмотря на то, что нитрилы занимают в этом ряду последнее место, они имеют наибольшее практическое значение для синтеза карбоновых кислот методом гидролиза. Это обусловлено, главным образом, тем, что цианиды могут быть сравнительно легко получены из соединений различных классов — галогенопроизводных, аминов, оксосоединений и других. Для гидролиза нитрильной группы требуются весьма жесткие условия. Реакция проводится в присутствии кислот или оснований.
В случае гидролиза в кислой среде, вероятно, сначала происходит протонирование атома азота нитрильной группы и затем следует нуклеофильная атака молекулы воды по электронодефицитному углеродному атому. Возникающее иминоокси соединение таутомеризуется в более устойчивую форму амида, который далее гидролизуется до карбоновой кислоты.
Наилучшими условиями омыления нитрилов считается нагревание их с концентрированной соляной кислотой или с 20-75%-ной серной кислотой.
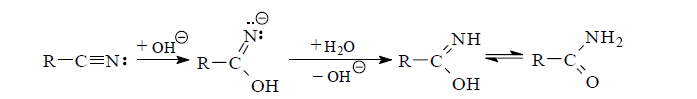
При щелочном гидролизе цианогруппы на первой стадии образуется N-анион иминооксисоединения как результат атаки нитрильного атома углерода гидроксид-ионом. Далее следует миграция протона от молекулы воды к N-аниону с последующим переходом образовавшегося амида в карбоновую кислоту.
В щелочной среде реакцию лучше вести не в воде, а в этиленгликоле, глицерине и подобных растворителях.
На скорость гидролиза оказывает влияние пространственное строение углеводородного радикала, с которым связана группа CN. Наиболее легко в реакцию вступают первичные цианиды, особенно трудно омыляются ароматические нитрилы с объемными заместителями в орто-положении.
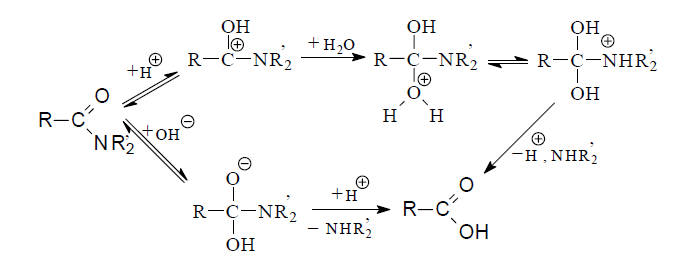
Промежуточно образующиеся при гидролизе нитрилов до кислот амиды, как правило, не выделяют. Вместе с тем, сами амиды могут служить хорошими источниками карбоновых кислот. Их омыление ведут как в кислой, так и в щелочной среде. Считают, что превращение имеет нуклеофильный механизм, аналогичный тому, который реализуется в реакциях гидролиза сложных эфиров, галогенангидридов, ангидридов. Кислотный катализ представляется как первоначальное протонирование амида по атому кислорода, что в дальнейшем облегчает нуклеофильную атаку молекулой воды. В щелочных условиях реакция начинается присоединением гидроксид-иона к амидному атому углерода.
Как правило, гидролиз амида проводят путем весьма длительного нагревания в водном растворе в присутствии кислоты или основания.
Если амид гидролизуется трудно, то его превращение в карбоновую кислоту реакцию рекомендуют проводить в 100%-ной фосфорной кислоте.
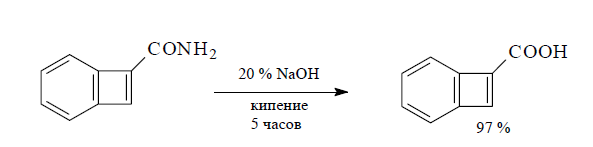
В ряде случаев для мягкого превращения первичных амидов в карбоновые кислоты их гидроксидезаминируют действием нитрита натрия в кислой среде (реакция Буво). Сначала азотистая кислота превращает амид в катион диазония, который тотчас разлагается с выделением молекулы азота. Возникающий катион ацилия атакуется молекулой воды.
Так, с помощью реакции удается с высоким выходом превратить в кислоты пространственно затрудненные амиды, которые обычно гидролизуются трудно.
Галогенангидриды и ангидриды в большинстве своем самопроизвольно гидролизуются водой. Тем не менее, эта реакция как метод синтеза кислот используется редко, так как чаще ангидриды и галогенангидриды получают из кислот.
В большинстве случаев реакция идет по бимолекулярному механизму. По убыванию активности для SN2-реакции галогенангидриды можно расположить в ряд: RCOF > RCOCl > RCOBr > RCOI. Электроноакцепторные заместители при α-углеродном атоме повышают активность галогенангидридов. Этот фактор, однако, действует до того предела, когда начинает преобладать мономолекулярный механизм, при котором влияние заместителей становится обратным. Кроме того, на легкость гидролиза оказывают влияние стерические эффекты заместителей и растворимость субстрата в воде. Следует учитывать также то обстоятельство, что, когда гидролиз идет по механизму SN1, промежуточный ион ацилия может претерпевать декарбонилирование.
Гидролиз хлорангидрида β,β-дифенилакриловой кислоты, который получают из 1,1-дифенилэтилена и оксалилхлорида, идет в растворе соды настолько интенсивно, что реакционную смесь необходимо охлаждать льдом.
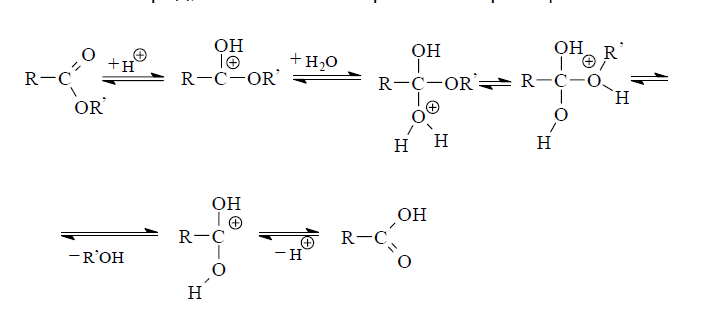
В курсе органической химии достаточно детально рассматриается гидролиз сложных эфиров, как обратная реакция этерификации. Это превращение идет в условиях кислотного катализа. Показано, что протон минеральной кислоты координирует с неподеленной парой электронов карбонильного кислорода. В результате этого на ацильном атоме углерода, который является объектом нуклеофильной атаки молекулой воды, увеличивается эффективный положительный заряд, что облегчает протекание реакции.
Поскольку реакция обратима, через некоторое время после ее начала устанавливается равновесие с соотношением концентраций эфир — кислота равным примерно 2 : 3. Для увеличения выхода кислоты необходимо создать условия для смещения равновесия вправо. Это достигается, как правило, путем отгонки образующегося спирта или добавлением в реакционную смесь избыточных количеств воды.
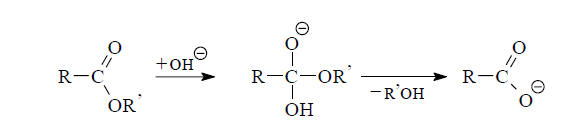
В щелочном растворе, напротив, реакция расщепления сложных эфиров необратима, так как продуктом ее является соль карбо-новой кислоты, которая не способна участвовать в обратной реакции ацилирования спирта. Это обстоятельство обусловливает необходимость использования в реакции не менее одного эквивалента щелочи.
Большей частью сложные эфиры гидролизуются гладко и с хорошим выходом. Свободную кислоту из ее соли выделяют, подкисляя реакционную массу.
Для получения кислот из пространственно затрудненных сложных эфиров применяют специальные методики гидролиза: проведение реакции в 100%-ной серной кислоте, в 18%-ной соляной кислоте, действие йодида лития в пиридине и др.
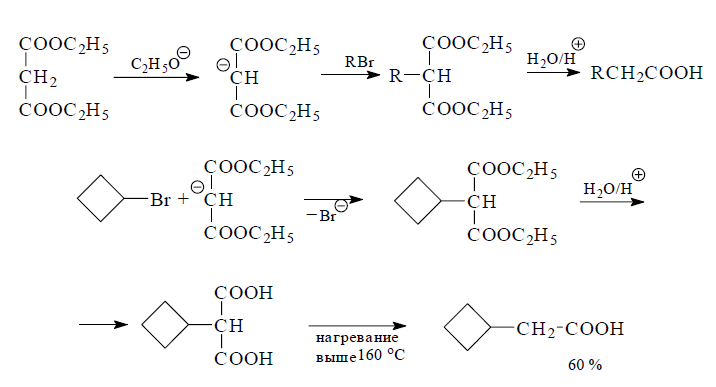
Большое значение в синтезе карбоновых кислот с применением реакции гидролиза играет способ, основанный на декарбоксилировании малоновых кислот и кислотном расщеплении ацетоуксусных эфиров.
Известно, что малоновый эфир обладает способностью при действии этилата натрия или магния образовывать устойчивый анион, который используют для введения заместителей в метиленовую группу. Полученные таким образом замещенные малоновые эфиры превращают путем кислотного гидролиза и последующего моно-декарбоксилирования малоновой кислоты в карбоновые кислоты, которые иногда называют как замещенные уксусные кислоты.
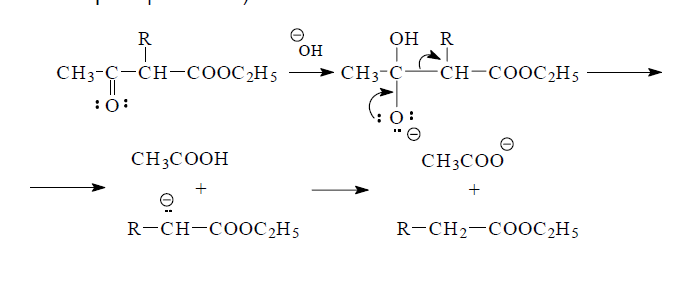
Ацетоуксусный эфир переходит при действии алкоголята натрия в натрийацетоуксусный эфир, который алкилируется галогенопроизводными по метиленовому атому углерода. Вместе с тем, для ацетоуксусного эфира характерны два направления разрыва углеродной цепи. Гидролиз разбавленными кислотами или основаниями приводит в результате декарбоксилирования ацетоуксусной кислоты к образованию диметилкетона (кетонное расщепление). С другой стороны, под действием сильных оснований (крепких щелочей, алкоголятов щелочных металлов) происходит разрыв С-С-связи при ацетильном фрагменте. Образующийся при этом сложный эфир омыляют затем обычным образом и получают карбоновые кислоты (кислотное расщепление).
Этим способом, как и с помощью малонового эфира, могут быть синтезированы многие карбоновые кислоты.
🔍 Видео
Химическое равновесие. Задание №22 | Химия ЕГЭ 2022 | УмскулСкачать

11 класс. Гидролиз солей.Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Электролиз. 10 класс.Скачать

Химия. Химические реакции. Гидролиз. Центр онлайн-обучения «Фоксфорд»Скачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать


















 (2,5-диметилфенола) = 1/2
(2,5-диметилфенола) = 1/2 СН3СН2СООН
СН3СН2СООН 




 •
• •V = 0,2•1,22•65,57 = 16,0 г.
•V = 0,2•1,22•65,57 = 16,0 г.




 .
.