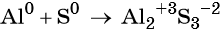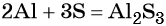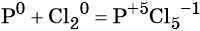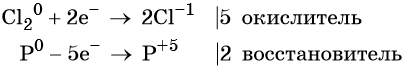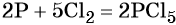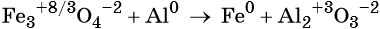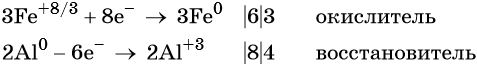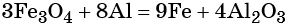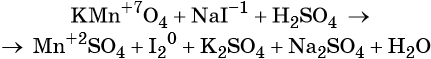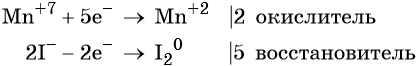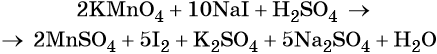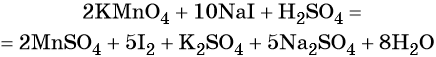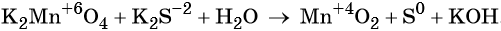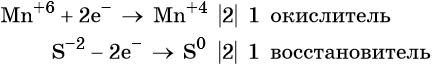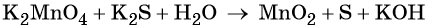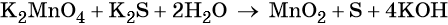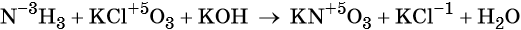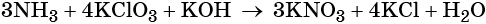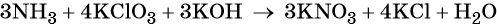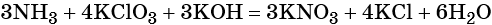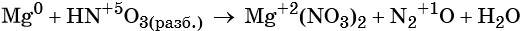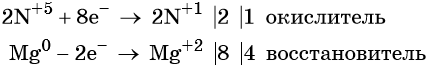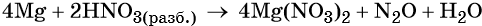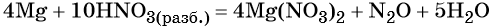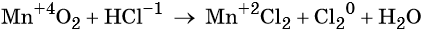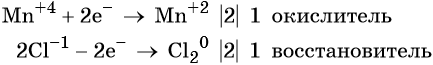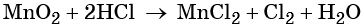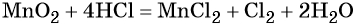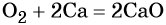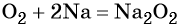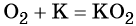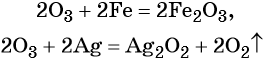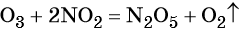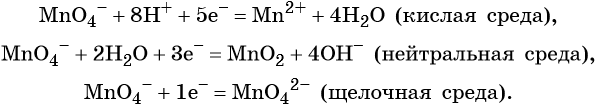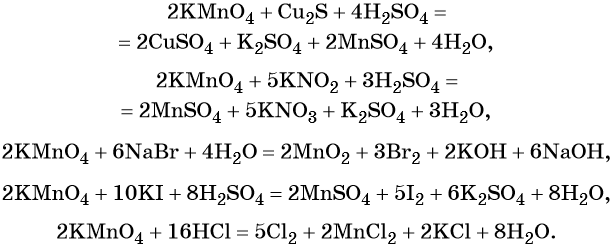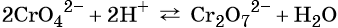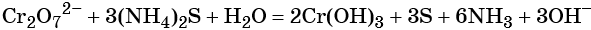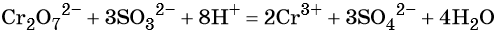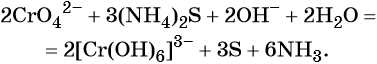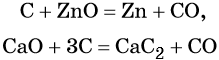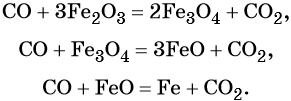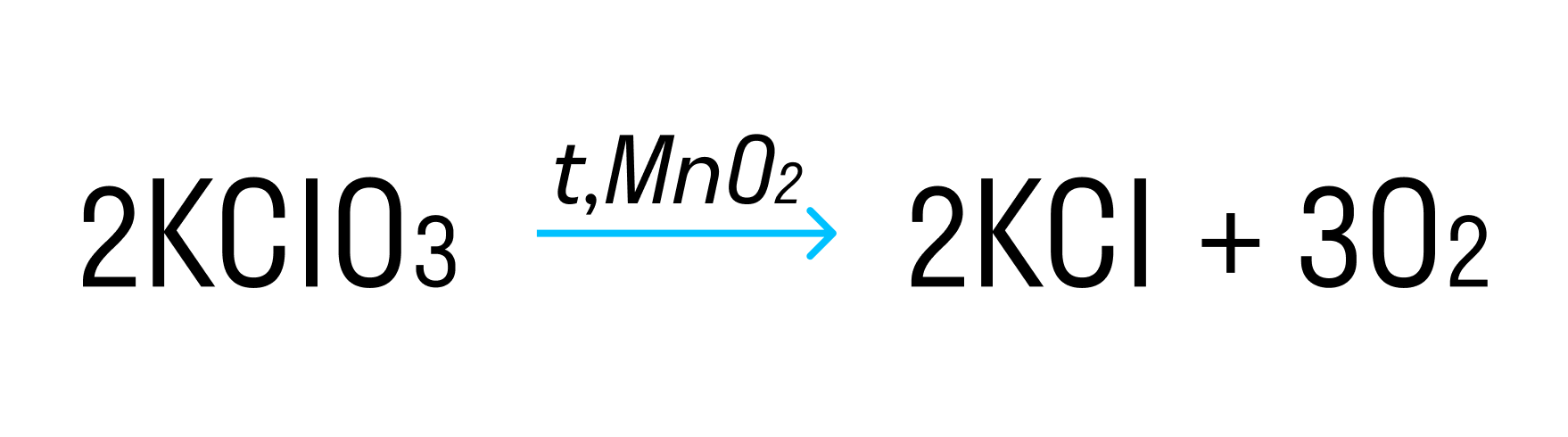- Кислород
- Положение в периодической системе химических элементов
- Электронное строение кислорода
- Физические свойства и нахождение в природе
- Способы получения кислорода
- Соединения кислорода
- Химические свойства
- Окислительно-восстановительные реакции. Окислитель и восстановитель
- Тренировочные задания
- Окислительно-восстановительные реакции
- Что такое ОВР
- Примеры веществ-окислителей
- Примеры веществ-восстановителей
- Окислительно-восстановительная двойственность
- Кислородсодержащие соединения серы в степени окисления +4
- Пероксид водорода
- Простое вещество йод
- Азотистая кислота и нитриты
- Классификация окислительно-восстановительных реакций
- Основные правила составления ОВР
- 📽️ Видео
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I2 0 . Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S 0 . Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl2 0 , хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
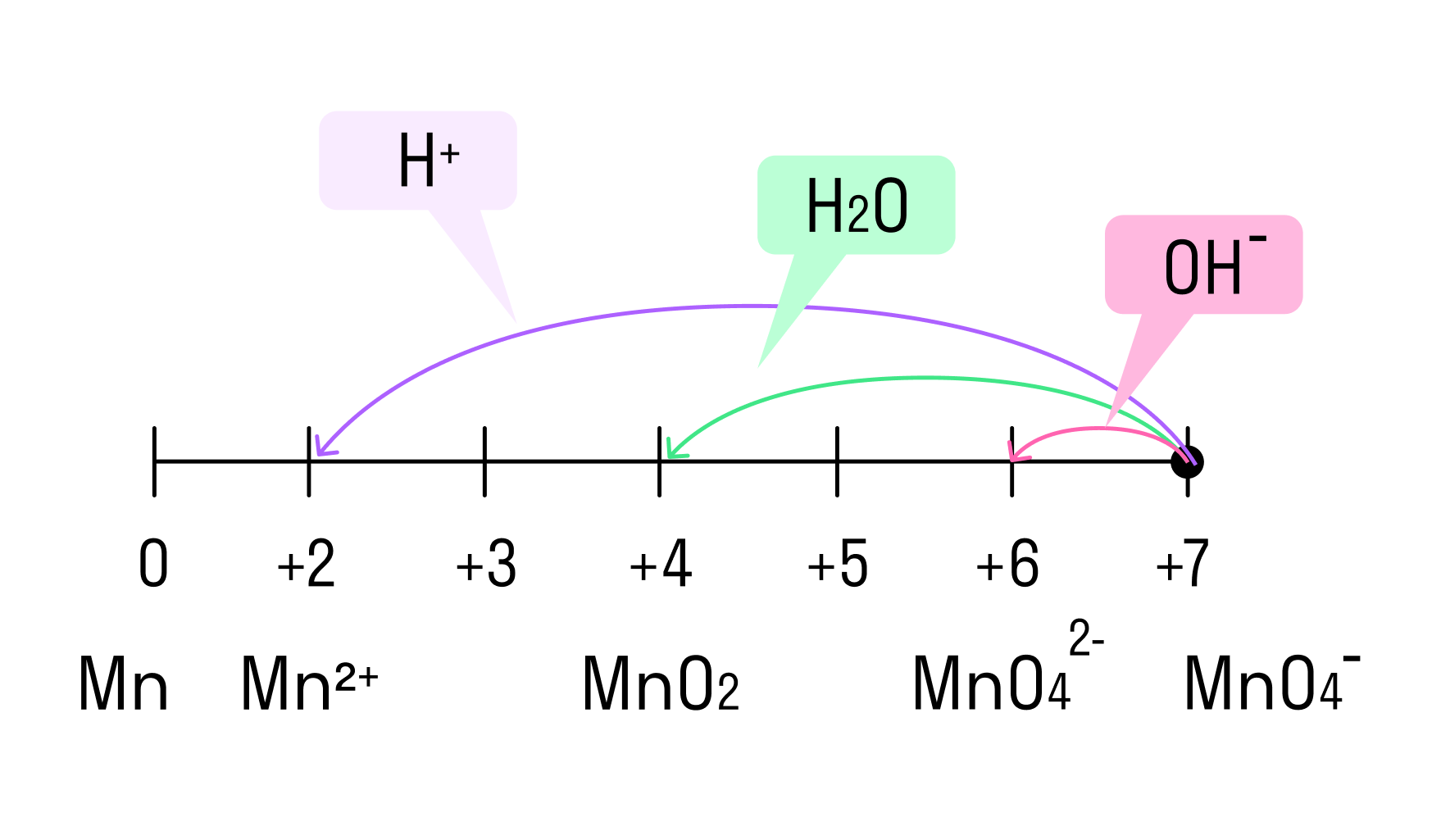
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn 2+ , в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO4 2– . Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
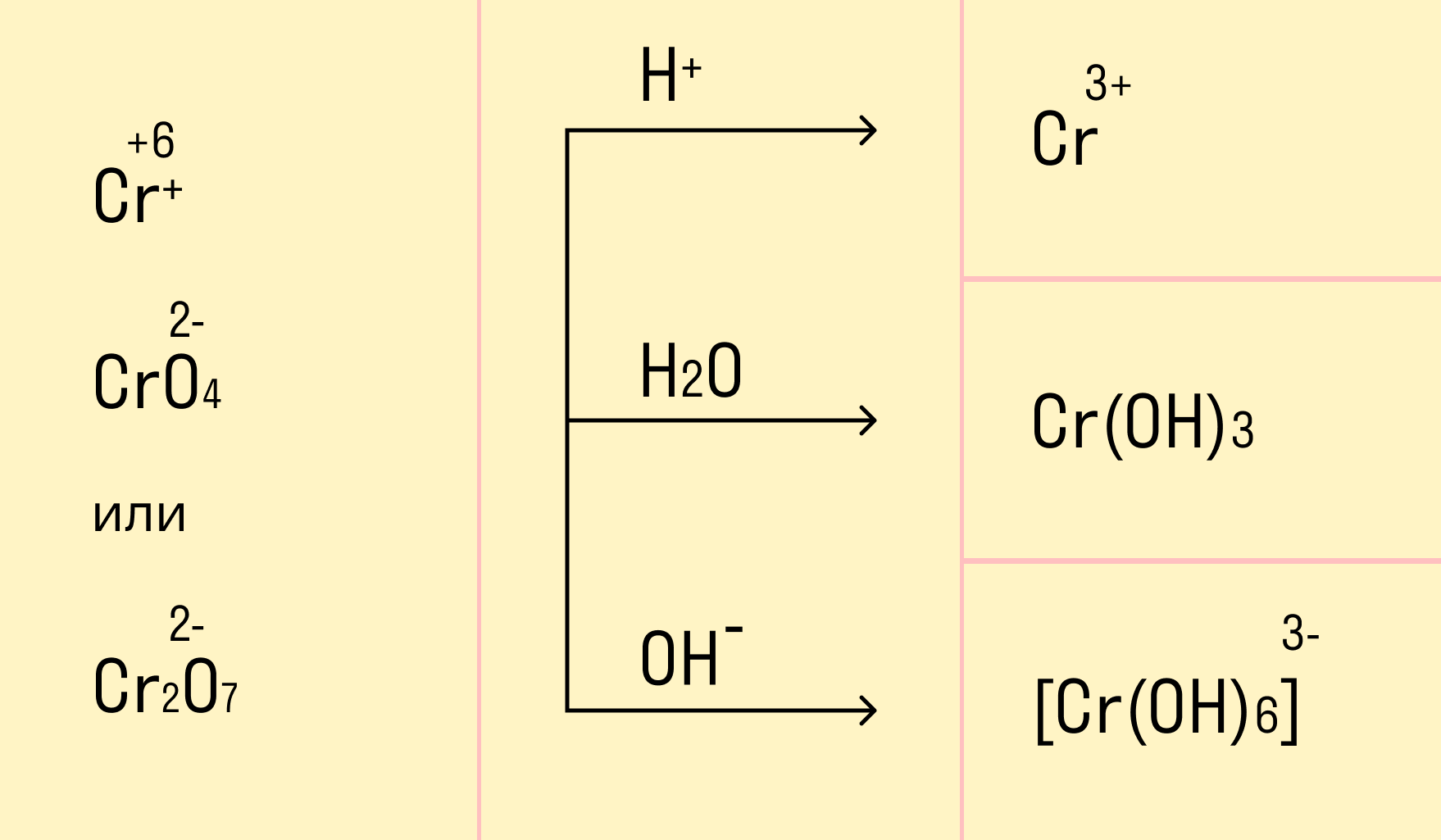
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr 3+ :
В щелочной — производные анионного комплекса [Cr(OH)6] 3– :
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
Видео:ОВР для чайников — Как определить Окислитель и Восстановитель #shorts #youtubeshortsСкачать

Окислительно-восстановительные реакции
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S +6 в серной кислоте (H2SO4), N +5 в азотной кислоте (HNO3) или солях-нитратах, Cr +6 в хроматах (CrO4 2− ) и дихроматах (Cr2O7 2− ) соответственно, а также Mn +7 (MnO 4− ).
В зависимости от среды проведения реакции Mn +7 и Cr +6 ведут себя по-разному. Рассмотрим на схемах:
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl +5 — окислитель, а O −2 — восстановитель.
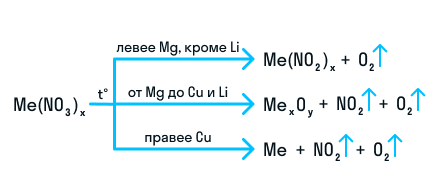
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
📽️ Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Соединения серы. 9 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Учимся составлять электронный баланс/овр/8классСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Кислород. 8 класс.Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Водород и кислород. 1 часть. 8 класс.Скачать