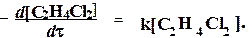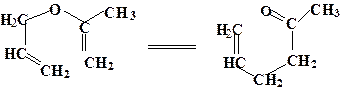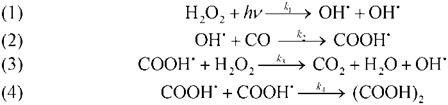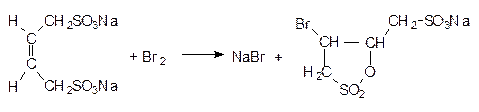Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
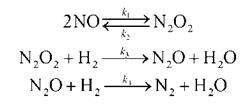
Мы рассмотрим два основных метода — метод квазистационарных (иногда просто — стационарных) концентраций и квазиравновесное приближение — на примере кинетической схемы:
1. Приближение квазистационарных концентраций применяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:
Если k2 >> k1, то B — неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
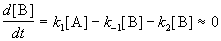
откуда 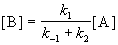
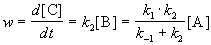
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближение применяют в том случае, когда одна из реакций — обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, что k2 . + H . + M (k1)
H . + п-H2 
H . + H . + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества — атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
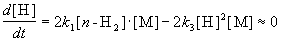
откуда 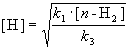
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
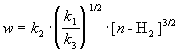
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2. Механизм ренатурации ДНК из двух ветвей спирали имеет вид:
Предполагая, что первая стадия — быстрая, а вторая — медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение. Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
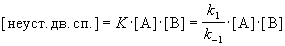
Скорость реакции определяется скоростью второй стадии:
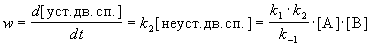
Образование устойчивой двойной спирали ДНК — реакция второго порядка с эффективной константой скорости k = k1 . k2 / k-1.
6-1. Механизм некоторой ферментативной реакции имеет вид:
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.(ответ)
6-2. Для реакции NO2Cl 
NO2Cl 
NO2Cl + Cl . 
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 
I2 
2I . 
2I . + H2 
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A 
дезактивация: A + A* 
распад: A* 
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5. Для тримолекулярной реакции 2NO + O2 
2NO 
(NO)2 + O2 
Определите порядок суммарной реакции, предполагая, что первая стадия — быстрая, а вторая — медленная.(ответ)
6-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O — . Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B 
A — + BH + 
A — + AH 
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
A 

Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях — по второму порядку.(ответ)
6-8. Химическая реакция N2O 
N2O + M 
N2O* 
N2O* + M 
N2O + O . 
Считая концентрации N2O* и O . стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + N2O5 
6-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + NO3 
Указание. Интермедиаты — NO и NO3.(ответ)
6-11. Дана схема цепной реакции:
AH 
A . 
AH + B . 
A . + B . 
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12. Дана кинетическая схема:
CH4 + M 
CH3 . + CH4 
H . + CH4 
H . + CH3 . + M 
(M — инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
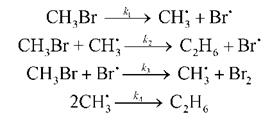
6-13. Реакция разложения бромметана 2CH3Br 
CH3Br 
CH3 . + CH3Br 
Br . + CH3Br 
2CH3 . 
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 
R . + R2 
R’ . 
2R . 
где R2, PA, PB — устойчивые углеводороды, R . и R’ . — радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.(ответ)
6-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO 
CH3 . + CH3CHO 
CH2CHO . 
CH3 . + CH3 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 
развитие цепи: CH3 . + CH3CH3 
CH3CH2 . 
H . + CH3CH3 
обрыв цепи: H . + CH3CH2 . 
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17. Дана кинетическая схема дегидрирования этана:
C2H6 
CH3 . + C2H6 
C2H5 . 
H . + C2H5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18. Химическая реакция 2C2H6 
C2H6 
H . + C2H6 
C2H5 . + C2H6 
2C2H5 . 
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 
Cl . + C2Cl4 
C2Cl5 . + Cl2 
2C2Cl5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20. Реакция образования фосгена CO + Cl2 
Cl2 
2Cl . 
CO + Cl . 
COCl . 
COCl . + Cl2 
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Химическая кинетика I. Порядок реакции.Скачать

колок. БИЛЕТЫ-коллоквиум_Кинетика_2021. Федеральное агентство по Кафедра физической химии образованию Дисциплина Физическая химия
| Название | Федеральное агентство по Кафедра физической химии образованию Дисциплина Физическая химия |
| Анкор | колок |
| Дата | 28.03.2022 |
| Размер | 330 Kb. |
| Формат файла |  |
| Имя файла | БИЛЕТЫ-коллоквиум_Кинетика_2021.doc |
| Тип | Документы #423669 |
| страница | 5 из 7 |
| Подборка по базе: Социально-биологические основы адаптации организма человека к фи, Министерство образования и науки Российской Федерации Федерально, Профилактика болезней средствами физической культуры.doc, Домашнее задание по физической культуре 2.docx, Рабочая программа по физической культуре 1-4 классы.doc, Анализ урока физической культуры.docx, Программа по физической культуре.docx, 9 класс тест по физической культуре.docx, Технологическая карта урока по физической культуре _Волейбол_ (7, Реферат_СРЕДСТВА ФИЗИЧЕСКОЙ КУЛЬТУРЫ В ПОВЫШЕНИИ ФУНКЦИОНАЛЬНЫХ Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Билет №18
Определите порядок реакции и сделайте предположение о типе реак- ции (простая или сложная).
очень медленно, но ускоряется в присутствии ионов серебра, что подтверждается тем, что скорость реакции становится пропорциональной концентрации ионов Ag + . Для реакции предложен следующий механизм: A T Используя метод квазистационарных концентраций по Ag 2+ и Tl 2+ выведите кинетическое уравнение этой реакции для Tl 3+ . 4. Основные положения теории ТАK. Понятие об активированном комплексе. Физический смысл порядка реакции в ТАK. Задача. Изопропенилаллиловый эфир в парообразном состоянии при температуре 150 0 С изомеризуется в аллилацетон Зависимость константы скорости от температуры описывается уравнением: Рассчитайте энтальпию и энтропию активации и дайте интерпретацию последней (реакция быстрая, медленная или нормальная). При 25 о С получены следующие опытные данные по продукту реакции: , мин………..0 20 30 40 50 60 Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000 Определите порядок реакции и вычислите константу скорости. Запишите выражение для скорости реакции.
Методом квазиравновесных концентраций получите кинетическое уравнение по продукту D и определите порядки реакции по реагентам. A +В = X + E K1 — константа равновесия 1 стадии C + X D k2 — константа скорости 2 стадии O=C(CH2COOH)2 O=C(CH3)2 +2CO2
По размерности константы скорости определите порядок реакции и запишите ее кинетическое уравнение. 4. Кинетика сложных реакций. Обратимые реакции. Превращение роданида аммония (NH4SCN) в тиомочевину (NH4)2C=S обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакции и константу равновесия на основании следующих данных по степени превращения NH4SCN
Билет№20
2 O 3 = 3 O 2предложен радикальный механизм: O3 O + O2 O + O 3 |
| Т, 0 С | 19,9 | 29,9 | 39,9 | 50 |
| k 10 2 , л/(мольс) | 0,713 | 1,50 | 3,05 | 5,89 |
По размерности константы скорости определите порядок реакции и запишите кинетическое уравнение реакции. Определите энергию активации реакции и предэкспоненциальный множитель A уравнения Аррениуса. Рассчитайте S и Н реакции при температуре 323 К
4. Обратимые реакции. Кинетическое уравнение обратимой мономо-лекулярной реакции. Наблюдаемая константа скорости. Для обратимой реакции константа равновесия составляет 1,7 при t =23 0 C. Определите какая из констант скоростей больше k1 или k-1.
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

Зависимость константы скорости от температуры.
2.1.1. У р а в н е н и е А р р е н и у с а. Скорость химических реакций обычно сильно зависит от температуры. Так, по правилу Вант — Гоффа для реакций в растворах при повышении температуры на десять градусов скорость увеличивается в 2-3 раза. Математически зависимость константы скорости от температуры выражается экспоненциальным уравнением Аррениуса k = А×exp(- 
параметры которого называются: А — предэкспонентом, Е — энергией активации.
В логарифмической форме уравнение Аррениуса принимает линейную форму от обратной температуры
ln k = ln B − 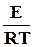
или в дифференциальном виде

Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости. Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле
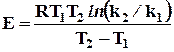
При большем количестве опытных точек, строят график зависимости lnk = f(1/T), угловой коэффициент наклона которого равен -Е/R в соответствии с уравнением (2.2). Так как температурный интервал экспериментальных данных обычно не превышает нескольких десятков градусов, графическое определение предэкспонента А затруднено из-за необходимости далекой экстраполяции. Поэтому величину А рассчитывают аналитически из уравнения 2.1, используя экспериментальные значения k при разных температурах и найденное значение энергии активации.
П р и м е р 2.1.1
Для реакции йодистого этила с алкоголятом натрия в этиловом спирте
найдены следующие значения константы скорости второго порядка
| t, 0 C | ||||
| k×10 5 , л/(мол××с) | 5,00 | 11,8 | 24,5 | 48,8 |
Определить энергию активации реакции и предэкспоненциальный член уравнения Аррениуса, рассчитать константу скорости при 15 о С.
Решение. Рассчитаем необходимые для построения графика 2.2 величины
| T, K | |||||
| T -1 ×10 3 , К — 1 | 3,663 | 3,584 | 3,508 | 3,436 | 3,367 |
| ln k | 1,609 | 2,468 | 3,199 | 3,888 | 4,605 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна учитывать третий знак после запятой, так как область изменения аргумента составляет всего 0,3 единицы и в противном случае точность определения искомой величины не будет соответствовать точности экспериментальных данных)
Построим график ln k — 1 /T и найдем угловой коэффициент его наклона (рис. 2.1)
|
Рис. 2.1. Зависимость логарифма константы скорости реакции от обратной температуры.
tga = -9,74 + 7,237/(3,65 — 3,4) ×10 -3 = -10,02 ×10 3 К, такое же значение коэффициента при аргументе в регрессионном уравнении.
E = — R × tga = 8,314 Дж/(моль×К) ×10,02×10 3 К = 83306 Дж/моль = = 83,3 кДж/моль.
Для расчета предэкспонента используем значение k при 24 о С (точка хорошо лежит на графике)
lnА = ln k + E/RT = — 6,905 + 10020/297 = — 6,905+33737 =26,83.
Можно использовать также значение свободного члена в регрессионном уравнении. Отсюда А = 4, 50 ×10 11 л/(моль×с)
Используя найденные параметры уравнения Аррениуса можно определить константу скорости данной реакции при любой температуре в рабочем интервале, например при 15 о С
=35,0.10 -5 л/(моль.с) или так
1. Константа скорости второго порядка для реакция нитроэтана со щелочью
имеет при 0 о К k = 39,1 л/моль*мин. Был приготовлен раствор 0,004 М нитроэтана и 0,005М NаОН, Через какое время прореагирует 90% нитроэтана?
2, Реакция окисления p-аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
Начальные концентрации комплекса и йода равны 1,0×10 -3 и 0,5×10 -3 моль/л. За кинетикой реакции следили по изменению концентрации йода, Температура 20 0 С, Полученные результаты приведены в таблице:
| Время , мин | |||||||
| [I2]×10 3 ,моль/л | 0,500 | 0,334 | 0,237 | 0,130 | 0,077 | 0,047 | 0,029 |
Определите порядок реакции и найдите среднее значение константы скорости реакции.
3.Изучалось гетерогенное разложение аммиака на вольфрамовой проволоке при Т = 1373 К : NН3 = 1 /2N2 + 3 /2 Н2
Период половины превращения (t1/2) в зависимости от начального давления аммиака Ро указан в таблице:
| Ро, мм рт, ст, | ||||
| t1/2 , мин | 7,6 | 3,7 | 1,7 | 1,0 |
Определите порядок реакции и константу скорости,
4. Определите порядок реакции 2СО=СО2+СТВ при 583,2 0 С, если в одном случае общее давление в реакции за 30 мин уменьшилось с 1,049 , 10 5 до 0,924 , 10 5 Па, а в другом за тот же промежуток времени оно уменьшилось с 0,714 , 10 5 до 0,624 , 10 5 Па (V=const),
5. Вычислите порядок реакции пиролиза диборана ( В2Н6 (газ) ) при 10 о С из следующих данных по зависимости скорости реакции от концентрации диборана и найдите константу скорости,
| [ B2Н6] , 10 2 , моль/л , | 2,153 | 0,433 |
| г , 10 4 , моль/(л , час) | 7,4 | 0,73 |
6. Константа скорости инверсии сахарозы
изменяется с ростом температуры следующим образом:
| t, 0 C | |||
| k × 10 4 , с -1 | 2,758 | 10,98 | 137,4 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7. При изучении кинетики димеризации бутадиена получено уравнение зависимости константы скорости от температуры:
Определите энергию активации и долю активных столкновений при 578 К, если стерический множитель равен 2.3.10 -5 .
8. Определите порядок реакции распада озона, если механизм его распада можно представить схемой:
Предполагая концентрацию атомов кислорода во времени стационарной, получите кинетическое уравнение для скорости распада озона. Сравните скорость распада озона со скоростью образования молекулярного кислорода.
9. Кинетика фотохимического хлорирования тетрахлорэтилена в растворе
Реакции цепная. Получите приведенное выше уравнение, если реакция идет по следующей схеме:




10. Превращение роданида аммония в тиомочевину –обратимая реакция первого порядка: k1
Рассчитайте константы скорости прямой и обратной реакции и константу равновесия на основании следующих данных по степени превращения NH4SCN:
| τ, мин | ∞ | |||||
| α NH4SCN, % | 2,0 | 6,9 | 10,4 | 12,3 | 13,6 | 23,2 |
1. Для реакции 2NO + 2 H2 = N2 +2 H2Oнайдено, что порядок по оксиду азота равен 2, а по водороду — первый, При 1000К константа скорости k =6·10 -4 л 2 /(моль 2 ·с), Чему равна скорость реакции при [NO]= 0,05 M и [Н2] = 0,01 М, Как изменится скорость, если концентрацию оксида азота утроить?
2. В результате реакции формальдегида с пероксидом водорода образуется муравьиная кислота. Реакция второго порядка.
Если смешать равные объемы молярных растворов НСНО и Н2О2, то через 2 часа при Т = 333,2 К концентрация муравьиной кислоты становится равной 0,215 моль/л, Вычислите константу скорости реакции и определите, через сколько времени прореагирует 98% исходных веществ,
3. По мере течения реакции между эквивалентными количествами окиси углерода и хлора, согласно уравнению СО + Сl2 = СОСl2 при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
| t, мин |
| Робщ,мм,рт, ст, |
Определите порядок реакции (V=const) графическим и аналитическим методом.
4, В реакции А + В = АВ получены следующие начальные скорости при различных начальных концентрациях реагентов :
| [А]0, моль/л | 1,0 | 0,1 | 1,0 |
| [В]0, моль/л | 1,0 | 1,0 | 0,0025 |
| r0, моль/(л , с) | 0,025 | 0,0025 | 0,00025 |
Напишите кинетическое уравнение реакции? Определите константу скорости,
5, При 518 о С время полупревращения реакции разложения ацетальдегида при начальном давлении 363 мм рт,ст, составляет 410 с, а при исходном давлении 169 мм рт, ст, t1/2 равно 880 с,
Определите порядок реакции и константу скорости реакции,
6. Реакция первого порядка имеет энергию активации 125 кДж/моль, а предэкспоненциальный множитель 5·10 13 с -1 . При какой температуре время полупревращения для данной реакции составит а) 1 мин; б) 30 дней?
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 105 0 С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Рассчитайте константу скорости реакции между йодом и водородом при температуре 500 0 С, если средний диаметр столкновений составляет 2×10 -10 м, а энергия активации 167 кДж/моль. Стерический множитель равен 1.
9. Экспериментально установлено, что порядок реакции разложения перекиси водорода в присутствии ионов Cr2O7 -2 в зависимости от температуры изменяется от 0 до 2. Предположительно механизм этого процесса описывается схемой:
Первая стадия этого процесса протекает быстро, а вторая стадия (лимитирующая)
-медленно. Найдите кинетическое уравнение реакции и объясните изменение ее
порядка с температурой.
10. Реакция между пероксидом водорода и ионом Fe 2+ идет по следующей схеме:




В ходе реакции образуются активные промежуточные частицы — свободные радикалы НО · и НО2 · . Используя метод квазистационарных концентраций, по радикалу НО · выведите кинетическое уравнение расходования Fe 2
11. Реакцию этерификации муравьиной кислоты этиловым спиртом

| τ, мин | ∞ | ||||
| СHCOOH , М | 43,52 | 40,40 | 37,85 | 35,10 | 24,28 |
изучали в водно-спиртовом растворе соляной кислоты с начальными концентрациями [HCOOH]0 = 0.0677 M. В условиях избыточных концентраций С2Н5ОН и Н2О, как прямая так и обратная реакция подчиняются уравнениям 1-го порядка. За кинетикой реакции наблюдали по изменению концентрации HCOOH.Результатыприведены в таблице:
Определите константы скорости прямой и обратной реакций.
1. Найдено, что в реакции SO2Cl2 = SO2 + Cl2 lg[SO2Cl2]линейно убывает со временем, За 240 с концентрация реагента уменьшилась от 0,4 до 0,28 М, Каков порядок реакции и время полупревращения?
2. Фенилдиазохлорид разлагается по уравнению:
В опыте, проводившемся при 323 К, измеряли объемы выделившегося азота, Были получены следующие результаты:
| τ, мин | ∞ | |||||||||
| VN2,см 3 | 19,3 | 26,0 | 32,6 | 36,0 | 41,3 | 45,0 | 46,5 | 48,3 | 50,4 | 58,3 |
Определите порядок реакции и константу скорости реакции,
3. Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
При изучении зависимости начальной скорости реакции от концентра-ции реагентов были получены следующие данные:
| Спнт , 10 4 , моль/л | ||||
| СHNO3,,моль/л | 0,4 | 0,8 | 0,4 | 0,8 |
| r , 10 6 , моль/(л*мин) |
Определите порядок реакции по каждому реагенту и рассчитайте константу скорости реакции,
4. Пользуясь зависимостью между временем полураспада и давлением, определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923 о К, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода следующие:
| Ро, мм рт,ст, |
 t1/2, с t1/2, с |
5. Газообразный азометан разлагается по реакции первого порядка:
При температуре 287 0 С и начальном давлении азометана равным 160 мм.рт.ст. через 100 с общее давление достигло 161,6 мм.рт.ст. Найдите константу скорости реакции и время полупревращения при указанной температуре.
6. Константа скорости омыления этилацетата щелочью изменяется с ростом температуры следующим образом:
| t, o C | |||
| k, л/(моль×мин) | 1,17 | 5,08 | 6,56 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 45 0 С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Окисление оксида азота озоном являетс бимолекулярной реакцией с энергией активации 9,6 кДж/моль:
Газокинетический диаметр молекулы азота равен 3 Å а молекулы озона − 4 Å. Определите теоретическое число молекул, реагирующих в 1 м 3 за 1 с при температуре 300 К и давлении 1 атм. Рассчитайте теоретическое значение предэкспонента уравнения Аррениуса для этой реакции по ТАС и сравните его с экспериментальным значением А = 1,1.10 9 л/(моль·с). Вычислите стерический множитель. Сделайте выводы о характере реакции на основании полученного значения стерического множителя.
9. Для следующей схемы сложной реакции:
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинети-
ческое уравнение реакции по реагенту А.
10. Кинетика термического распада дихлорэтана в газовой фазе описывается уравнением
Согласуется ли вышеприведенное уравнение скорости со следующей схемой цепного механизма реакции?




Используя метод квазистационарных концентраций выведите кинетическое
11. В водных растворахγ-оксимасляная кислота обратимо превращается в лактон при 25ºС. О
Начальная концентрация кислоты 0,1823 М. В таблице приведены данные по изменению концентрации лактона во времени:
| τ, мин | ∞ | ||||||||
| [C4H6O2].10 2 ,М | 2,41 | 3,73 | 4,99 | 6,10 | 7,08 | 9,11 | 10,35 | 11,55 | 13,28 |
Определите константы скорости прямой и обратной реакции.
1. Реакция иодирования b-фенилпропиоловой кислоты образованием a, b-дийодкоричной кислоты:
подчиняется кинетическому уравнению второго порядка, Исходные величины были взяты в эквивалентных количествах, Кинетику реакции изучали, определяя концентрацию иода титрованием проб тиосульфатом, В таблице приводятся данные по кинетике реакции при 24,8 о С, Определите среднее значение константы скорости реакции,
| t, мин | ||||||
| [I2], моль/л | 0,0251 | 0,0213 | 0,0177 | 0,0155 | 0,0124 | 0,0079 |
2. Для реакции гидролиза метилнитрата водой:
проходящей в избытке воды при температуре 90,5 о С и при начальной концентрации метилнитрата 0,02153 моль/л, были получены следующие экспериментальные данные:
| t, мин | ||||||
| [HNO3] , 10 3 ,моль/л | 0,0 | 1,75 | 3,48 | 4,85 | 6,27 | 7,57 |
| t, мин | µ | |||||
| [HNO3] , 10 3 ,моль/л | 8,99 | 10,49 | 11,97 | 13,53 | 14,97 | 21,53 |
Определите порядок реакции, рассчитайте среднее значение константы скорости реакции при данной температуре,
3. Термическая диссоциация окиси этилена протекает по уравнению:
При температуре 687,70С и постоянном объеме общее давление реакционной смеси, измеренное в мм,рт,ст , изменяется со временем следующим образом:
| Робщ, мм рт,ст, | 116,51 | 120,56 | 125,72 | 128,74 | 133,23 | 141,37 |
 t, мин t, мин |
4. Термическое разложение диоксана изучалось при температуре 504 О C, Получена следующая зависимость начальной скорости реакции от давления диоксана в начале реакции :
| rо , мм рт,ст,/мин | 42,5 | 14,7 |
| Ро, мм рт,ст, |
Определите порядок и константу скорости реакции,
5. Реакция нитрования п-нитротолуола азотной кислотой в водном растворе серной кислоты протекает по уравнению :
Реакция проводилась при температуре 25 о С в 94% Н2SО4 и при равных начальных концентрациях реагентов, Время полупревращения изменялось при изменении начальной концентрации п-нитротолуола следующим образом:
| Со , 10 5 , моль/л | 7,22 | 5,37 | 2,8 |
| t1/2, мин, | 14,5 | 19,4 | 37,5 |
Определите порядок реакции и рассчитайте константу скорости
6. Для реакции кислотного распада p-аллилпалладийбромида, протекающей в растворе бромистоводородной кислоты и характеризующейся следующим стехиометрическим уравнением:
изучена температурная зависимость константы скорости второго порядка:
| t, 0 C | ||||
| k2 ×10 6 , л/(моль ×с) | 0.795 | 2.51 | 5.01 | 10.0 |
Графическим методом определите энергию активации и предэкспоненциальный множитель A.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 40 0 С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Определите стерический фактор реакции пара-орто-превращения водорода по реакции H + p-H2 = o-H2 + H, если константа скорости этой реакции при 27 0 С равна 7,3×10 4 л/(моль×с), а энергия активации – 34,3 кДж/моль. Газокинетический диаметр молекул водорода 2,7 
9. Для следующей схемы сложной реакции:
где Х — промежуточная высокореакционная частица.
Используя метод квазистационарных концентраций по Х и Y выведите кинети-
ческое уравнение реакции по реагенту А.
10. Для гомогенного пиролиза метана 2CH4 = C2H6 + H2 предложен следующий механизм:




М — некоторая молекула (возможно, CH4 или C2H6), которая отводит энергию рекомбинации. На основе принципа стационарного состояния, выведите уравнение для скорости образования C2H6.
11.Смесь кетонной и енольнойформ ацетоуксусной кислоты доводят до рав-новесия, измеряя изменение показателя преломления во времени, по которому определяют содержание енольной формы Н3С−С(ОН)=СН−СООН.

| τ, мин | 4,25 | 6,50 | 9,17 | 12,0 | 14,2 | 17,5 | 20,8 | 24,2 | 27,5 | 31,5 | ∞ |
| Енол, % | 76,3 | 72,5 |
Определите константы скоростей прямой и обратной реакций первого по-рядка и константу равновесия.
1. Реакция амина и иодистого алкила протекает по уравнению:
Скорость реакции в нитробензоле определялась при 25 о С, причем найдено, что
| t, с | ||||||
| х, моль/л | 0,00876 | 0,01066 | 0,01208 | 0,01392 | 0,01476 | 0,01538 |
Начальные концентрации амина и иодистого алкила равны 0,0198 моль/л, Реакция второго порядка, Определите константу скорости,
2. Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идёт как реакция первого порядка,)
3. Реакция окисления p-аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
Начальные концентрации комплекса и иода равны 1,10×10 -3 и 0,65×10 -3 моль/л, За кинетикой реакции следили по изменению концентрации йода, Температура 25 0 С, Полученные результаты приведены в таблице:
| Время , мин | |||||||
| [I2]×10 3 ,моль/л | 0,650 | 0,387 | 0,255 | 0,128 | 0,071 | 0,041 | 0,024 |
Покажите, что реакция имеет первый порядок по каждому из реагентов и найдите среднее значение константы скорости реакции,
4. Кинетика реакции димеризации бутадиена
Определите порядок реакции и константу скорости по изменению общего давления (Р) в реакции при 326 о С:
| t, мин | 3,25 | 12,18 | 17,30 | 33,0 | |
| Робщ, мм, рт,ст, | 632,0 | 618,5 | 584,2 | 566,1 | 527,8 |
| t, мин | 42,50 | 55,08 | 90,05 | 119,00 | 259,50 |
| Робщ, мм, рт,ст, | 508,8 | 490,2 | 453,3 | 432,8 | 381,0 |
Определите порядок реакции и константу скорости реакции при данной температуре.
5.Изучалась зависимость скорости распада диоксида азота от концентрации реагента 2NO2 = 2NO +O2
Определите вид кинетического уравнения этой реакции и рассчитайте значение константы скорости по следующим данным:
| С NO2 , 10 5 , моль/л | 4,47 | 5,01 | 6,31 | 7,94 | 12,59 | |
| r , моль/(л , сек) | 0,032 | 0,040 | 0,063 | 0,095 | 0,158 | 0,214 |
6. Константа скорости разложения пентоксида диазота
равна 0,079×10 -5 с -1 при 0 0 С и 12,9×10 -5 с -1 — при 35 0 С. Рассчитайте энергию активации
и величину предэкспоненциального множителя.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 45 0 С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Для реакции разложения диоксида азота 2NO2 = 2NO + O2 предэкспоненциальный множитель уравнения Аррениуса равен 3×10 9 л/(моль×с). Рассчитайте стерический фактор этой реакции, если газокинетический диаметр молекулы диоксида азота равен 3,6 
9. Для следующей схемы сложной реакции:
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинети-
ческое уравнение реакции по реагенту С.
10. Реакция термического разложения азотной кислоты при 400 0 С описывается уравнением 2HNO3 = H2O + O2 + NO2 + NOи протекает по механизму
Выведите уравнение скорости расходования азотной кислоты в квазистационарном режиме. Как изменится порядок реакции по реагенту по мере увеличения степени конверсии? Какой из продуктов оказывает тормозящее действие?
методом температурного скачка была измерена константа скорости k1= (1,3±0,2)·10 11 л/(моль·с). Найдите константу скорости обратной реакции и время полупревращения в реакции нейтрализации 10 -4 М кислоты 10-4 М щелочью, считая, что реакция практически необратима.
1.Разложение мочевины в кислой средеимеет первый порядок по мочевине в избытке кислоты и воде:
При начальной концентрации мочевины равной 0,2 М скорость реакции составляет 8,56,10 -5 моль/(л , с) при t =61ºС, Определите константу скорости, концентрацию реагента через 5000 с, а также скорость реакции в этот момент,
2, Изменение концентрации метильных радикалов 2СН3 = С2Н6
изучали с помощью флеш-фотолиза (мгновенных вспышек), Были получены следующие данные:
| Время, мкс | ||||||
| [CH3 ∙ ] , 10 6 , М | 1,25 | 0,95 | 0,80 | 0,65 | 0,57 | 0,50 |
Определите порядок реакции и значение константы скорости,
3, Реакция разложения пентоксида диазота в газовой фазе протекает по уравнению:
Кинетику этого процесса изучали, измеряя увеличение общего давления (ΔР = Робщ,– Р0) в реагирующей системе в определенные моменты времени при V=const, При 328,1 К были получены следующие данные:
| t, мин | ∞ |
| ΔР, мм рт,ст, |
Каков порядок реакции, среднее значение константы скорости и период полураспада?
4, Время разложения для двух различных соединений РН3(1) и N2О (2) на 50% при различных исходных давлениях приводится ниже:
| РоРН3, мм рт,ст, | 52,5 |
| t1/2, с | |
| РоN2O,мм рт,ст, | 37,5 |
| t1/2, с |
Определите порядок обеих реакций,
5. Для реакции разложения ацетальдегида в газовой фазе:
изучена зависимость начальной скорости от давления ацетальдегида
| Рсн3сно0·10 -4 , Па | 0,88 | 1,08 | 1,6 | 2,93 | 3,49 | 5,05 |
| r0, Па/мин |
Определите порядок реакции и константу скорости .
6. Найдите энергию активации реакции и предэкспоненциальный множитель уравнения Аррениуса для реакции взаимодействия оксида углерода с диоксидом азота:
| Т, К | |||||
| k, л/(моль.с) | 0,028 | 0,22 | 1,3 | 6,0 | 2,3 |
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 800К.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Диаметр метильного радикала равен 3,8×10 -10 м. Какова гипотетическая максимальная константа скорости реакции второго порядка для рекомбинации радикалов при комнатной температуре. Трансмиссионный коэффициент принять равным 1, а энергию активации — 3 кДж/моль.
9. Для следующей схемы сложной реакции:
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинети-
ческое уравнение реакции по реагенту А.
10. Для реакции гомогенного пиролиза этана, протекающей по следующему основному маршруту C2H6 = C2H4 + H2 , предложен следующий механизм:
Выведите кинетическое уравнение образования этилена, используя метод квазистационарных концентраций. Каков порядок реакции по реагенту в этом уравнении? Тормозится ли реакция продуктами? Есть ли в механизме лимитирующая стадия?
11. Кинетика обратимойреакцииаквакомплекса ванадия(Ш) с тиоцианат-ионом в водном растворе при 25ºС
12. 

13. изучалась в условиях избыткаV 3+ , при этом наблюдаемая константа релаксации линейно зависела от концентрации последнего. Определите константы скорости прямой и обратной реакций на основании следующих
| [V 3+ ]·10 3 , М | 2,0 | 4,0 | 6,5 | 9,5 | 12,0 | 20,0 | 26,5 |
| k набл. ,с -1 | 1,3 | 1,5 | 1,7 | 2,1 | 2,3 | 3,2 | 4,1 |
16.
17. Каковы константы скорости прямой и обратной реакций?
1. Разложение пентоксида диазота N2О5 является реакцией первого порядка, Если в системе давление N2O5 через 10 мин составляло 69,2 мм.рт.ст., а через 30 мин 39,6 мм.рт.ст, то какова константа скорости реакции?
2. Реакция кислотного распада бис-p-аллилникеля в водных растворах описывается следующим стехиометрическим уравнением:
Начальные концентрации комплекса и кислоты соответствуют и равны 0,00500 и 0,0100 моль/л, Изменение концентрации H3O + во времени при 11 0 С характери-зуется следующими значениями:
| Время, мин | ||||||
| [HCl]×10 2 ,моль/л | 1,000 | 0,3460 | 0,1499 | 0,1168 | 0,0957 | 0,0810 |
Подтвердите выполнимость второго порядка реакции и рассчитайте значение константы скорости,
3. Дитретбутилпероксид при 154,9 0 С распадается по уравнению
Составьте материальный баланс по каждому реагенту, определите порядок реакции и время полураспада из следующих данных по изменению общего давления в системе:
| t, мин | ||||||||
| Робщ, мм.рт.ст | 169,3 | 188,3 | 201,1 | 207,1 | 218,7 | 224,4 | 250,3 | 255,2 |
4. Изучалась зависимость скорости реакции димеризации бутадиена в газовой фазе от начальной концентрации бутадиена,
При 240 О С получены следующие данные:
| Со, моль/л | 0,05 | 0,1 | 0,15 | 0,20 |
| rо, 10 4 , моль/(л, , мин,) | 0,565 | 2,26 | 5,07 | 9,02 |
5. Термический распад диоксана изучался при температуре 504 О С, При начальном давлении диоксана 800 мм.рт.ст, его концентрация уменьшалась вдвое за 15,8 минут, а при начальном давлении 400 мм.рт.ст. _ за 22,3 мин, Определите порядок реакции и рассчитайте константу скорости реакции.
6. Реакция первого порядка прошла на 30% при 25 0 С за 30 мин, а при 40 0 С — за 5 мин. Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ (приС o =1 моль/л и С o =1 моль/см 3 ) при температуре 45 0 С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Димеризация бутадиена в газовой фазе является реакцией 2-го
Эффективный диаметр молекул бутадиена равен 5,5 . 10 -10 м. В таблице даны значения констант скорости реакции димеризации бутадиена в зависимости от температуры:
| Т, К | ||||||
| k, 10 3 , л/(моль×с) | 0,531 | 0,715 | 1,40 | 2,43 | 9,85 | 44,5 |
Вычислите энергию активации и значение предэкспонента уравнения Аррениуса. Рассчитайте значение предэкспонента при 600 К по теории столкновений и сопоставьте его с опытным значением. К какому типу (“нормальные“, “медленные“ или “быстрые“) относится рассматриваемая реакция?
9. Для разложения перекиси водорода на катализаторе Pt/SiO2 В.П. Лебедев предложил следующий механизм:
Константа адсорбционного равновесия первой стадии этого процесса Ка = k1/k2. Напишите кинетическое уравнение для скорости разложения H2O2 методом квазиравновесных концентраций.
10. Реакция разложения бромметана 2СH3Br à C2H6 + Br2
протекает по следующему механизму:
Используя метод квазистационарного приближения, найдите выражение для
скорости образования этана.
1. В реакции второго порядка между веществами А и В начальная скорость имеет величину 7,2*10 -8 моль/(л·с) при концентрации А = 0,1 моль/л и В=0,03 моль/л, Какова константа скорости реакции? Через сколько времени реакция пройдет на 10% по веществу с меньшей концентрацией?
2. Реакция восстановленияхлорида железа(III) хлористым оловом протекает по уравнению
2 Fe +3 + Sn 2+ = 2 Fe +2 + Sn 4+
и подчиняется уравнению 3-его порядка, Начальные концентрации реагентов эквивалентны и равны [Fe +3 ]0 =[Sn 2+ ]0 =0,0625M, За кинетикой следили, определяя концентрации продукта [Fe +2 ]во времени титрованием проб бихроматом, Определите константу скорости по приведенным в таблице результатам титрования:
| Время, мин | |||||
| [Fe +2 ],моль/л | 0,01434 | 0,02586 | 0,03612 | 0,04502 | 0,05058 |
3. Реакция йодирования ацетона в растворе соляной кислоты идёт по уравнению: СН3СОСН3 + I2 + Н2О = СН3СОСН2J + Н3О + + I −
Изучалась зависимость скорости реакции от концентрации компонентов систепмы при 25 О С,
| Сац, , 10 2 , моль/л | ||||
| Сйода , 10 3 , моль/л | 1,3 | 1,3 | ||
| СHCl, моль/л | 0,1 | 0,1 | 0,025 | 0,1 |
| r , 10 6 , моль/(л , мин) | 4,01 | 3,98 | 0,98 |
По приведенным данным выведите кинетическое уравнение реакции и рассчитайте константу скорости реакции,
4. Пользуясь зависимостью между временем полураспада и начальным давлением, определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923 о К, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода p-H2 à o-H2 следующие:
| Ро, мм рт,ст, |
 t1/2, с t1/2, с |
5. Кинетика реакции димеризации бутадиена
Определите порядок реакции и константу скорости по изменению общего давления (Робщ) в реакции при 326 о С:
| t, мин | 8,02 | 12,18 | 33,0 | 42,50 | 68,05 | 90,05 | 259,50 | |
| Робщ, мм.рт.ст. | 632,0 | 599,4 | 584,2 | 527,8 | 508,8 | 474,6 | 453,3 | 381,0 |
6. Константа омыления уксусно-этилового эфира едким натром
при 9 0 С k = 2,37 л/(моль×мин), а при 14 0 С – k = 3,204 л/(моль×мин). При какой температуре константа скорости равна 5 л/(моль×мин)?
7. Изопропенилаллиловый эфир в парообразном состоянии при температуре 150 0 С изомеризуется в аллилацетон
Зависимость константы скорости от температуры описывается уравнением:
k = 5×10 11 × exp ( -122200 /RT), c -1 ; [E] = Дж/моль
Рассчитайте энтальпию и энтропию активации и дайте интерпретацию последней.
8. Предполагается, что реакцияI — + OCl — = OI − +Cl −
в растворе имеет следующий механизм:
В первой и третьей реакцией быстро устанавливается равновесие, а вторая стадия является лимитирующей. Выведите кинетическое уравнение реакции, соответствующее этому механизму. Оказывает ли какое-либо вещество тормозящее влияние?
9. Суммарное уравнение разложения перекиси водорода при фотохимическом образовании щавелевой кислоты отвечает суммарной реакции:
Предполагая, что механизм этой реакции отвечает следующей схеме:
Выведите кинетическое уравнение для разложения перекиси водорода.
1. Реакция первого порядка проходит на 25% а 35 мин, Какова величина константы скорости этой реакции в с -1 ? Сколько исходного вещества останется непрореагировавшим через 5 ч?
2. При взаимодействии персульфата калия с йодидом выделяется йод,
При изучении кинетики этой реакции сливали равные объемы 1/15 N растворов персульфата калия и иодистого калия, Через определенные промежутки времени отбирали пробы по 25 мл раствора и оттитровывали I2 0,01N раствором тиосульфата натрия, VNa2S2O3*NNa2S2O3 = VI2*NI2 , Результаты титрования:
| t, мин | ||||
| VNa2S2O3, мл | 4,52 | 7,80 | 14,19 | 20,05 |
Определите константу скорости 2-го порядка,
3. Некоторое вещество А смешано в равных молярных количествах с веществами В и С так, что концентрации их равны 1 моль/л, По истечении 1000 с половина А прореагировала, Сколько останется вещества А по истечении 2000 с, если считать, что соответствующая реакция: а) первого порядка; б) второго порядка; в) третьего порядка,
4. Термическая диссоциация окиси этилена протекает по уравнению:
При температуре 687,70С и постоянном объеме общее давление реакционной смеси, измеренное в мм,рт,ст , изменяется со временем следующим образом:
| Робщ, мм рт,ст, | 116,51 | 120,56 | 125,72 | 128,74 | 133,23 | 141,37 |
 t, мин t, мин |
5. Взаимодействие трифторида бора с аммиаком изучалось по начальным скоростям при V = const при различных концентрациях реагентов:
| [BF3], M | 0,250 | 0,250 | 0,200 | 0,350 | 0,175 |
| [NH3], M | 0,250 | 0,125 | 0,1 | 0,1 | 0,1 |
| ro, моль/(л,с) | 0,2130 | 0,1065 | 0,0682 | 0,1193 | 0,0596 |
Выведите кинетическое уравнение и определите константу скорости.
6. Константа скорости реакции окисления p-аллилпалладиййодида под действием йода:
изменяется с ростом температуры следующим образом:
| t, 0 C | |||||
| k2, л/(моль*с) | 1.47 | 1.80 | 2.44 | 3.06 | 4.73 |
Определите предэкспоненциальный множитель уравнения Аррениуса.
константу скорости реакции при 10 о С.
7. Для реакции бромирования бутен-2-дисульфоната-1,4 в жидкой фазе
рассчитайте энтальпию и энтропию активации на основании
| Т, К | |||
| k, 10 3 , л/(моль×с) | 8,9 | 11,0 | 13,7 |
8. Скорость реакции 2N0(г) + 2Н2(г à N2(г) + 2Н20(г)
описывается кинетическим уравнением r = k*(cN0) 2 *cН2. Для этой реакции был предложен механизм:
Первая и третья стадия этого процесса — быстрые химические реакции, а вторая
— медленная. Совместим ли этот механизм с экспериментальным кинетическим
9. Реакция взаимодействия катализатора Уилкинсона RhClL3,гдеL=P(C6H5)3, с водородом, приводящая к образованию активной формы этого катализатора RhClL2H2, способной вести процесс гидрирования алкенов, может быть описана следующей схемой:


💥 Видео
Химия - решение типовых задач по теме "Химическая кинетика и химическое равновесие"Скачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Основы химической кинетикиСкачать

ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать

ЛЕКЦИЯ №1 || Химическая кинетика || Основные понятия, элементарный акт, стехиометрическое уравнениеСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Хим. кинетика 1 часть | Физическая химияСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

12.12 Химическая кинетикаСкачать

Есенгалиев Д.А. - Кинетика сложных реакций. Лекция 8Скачать

Кинетика. О чем говорят графики. БиохимияСкачать

Открытый вебинар по теме: "Основы химической кинетики"Скачать

Асеев В. В. - Основы энзимологии - Ферментативная кинетика Уравнение Михаэлиса-МентенСкачать
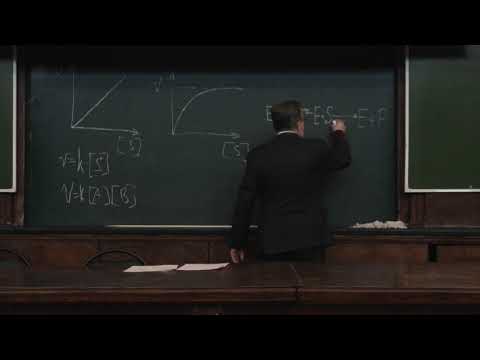
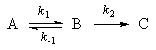
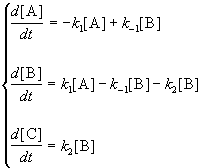
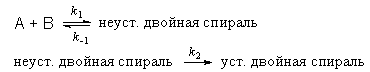
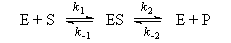


 Ce 4+ + Ag + Ce 3+ + Ag 2+ (k1,k-1)
Ce 4+ + Ag + Ce 3+ + Ag 2+ (k1,k-1)
 O2 + O
O2 + O O3
O3 2 O 2
2 O 2