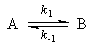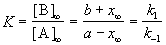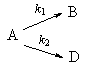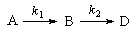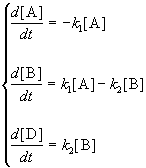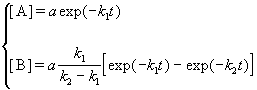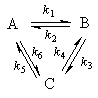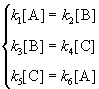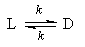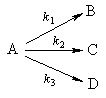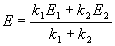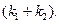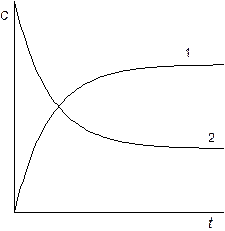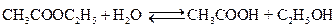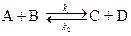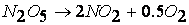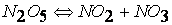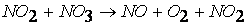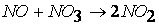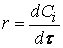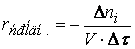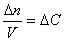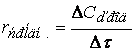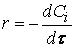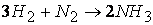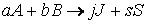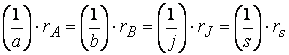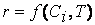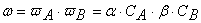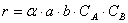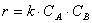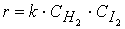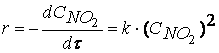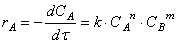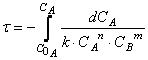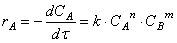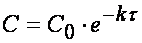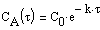При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
Если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Основные типы сложных реакций мы рассмотрим на примере реакций первого порядка.
1. Обратимые реакции первого порядка:
Закон действующих масс записывается следующим образом:
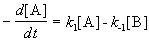
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a — x, [B] = b + x), то кинетическое уравнение приобретает вид:
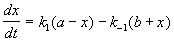
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
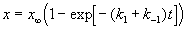
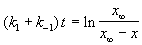
где x 
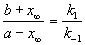
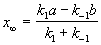
При t 

2. Параллельные реакции первого порядка:
Кинетическое уравнение записывается с учетом принципа независимости:
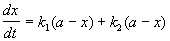
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:
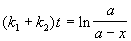
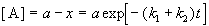
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
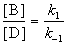
3. Последовательные реакции первого порядка:
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
Решение этой системы дает концентрации веществ:
Концентрация промежуточного вещества достигает максимума при
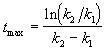
Величина этого максимума определяется отношением констант k2 / k1. Если оно велико, т.е. k2 >> k1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала. В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций ( 6).
Пример 5-1. Для обратимой реакции первого порядка
Kравн = 8, а k1 = 0.4 с -1 . Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции:
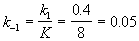
По условию, мы должны найти время, за которое прореагирует ровно половина вещества A. Для этого надо подставить значение x(t) = a/2 в решение кинетического уравнения для обратимых реакций (5.1) и (5.2):
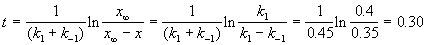
Пример 5-2. В параллельных реакциях первого порядка
выход вещества B равен 63%, а время превращения A на 1/3 равно 7 минутам. Найдите k1 и k2.
Решение. Кинетическое уравнение (5.3) для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка, в которое вместо одной константы скорости входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения A на 1/3 (x(t) = a/3) можно определить сумму констант k1 + k2:
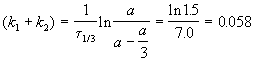
Выход вещества В равен 63%, а вещества D — 37%. Отношение этих выходов равно отношению конечных концентраций веществ B и D, следовательно оно равно отношению соответствующих констант скорости:
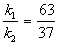
Решая это уравнение совместно с предыдущим, находим: k1 = 0.037 мин -1 , k2 = 0.021 мин -1 .
Пример 5-3. Имеется следующее равновесие:
Как связаны между собой константы k1 — k6?
Решение основано на принципе детального равновесия:
Если сложная система находится в равновесии, то в каждой из элементарных стадий также соблюдается равновесие.
Это означает, что во всех трех процессах: A 


Перемножив почленно эти три равенства и поделив левую и правую части на произведение равновесных концентраций [A] . [B]. [C], находим искомое соотношение между константами скорости:
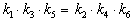
5-1. Нарисуйте графики зависимости концентраций веществ A и B от времени в обратимой реакции A 
5-5. Превращение роданида аммония NH4SCN в тиомочевину (NH4)2CS — обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t, мин
Доля прореагировавшего NH4SCN, %
5-6. Один из методов оценки возраста биологических объектов основан на измерении содержания в них оптических изомеров аминокислот. В живых организмах отношение концентраций D- и L-изомеров постоянно ([D]0 / [L]0 = a). В мертвых организмах происходит рацемизация:
Чему равен возраст биологического объекта, в котором [D] / [L] = b? Решите задачу в общем виде и для образца, содержащего аспарагиновую кислоту (k = 1.48 . 10 -5 лет -1 , a = 0.07, b = 0.27).(ответ)
5-7. В параллельных реакциях первого порядка
выход вещества B равен 53%, а время превращения A на 1/3 равно 40 c. Найдите k1 и k2.(ответ)
5-8. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль/л, [C] = 1.8 моль/л, [D] = 4.0 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 10 мин.(ответ)
5-9. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 10 мин после начала реакции были равны: [B] = 1.6 моль/л, [C] = 3.6 моль/л, [D] = 7.8 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 8 мин.(ответ)
5-10. Покажите, что при двух параллельных реакциях
энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:
*5-11. В системе идут две параллельные газофазные реакции: А + B 

5-12. На одном графике нарисуйте зависимости концентрации вещества B от времени в системе последовательных реакций A 

| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
- Кинетика двусторонних (обратимых) химических реакций
- Д.Г.НАРЫШКИН
- КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- ВВЕДЕНИЕ 3
- 1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
- 1.1. Скорость реакции
- 1.2. Влияние концентрации на скорость реакции
- 1.3. Молекулярность и порядок реакции
- 1.5. Реакция первого порядка
- 1.7. Реакции других порядков
- 1.8. Методы определения порядка реакции
- 2. Сложные реакции
- 2.1. Кинетика обратимых реакций
- 2.2 Параллельные реакции
- 2.3 Последовательные реакции
- 2.4 Метод квазистационарных концентраций
- 3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- 3.1.Уравнение Аррениуса
- 3.2. Связь энергии активации с тепловым эффектом реакции
- 3.3. Связь между скоростью реакции и равновесием
- 4. КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ
- 4.1. Общие понятия
- 4.2. Макрокинетика. Внешнедиффузионная область
- 4.3. Макрокинетика. Внутридиффузионное торможение
- 7. Заключение
- ВВЕДЕНИЕ
- 1.1. Скорость реакции
- 1.2. Влияние концентрации на скорость реакции
- 1.3. Молекулярность и порядок реакции
- 1.4. Прямая и обратная задача химической кинетики
- 1.5. Реакция первого порядка
Видео:Обратимая реакция второго порядка || Вывод уравнения || Разбор задачи || КинетикаСкачать

Кинетика двусторонних (обратимых) химических реакций
1. Рассмотрим двустороннюю (обратимую) реакцию
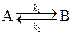
протекающую в закрытой системе при постоянном объеме, когда обе стадии, прямая и обратная, являются реакциями первого порядка. Если скорости прямой и обратной реакций в изучаемом диапазоне условий соизмеримы, то, согласно закону действующих масс, выражение для суммарной скорости записывается в виде разности скоростей прямой и обратной реакций.
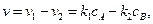
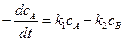
Пусть начальные концентрации веществ А и В равны соответственно 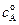
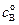
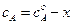
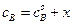
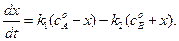
Преобразуя уравнение (4.71), получим:
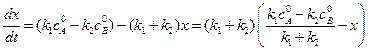
В момент равновесия ( 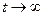
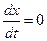
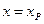
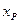
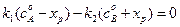
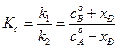
где Kс –константа равновесия реакции. Решив уравнение (4.73) относительно 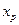
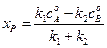
Подставив (4.74) в (4.72) получим:
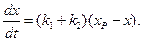
Разделяя переменные и интегрируя от 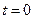
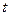
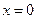
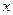
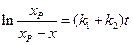
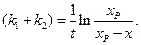
Уравнение (4.77) аналогично уравнению (4.24) для односторонней реакции первого порядка, с той лишь разницей, что вместо 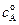
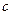
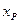
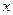
Количество вещества, вступившего в реакцию к моменту времени t можно рассчитать, по соотношению:
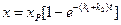
Изменение концентрации реагентов и продуктов реакции во времени можно изобразить на графике (рис 6).
Рис. 6 Зависимость концентрации реагентов от времени
Для обратимой реакции первого порядка.1 – продукт реакции, 2 –исходное вещество.
Выражение (4.78)можно также представить в виде уравнения прямой линии:
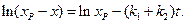
Таким образом, для обратимой реакции первого порядка должна соблюдаться линейная зависимость функции 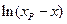
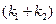
Для расчета значений каждой из констант, необходимо рассчитать константу равновесия реакции 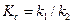
Зная значения 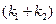
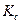
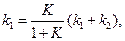
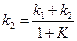
2. Типичным примером обратимой химической реакции, в которой обе реакции протекают как реакции второго порядка, является реакция омыления сложного эфира
Схема такой реакции
Решение задачи рассмотрим для случая, когда продукты реакции до начала реакции в реакционной смеси отсутствуют: СА 0 = СВ 0 =а.
Уравнение скорости химической реакции можно записать в виде:
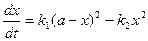
При достижении состояния равновесия выполняется условие:
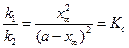
С учетом уравнения (4.81) уравнение (4.80) для скорости химической реакции запишется как:
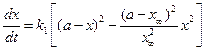
Полином допускает наличие двух корней квадратного уравнения х1= х∞ и х2= 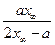
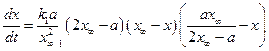
Интегральная форма этого уравнения имеет вид
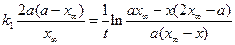
Константы скоростей k1 и k2можно определить из опытного значения кажущейся константы скорости:
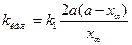
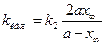
Дата добавления: 2016-01-09 ; просмотров: 2162 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Определение порядка реакции методом подбора кинетического уравненияСкачать

Д.Г.НАРЫШКИН
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Возможности компьютерной математики
при исследовании поведения химических систем во времени
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТТУ)
Видео:Скорость химических реакций. 9 класс.Скачать

ВВЕДЕНИЕ 3
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
Видео:Составляем кинетические уравненияСкачать

1.1. Скорость реакции
Видео:Порядок реакцииСкачать

1.2. Влияние концентрации на скорость реакции
Видео:Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

1.3. Молекулярность и порядок реакции
1.4. Прямая и обратная задача химической кинетики
Видео:ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

1.5. Реакция первого порядка
1.6. Реакции второго порядка
Видео:Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

1.7. Реакции других порядков
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

1.8. Методы определения порядка реакции
Видео:Кинетика || Лекция 4 || Реакции второго порядка, общий интеграл кинетического уравненияСкачать

2. Сложные реакции
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

2.1. Кинетика обратимых реакций
Видео:Лекция 2: закон действия масс, реакции первого и второго порядка (18.09.2019)Скачать

2.2 Параллельные реакции
Видео:Коробов М. В. - Физическая химия II - Кинетика необратимой реакции нулевого порядка и порядка nСкачать

2.3 Последовательные реакции
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

2.4 Метод квазистационарных концентраций
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Видео:задачи на порядок хим реакцииСкачать

3.1.Уравнение Аррениуса
Видео:ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать

3.2. Связь энергии активации с тепловым эффектом реакции
Видео:Основы химической кинетикиСкачать

3.3. Связь между скоростью реакции и равновесием
4. КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ
4.1. Общие понятия
4.2. Макрокинетика. Внешнедиффузионная область
4.3. Макрокинетика. Внутридиффузионное торможение
5. КИНЕТИКА РЕАКЦИЙ В ОТКРЫТЫХ СИСТЕМА
5.1. Химические реакторы.
5.2. Реакторы идеального смешения.
5.3. Реакторы идеального вытеснения.
5.4. Обратимые химические реакции в реакторах
в реакторах смешения и вытеснения.
7. Заключение
8. Рекомендуемая литература
ВВЕДЕНИЕ
Термодинамический метод изучения химических реакций позволяет сделать вывод о принципиальной возможности исследуемого процесса в тех или иных условиях и о глубине его протекания.
При постоянстве давления и температуры самопроизвольное протекание процесса возможно только в направлении уменьшения энергии Гиббса.
Условие 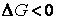
Это обстоятельство связано с тем, что 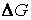
Однако химические реакции могут протекать с самыми различными скоростями – от взрывных до очень медленных, протекающих в течение многих месяцев и лет. Даже одна и та же реакция, протекающая на различных катализаторах, может иметь скорости, различающиеся во много раз.
В некоторых случаях необходимо увеличить скорость реакции, в других наоборот, уменьшить. Таких примеров можно привести множество.
Поэтому изучение скорости протекания химических процессов (а это и составляет задачу кинетики) чрезвычайно важно.
Для рационального проведения химических реакций необходимо уметь управлять ими, знать зависимости скорости от различных параметров.
По кинетике издано очень много учебной и методической литературы. Но все эти книги и учебные пособия написаны так, что хочется спросить: «Какое, милые, тысячелетье на дворе?»
Современные системы компьютерной математики позволяют дать быстрый, и что, пожалуй, главное, наглядный прогноз относительно поведения химической системы во времени.
Однако в русскоязычной учебной литературе по кинетике химических реакций подход, в котором используются средства символьной математики в совокупности со средствами решения систем дифференциальных уравнений, представляемые математическим пакетом Mathcad , практически отсутствует.
Поэтому, отвечая на естественный вопрос – чем предлагаемое учебное пособие отличается от множества других, можно ответить: настоящее пособие имеет цель продемонстрировать эффективность применения математического пакета Mathcad для решения задач химической кинетики.
Специальные химические дисциплины, такие как термодинамика и кинетика, достаточно математизированы, и часто решение химической задачи вызывает у студентов значительные трудности, связанные с математикой – довольно часто это приводит к тому, что приходится сознательно упрощать задачу.
Пособие иллюстрирует богатейшие возможности, которые открывает применение компьютерной математики перед исследователем для анализа поведения химических систем во времени.
В этом отношении математические пакеты становятся практически незаменимыми элементами обучения, позволяющими сделать акцент на содержательном анализе полученных результатов.
Знаком >>>>>> в тексте пособия отмечен переход к Mathcad документу для интерактивного расчета.
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1. Скорость реакции
Х имическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени.
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса. Однако путь перехода системы из начального в конечное состояние может быть достаточно сложным и «извилистым».
Так, например, реакция
протекает по следующему механизму:
Изучить кинетику реакции – значит показать, как реально протекает исследуемая реакция, её механизм, получить зависимость, связывающую скорость реакции с факторами, влияющими на неё.
Различают два типа химических реакций: гомогенные и гетерогенные.
К гомогенным относят реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму.
К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз.
Пусть протекает реакция
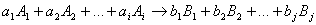
где a 1 , a 2 , ai , b 1 , b 2 , bj – стехиометрические коэффициенты.
Скорость реакции по i –му веществу в гомогенной системе определяется как количество i -го вещества, образующееся (или реагирующее) в единице реакционного объёма в единицу времени:
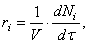
где V – объём реакционной зоны, Ni – количество i –го вещества.
Если реакция протекает изохорически, т.е. объём во время реакции не меняется, то, поскольку концентрация и объём связаны соотношением
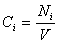
скорость реакции можно определить как изменение концентрации вещества во времени
Ранее мы определили скорость химической реакции как изменение числа молей реагирующих веществ в единицу времени в единице объема, т. е.
где 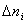
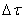
Таким образом определяется средняя скорость реакции для заданного интервала времени.
Если объем в процессе реакции постоянен, то
где 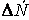
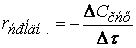
(скорость всегда положительна, а 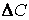
Если интервал времени 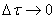
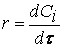
Размерность скорости: моль/(л·с).
Не только знак, но и абсолютное значение скорости зависит от того, по какому из участников реакции она измерена.
Так, например, при протекании реакции
скорость, с которой уменьшается концентрация водорода во время процесса, в три раза больше скорости убывания концентрации азота и в полтора раза выше скорости возрастания концентрации аммиака.
Следовательно, для реакции
скорости по компонентам реакции будут связаны соотношением:
Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации (или давления), температуры, т.е.
Раскрытие этой зависимости и составляет одну из задач кинетики.
1.2. Влияние концентрации на скорость реакции
Подход к выяснению зависимости скорости реакции от концентрации реагирующих веществ можно иллюстрировать следующим положением теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для того чтобы произошло химическое взаимодействие, например, реакция
необходимо, но не достаточно, столкновение реагирующих молекул А и В, т.е. одновременное нахождение их в определённой точке реакционного пространства.
Вероятность ω нахождения молекулы для каждого из веществ прямо пропорциональна количеству молекул в единице объёма, т.е. его концентрации:
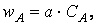
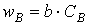
Тогда вероятность того, что обе молекулы будут одновременно находиться в одной точке пространства, т.е. что они столкнутся, равна
Но не все столкновения приведут к реакции, а лишь их некоторая доля α , величина которой зависит от температуры и природы веществ, поэтому скорость реакции
Постоянную k , не зависящую от концентрации и зави сящую только от температуры и природы реагирующих веществ, называют константой скорости реакции.
Численное значе ние k выражает скорость реакции, когда концентрации реагирующих веществ равны 1 моль/л.
Пусть протекает химическая реакция:
aA + bB + … → продукты.
Тогда зависимость скорости реакции от концентрации можно выразить соотношением
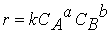
Полученное выражение называют законом действия масс.
1.3. Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул.
Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул.
Так, например, рассмотренная выше реакция
протекает по следующему механизму:
вторая стадия (медленная)
Определить такие стадии – значит определить механизм, или путь реакции.
Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм.
Поэтому закон действующих масс справедлив только для таких элементарных стадий.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества.
Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции.
при температурах, меньших 298К, протекает по следующему механизму:
первая стадия процесса: NO 2 + NO 2 ® NO 3 + NO
вторая стадия процесса: NO 3 + CO ® CO 2 + NO 2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса:
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать:
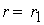
где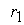
Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции
от концентрации реагирующих веществ:
Обратите внимание, что скорость реакции
не зависит от концентрации оксида углерода CO .
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме.
К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения.
1.4. Прямая и обратная задача химической кинетики
Определение на основании экспериментальных данных о зависимости концентраций от времени проведения процесса параметров кинетического уравнения – порядка реакции и значения константы скорости – составляет так называемую обратную задачу химической кинетики.
Знание кинетического уравнения реакции в дифференциальной форме позволяет определить время достижения некоторой заданной концентрации реагирующего вещества (или продукта реакции).
Пусть, например, протекает реакция
aA + bB + … → продукты,
кинетическое уравнение которой:
Тогда время достижения некоторой концентрации вещества А можно определить, интегрируя кинетическое уравнение реакции в дифференциальной форме:
Решая дифференциальное уравнение
можно получить зависимость концентрации реагирующего вещества (или продукта реакции) от времени проведения процесса – так называемых кинетических кривых.
Определение – на основании феноменологической модели процесса – концентраций реагентов от времени проведения реакции составляет прямую задачу химической кинетики.
Отметим сразу, что аналитически не всегда удаётся решить дифференциальное уравнение, особенно в случае сложной кинетики.
В этом случае прибегают к численным методам решения и использование компьютерной математики. В частности, применение математических пакетов, например, таких, как Mathcad , становится незаменимым инструментом в исследовательской практике и в процессе обучения.
1.5. Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
Примером такой реакции может служить реакция разложения диметилового эфира:
Кинетическое уравнение реакции первого порядка можно представить дифференциальным уравнением
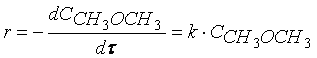
Тогда время t достижения некоторой концентрации диметилового эфира CH 3 OCH 3 можно определить, интегрируя соотношение (1.5):
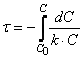
где С и C 0 – концентрация CH 3 OCH 3 в момент времени t и t =0.
Интегрирование приводит к выражению
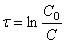

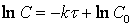
Из (1.7) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
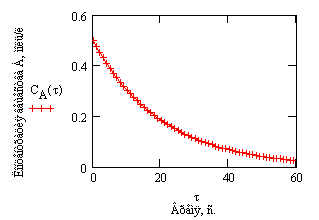
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции первого порядка
с начальной концентрацией 


Рис.1. Зависимость концентрации
от времени в реакции первого порядка .
и, в логарифмических координатах, согласно зависимости