Читайте также:
|
Опыт 1. Зависимость скорости разложения тиосерной
Кислоты от её концентрации при постоянной температуре
Цель работы. Изучить зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ при постоянной температуре .
Приборы:Бюретки, химические стаканчики, пробирка, секундомер
Реактивы: H2SО4– раствор серной кислоты
Na2S2О3 – тиосульфат натрия
H2O –дистиллированная вода
Уравнение взаимодействия тиосульфата натрия и серной кислоты:

Данная реакция сложная. Изучение механизма реакции показало, что она
протекает через три последовательные стадии:

Скорость всего процесса определяется второй стадией, так как
2-я стадия наиболее медленная.
Закон действующих масс – ν=kCH2S2O3
Кинетическое уравнение реакции (ЗДМ): ν= kCH2S2O3
| № опыта | Объём,мл | Общий объѐм, мл | Отношение концентраций между собой | Промежуток времени от начала до конца опыта Δ τ,с | Средняя скорость  |
| Na2S2О3 | Н2О | H2SО4 | |||
| 1:2:3 | 45,63 | 0,0219 | |||
| 21,88 | 0,0457 | ||||
| — | 14,33 | 0,0697 |
При идеальном выполнении закона действующих
масс (ЗДМ) график имеет вид: Прямой
Молекулярность изучаемой реакции, М =1
Общий порядок изучаемой реакции, П =1
Изменение концентрации Na2S2О3 влияет на среднюю скорость
реакции: При увеличении концентрации Na2S2O3 увеличивается средняя скорость реакции (это видно по результатам в таблице).
Зависимость скорости разложения тиосерной кислоты от еѐ
концентрации при постоянной температуре изображается графически прямой линией, т.к. Постепенно увеличивается концентрация вещества → также постепенно, без скачков увеличивается скорость реакции.
Опыт 2. Влияние концентрации на смещение химического
Равновесия
Цель работы.Изучить влияние изменения концентрации реагирующих
веществ на смещение химического равновесия.
Приборы:Стаканчик, пробирки.
Реактивы: KCNS –роданид калия
FeCl3 – хлорид железа (III)
Fe(CNS)3 — роданид железа (III)
КСl –хлорид калия
Уравнение химической реакции взаимодействия хлорида железа (III) и роданида калия.
FeCl3 + 3KCNS = Fe(CNS)3 + 3КСl.
Константа химического равновесия изучаемой реакции,
Kp=
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.005 сек.)
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Лабораторная работа № 1 «Кинетика химических процессов»
Лабораторная работа № 1
Кинетика химических процессов
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, температуры, концентрации.
Основные понятия: понятия гомогенной и гетерогенной систем, поверхность раздела, скорости гомогенной и гетерогенной реакции; закон действующих масс, порядок и молекулярность реакции, константа скорости химической реакции; уравнения Вант-Гоффа, Аррениуса; энергия активации; закон Генри.
1. пробирки: 6 шт;
2. штатив для пробирок;
3. метроном или секундомер;
4. термостат и крышка к нему
5. с отвестиями для пробирок;
7. стеклянные палочки;
8. пипетки капельные.
1. тиосульфат натрия Na2S2O3;
2. 2 н. раствор серной кислоты H2SO4;
3. раствор концентрированной соляной кислоты HCl;
1. Что такое скорость химической реакции?
2. Перечислите факторы, от которых зависит скорость химической реакции.
3. Сформулируйте закон действующих масс.
4. Что называют константой скорости химической реакции?
5. Что называют порядком химической реакции?
6. Что такое молекулярность реакции, в чем отличие молекулярности реакции от порядка реакции?
7. Как изменится скорость химической реакции при изменении температуры? Уравнение Вант-Гоффа. Физический смысл температурного коэффициента.
8. Что называют энергией активации? Уравнение Аррениуса.
Опыт № 1. Исследование влияния концентрации реагирующих веществ на скорость в гомогенной системе.
Исследование влияния концентрации реагирующих веществ на скорость в гомогенной системе проведите на примере реакции взаимодействия тиосульфата натрия с серной кислотой. Тиосульфат натрия является солью слабой тиосерной кислоты и является термодинамически устойчивым, не разлагается ни в твердом виде, ни в водных растворах. При действии на соль тиосерной кислоты сильных кислот, например, серной, последние вытесняют ее из солей, в отличие от которых, кислота неустойчива и в водных растворах диспропорционирует. Данное взаимодействие может быть описано следующим общим уравнением:
Рассмотрим все стадии реакции:
1 стадия: Na2S2O3 + H2SO4 = H2S2O3+ Na2SO4
S2O32- + 2H+= H2S2O3
2 стадия: H2S2O3 = H2SO3 + S
Вторая стадия процесса, представляющая собой диспропорционирование тиосерной кислоты, является самой медленной (лимитирующая стадия) и ее скорость определяет скорость протекания всего процесса взаимодействия тиосульфата натрия с серной кислотой.
Предварительно проделайте качественный опыт, для чего в пробирку внесите 5-10 капель 1н. раствора тиосульфата натрия и 3-5 капель 2н. раствора серной кислоты. Наблюдайте появление слабой опалесценции и дальнейшее помутнение раствора от выпавшей свободной серы.
Приготовьте три раствора тиосульфата натрия различной концентрации в соответствие с таблицей.
Первую и вторую пробирки осторожно встряхните. Таким образом, содержание тиосульфата натрия (в моль) составит: в 1-й пробирке – 1С моль; во 2-й пробирке – 2С моль; в 3-й пробирке – 3С моль.
Включите метроном. В первую пробирку добавьте 1 каплю 2н. раствора серной кислоты. Считая удары метронома, измерьте время от момента добавления кислоты до появления в растворе заметной опалесценции. Аналогичную операцию проведите с растворами, содержащимися во 2-й и 3-й пробирках.
Данные опыта занесите в таблицу. Постройте графическую зависимость скорости химической реакции от концентрации раствора тиосульфата натрия u = f(C), на основании которой сделайте вывод об изменении скорости химической реакции при изменении концентрации реагирующих веществ.
Число капель раствора Na2S2O3
Число капель H2O
Число капель раствора H2SO4
Общий объем раствора
Время течения реакции, сек.
Скорость реакции, 1/t
Опыт № 2. Влияние температуры на скорость реакции в гомогенной системе.
Приготовьте термостат, для чего в стакан емкостью 300-400 см3 налейте воды на 2/3 объема и закройте стакан картонной крышкой с тремя отверстиями, в одно из отверстий вставьте термометр с ценой деления 0,2, во второе-пробирку с 2н. раствором серной кислоты и с опущенной в нее пипеткой. В третье отверстие поместите пробирку с 10 каплями 1н. раствора тиосульфата натрия. Через 5-10 минут включите метроном или секундомер. Не вынимая пробирку с тиосульфатом натрия из термостата, добавьте в нее 1 каплю 2н. серной кислоты из пробирки, находящейся в том же термостате. Считая удары метронома, измерьте время от момента добавления кислоты до появления заметной опалесценции. Измерения проведите не менее 3-х раз, повышая температуру при каждом новом эксперименте в среднем на 10 градусов.
Полученные данные занесите в таблицу.
Температура опыта, ºС
Время течения реакции (число ударов метронома)
Скорость реакции 1/t, условные единицы.
На основании графической зависимости u = f(T) сделайте вывод о зависимости скорости химической реакции от температуры.
Опыт № 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Возьмите 2 одинаковые навески мрамора: одну – целым куском, а другую – в виде мраморной крошки. Опустите навески в две пробирки и одновременно добавьте одинаковое количество (10-20 капель) раствора соляной кислоты (1:1) (ТЯГА!). Сравните время полного растворения мрамора в каждом случае от момента внесения первой капли раствора кислоты и объясните наблюдаемые явления. Напишите уравнения соответствующих реакций.
Лабораторная работа № 2
Катализ и катализаторы
Цель работы: изучить явление катализа, рассмотреть влияние катализаторов на интенсивность протекания химических реакций.
Основные понятия: катализ: гомогенный, гетерогенный; катализаторы: гомогенные, гетерогенные, биокатализаторы; теории катализа; каталитические яды; “отравление“ катализатора.
1. колбы конические
2. на 250 мл – 3 шт;
3. цилиндры на 10 и 100 мл – по одной шт;
4. стакан на 200 мл – 3 шт
1. раствор медного купороса (3%-ный или 0,12М) CuSO4×5H2O;
2. раствор аммиака (10%-ный) NH4OH;
3. раствор пероксида водорода (10%-ный и 3%-ный) H2O2;
4. оксид марганца(IV) MnO2,
5. кусочек свежего и вареного картофеля.
1. Понятие катализа. Виды катализа.
2. Катализаторы и их классификация.
3. Теории катализа: адсорбционная теория.
4. Теории катализа: теория промежуточного комплекса.
5. Объясните с позиций теории промежуточного комплекса каталитическое действие оксида ванадия(V) на реакцию окисления диоксида серы в контактном способе получения серной кислоты.
6. Объясните с позиций теории промежуточного комплекса каталитическое действие монооксида азота на реакцию окисления диоксида серы в нитрозном способе получения серной кислоты.
7. Структура катализатора.
8. Объясните с точки зрения адсорбционной теории механизм каталитического действия оксида ванадия(V) на реакцию окисления диоксида серы в контактном способе получения серной кислоты.
9. Биокатализ. Биокатализаторы. Механизм действия биокатализаторов. Температурная зависимость ферментативных реакций.
10. “Отравление” катализатора. Каталитические яды. Регенерация катализаторов. Приведите примеры веществ, выступающих в качестве каталитических ядов по отношению к оксиду ванадия(V) и предложите методы восстановления каталитической активности катализатора.
Опыт №1. Изучение гомогенного катализа.
Исследование гомогенного катализа проведите на примере реакции разложения пероксида водорода в водном растворе.
H2O2 представляет собой бесцветную сиропообразную жидкость с плотностью равной 1,45 г/см3 . Это соединение способно разлагаться со взрывом на воду и кислород:
Водные растворы перекиси водорода более устойчивы; в прохладном месте они могут сохранятся довольно долго. Разложение перекиси водорода в водных растворах ускоряется катализаторами, например, MnO2, Cu, Fe, Mn и их ионами.
Для проведения эксперимента в конические колбы внесите: в 1-ю – 50 мл раствора медного купороса; во 2-ю – 50 мл раствора аммиака; в 3-ю – по 25 мл растворов медного купороса и аммиака. В третьей колбе образуется темно-синий раствор сульфата тетрааммина-меди(II)
CuSO4 + 4H3N×H2O = [Cu(NH3)4]SO4 + 4H2O
Cu2+ + 4H3N×H2O = [Cu(NH3)4]2+ + 4H2O
Добавьте во все колбы по 10 см3 раствора пероксида водорода. Объясните наблюдаемые явления.
Опыт №2. Изучение гетерогенного катализа.
Налейте в два стакана по 50 см3 3%-ного раствора пероксида водорода. В один стакан добавьте немного оксида марганца(IV), в другой – небольшой кусочек свежего картофеля. Наблюдайте интенсивное разложение пероксида водорода с выделением кислорода. Выделение кислорода покажите тлеющей лучинкой. Налейте в третий стакан 50 см3 раствора перекиси водорода и положите туда кусочек вареного картофеля. Отметьте интенсивность реакции разложения перекиси водорода во всех колбах. Объясните наблюдаемые явления.
Лабораторная работа № 3
Цель работы: изучение влияния различных факторов на состояние химического равновесия.
Основные понятия: обратимые и необратимые химические реакции; химическое равновесие как динамический процесс; константа химического равновесия; смещение химического равновесия, принцип Ле-Шателье; тепловой эффект реакции: экзотермические и эндотермические химические реакции.
1. пробирки – 4 шт;
2. колбы с пробками на 50 и 100 см3 по 1 шт;
4. штатив для пробирок.
1. 0,002н. раствор хлорида железа (III) FeCl3;
2. 0,002н. раствор роданида калия KSCN;
3. насыщенный раствор хлорида железа (III) FeCl3;
4. насыщенный раствор роданида калия KSCN;
5. кристаллический хлорид калия KCl;
6. диоксид азота NO2.
1. Какие реакции называются обратимыми? Приведите примеры.
2. Что такое состояние химического равновесия? Его характер.
3. Что называют константой химического равновесия?
4. Что называют сдвигом равновесия?
5. Перечислите факторы, влияющие на состояние химического равновесия.
6. Для необратимых реакций, протекающих до конца, константа равновесия стремится к бесконечности, так как концентрация продуктов реакции намного превышает концентрацию исходных веществ. О чем свидетельствует стремление константы равновесия к нулю?
7. Какие процессы называются экзотермическими и эндотермическими?
8. Сформулируйте принцип смещения равновесия Ле-Шателье.
9. Как влияет температура на состояние химического равновесия?
10. Оцените влияние концентраций компонентов системы на состояние химического равновесия.
11. Оцените влияние давления на состояние химического равновесия в газовых системах.
Опыт №1. Влияние концентрации реагирующих веществ на смещение химического равновесия.
Исследование влияния концентрации реагирующих веществ на состояние химического равновесия проведем на примере реакции образования роданидных комплексов железа (III), имеющих характерную кроваво-красную окраску (качественная реакция на Fe3+)
Для этого в четыре пробирки внесите по 5-7 капель 0,002н. растворов хлорида железа (III) и роданида калия. Растворы поставьте в штатив. Одну пробирку с полученным раствором сохраните для сравнения результатов опыта. В остальные пробирки добавьте 
Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона.
Запишите свои наблюдения. Составьте уравнения соответствующей обратимой реакции и напишите выражение константы равновесия.
1. Какие вещества находятся в растворе при равновесии?
2. Какое вещество придает раствору красную окраску?
3. Как изменяется интенсивность окраски раствора, и в каком направлении смещается равновесие данной равновесной системы при добавлении: а) хлорида железа (III); б) роданида калия; в) хлорида калия.
4. Как изменяются при этом в каждом случае концентрация компонентов равновесной системы:
а) роданида железа;
в) хлорида железа (III);
г) роданида калия по сравнению с их концентрациями после прибавления соответствующего реагента.
Опыт №2. Влияние температуры на смещение равновесия.
Влияние температуры на смещение равновесия исследуйте на примере димеризации NO2 . Для этого заполните две сухие колбы диоксидом азота, отметьте бурый цвет оксида азота(lV). Приготовьте два стакана: один – с горячей, другой – с холодной водой. Одновременно осторожно опустите в них колбы. Наблюдайте усиление окраски газа в горячей воде и обесцвечивание в холодной. В данном случае имеет место обратимая реакция образования димера N2O4 (бесцветный газ) из NO2 (бурый газ)
На основании принципа Ле-Шателье и данных опыта решите вопрос о тепловом эффекте прямой и обратной реакций.
Видео:Скорость химических реакций. 9 класс.Скачать

Опыт №2. Зависимость скорости реакции от концентрации реагирующих веществ. Определение порядка реакции разложения тиосерной кислоты
Читайте также:
|
| Опыт | Объем растворов, мл |  моль/л моль/л |  |  , с , с |  , с –1 , с –1 |
 | 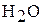 |  | общий объем, мл | ||
| – |
Расчет
1. На основании полученных данных постройте график зависимости 

2. Определите по графику порядок реакции разложения тиосерной кислоты.
3. Напишите кинетическое уравнение реакции разложения тиосерной кислоты.
3. На основании графика сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ. Согласуются ли ваши наблюдения с законом действующих масс?
Дата добавления: 2015-07-25 ; просмотров: 475 | Нарушение авторских прав
📹 Видео
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Составляем кинетические уравненияСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Скорость реакции. Химия – ПростоСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Химическая кинетика / Скорость химической реакцииСкачать

Зависимость скорости реакции от концентрацииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Занятие 4. "Энергетический профиль химической реакции".Скачать
Зависимость скорости реакции от концентрации реагентовСкачать

Опыты по химии. Типы химических реакцийСкачать

25. Схема реакции и химическое уравнениеСкачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Влияние температуры на скорость реакцииСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать






 .
.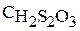 соответствует исходной концентрации тиосульфата натрия с учетом увеличения объема реакционной смеси за счет добавления воды и серной кислоты.
соответствует исходной концентрации тиосульфата натрия с учетом увеличения объема реакционной смеси за счет добавления воды и серной кислоты. .
. во всех проводимых опытах – постоянная величина. Вследствие этого при графическом определении порядка реакции средняя скорость разложения тиосерной кислоты можно быть рассчитана по формуле:
во всех проводимых опытах – постоянная величина. Вследствие этого при графическом определении порядка реакции средняя скорость разложения тиосерной кислоты можно быть рассчитана по формуле: .
.