Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Ваш ответ
Видео:Составляем кинетические уравненияСкачать

решение вопроса
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Похожие вопросы
- Все категории
- экономические 43,413
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,050
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Напишите кинетическое уравнение для реакции 2NO(г) + Cl2(г) = 2NOCl(г).
| 🎓 Заказ №: 22230 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Напишите кинетическое уравнение для реакции 2NO(г) + Cl2(г) = 2NOCl(г). Определите, во сколько раз увеличится скорость реакции: А) при повышении концентрации NO в 3 раза; Б) при повышении давления в системе в 2 раза?
Решение: Записываем кинетическое уравнение прямой реакции согласно ЗДМ до изменения условий. [ ] [ ]2 2 v k NO Cl пр А) При увеличении концентрации NO в 3 раза выражение примет вид (3[ ]) [ ] 9 [ ] [ ]2 2 2 2 v k NO Cl k NO Cl пр Находим соотношение скоростей и определяем изменение скорости реакции 9 [ ] [ ] 9 [ ] [ ] 2 2 2 2
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:25. Схема реакции и химическое уравнениеСкачать

Химическая кинетика. Химическое равновесие
4. Напишите кинетические уравнения следующих реакций:
б) 2NOCl(г) = 2NO(г) + Cl2(г)
Объясните причину несовпадения молекулярности и порядка реакции.
Решение.
Кинетические уравнения отражают взаимосвязь между концентрациями исходных веществ, находящихся в одной фазе, и скоростью реакции. Теоретической основой для написания кинетических уравнений является закон действующих масс (ЗДМ), согласно которому скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных их стехиометрическим коэффициентам. В соответствии с ЗДМ кинетические уравнения рассматриваемых реакций выглядят следующим образом:
V=k*C(O2), где V – скорость реакции, k – константа скорости реакции, C(O2) – концентрация кислорода, моль/л
V=k*C(NOCl) 2 , где V – скорость реакции, k – константа скорости реакции, C(NOCl) – концентрация NOCl, моль/л
V=k*C(C12H22O11)*C(H2O), где V – скорость реакции, k – константа скорости гидролиза сахарозы C12H22O11, C(C12H22O11) – концентрация сахарозы в водном растворе ,моль/л, С (Н2О) –концентрация воды, моль/л.
V=k*C(NO) 2 *C(H2), где V – скорость реакции, k – константа скорости, C(NO) – концентрацияNO,моль/л, С (Н2) –концентрация водорода, моль/л.
1.Причина несовпадения молекулярности и порядка реакции
Молекулярность реакции определяется числом частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Основными причинами несовпадения молекулярности и порядка реакции могут являться: простое несовпадение ( поскольку молекулярность- характеризует механизм, а порядок — кинетику реакции),
наличие избытка одного из исходных веществ, гетерогенность реакции, ее ступенчатый характер.
5. Установите, как изменится скорость химической реакции
а) уменьшить объем реакционной смеси в 2 раза;
б) уменьшить давление в 2 раза;
в) увеличить концентрации исходных веществ в 2 раза.
Решение.
Составим кинетическое уравнение реакции:
2.После уменьшения объема реакционной смеси в 2 раза концентрации реагентов увеличатся тоже в два раза. Тогда кинетическое уравнение примет вид:
Как видно из расчетов, после уменьшения объема реакционной смеси в 2 раза скорость реакции возрастет в 8 раз.
Уменьшение давления в 2 раза приведет к соответствующему уменьшению концентраций реагентов. Кинетическое уравнение примет вид:
Из расчетов следует, что после уменьшения давления реакционной смеси в 2 раза скорость реакции уменьшится в 8 раз.
Увеличение концентраций исходных веществ в 2 раза приведет к эффекту, аналогичному при соответствующем уменьшении объема системы:
Т.о, после увеличения концентраций исходных веществ в 2 раза скорость реакции возрастет в 8 раз
6. Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
Запишем уравнение реакции синтеза аммиака из простых веществ:
N2 (г)+3H2(г)=2NH3(г) 
Данная реакция является обратимой, гомогенной (все реагенты – газы,), протекает с уменьшением объема (в реакцию вступает 4 объема исходных газов-реагентов, получается 2 объема газообразного продукта).
Повышение температуры, давления и концентрации исходных веществ будет влиять на рассматриваемую реакцию в соответствии с законом Ле-Шателье:
Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
Повышение температуры будет смещать равновесие в сторону обратной эндотермической реакции, протекающей с поглощением тепла.
Повышение давления будет смещать равновесие в сторону прямой реакции, протекающей с уменьшением объема реакционной смеси, т.е., с уменьшением давления.
1. Повышение концентраций исходных веществ(азота и водорода) будет смещать равновесие в сторону прямой реакции, ведущей к уменьшению этих концентраций.
6.Таким образом, из рассмотренных факторов повышение давления и концентраций исходных веществ будет благоприятно влиять на экзотермическую реакцию синтеза аммиака из простых веществ, способствовать увеличению ее выхода. Напротив, повышение температуры будет способствовать уменьшению выхода прямой реакции.
7. В биологическом полимере (белке) имеет место следующее превращение:
нативное состояние ↔ денатурированное состояние,
Причем при повышении температуры равновесие сдвигается вправо.
Сделайте вывод об энтальпии реакции (принцип Ле-Шателье).
Решение.
1.Принцип Ле-Шателье гласит: Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
2. В соответствии с этим принципом при повышении температуры равновесие сдвигается в сторону эндотермической реакции, протекающей с поглощением тепла, т.е., с увеличением энтальпии реакции.
3. Поскольку, согласно условию, при повышении температуры равновесие сдвигается вправо , то прямая реакция (идущая вправо) – эндотермическая:
нативное состояние ↔ денатурированное состояние, 
Растворы
8. Раствор содержит 20 г глюкозы в 100 г воды.
Вычислите давление насыщенного пара растворителя над раствором при температуре 15 о С, если давление пара чистой воды при этой же температуре равно 23,75 мм рт. ст.
Рассчитайте молярную долю растворителя.
Решение
Рассчитаем молярные доли растворенного вещества и растворителя:
1.1.

Где 

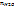

Тогда 
1.2.Молярную долю растворителя, 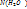

тогда 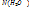
Согласно закону Рауля, давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:

где 


9. Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 о С.
Рассчитайте относительную молекулярную массу спирта и установите его формулу.
Решение.
1. Согласно закону Рауля понижение температуры кристаллизации раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества:
ΔТзам.= Тзам (растворителя)- Тзам (раствора)=KСm (1)
где Сm– моляльная концентрация раствора; К – криоскопическая постоянная. Для воды К=1,86° .
В соответствии с условием задачи ΔТзам.=0 о С-(-0,354 о С)=0,354 о С.
2. Из выражения (1) найдем моляльную концентрацию растворенного вещества:
Сm= ΔТзам/К=0,354/1,86=0,19 моль/кг
3.Согласно определению для моляльной концентрации:

Отсюда 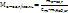
3. Общая формула предельных одноатомных спиртов –СnH2n+1OH. ., тогда молярную массу спирта можно выразить следующим образом:
М(R-OH)=14n+18=46, 14n=28, n =2. Следовательно, формула спирта – С2H5OH- этанол.
10. Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 о Сили 277 К).
Установите молярную массу гемоглобина.
Решение.
1. Согласно закону Вант-Гоффа осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
Из выражения (1) найдем величину См:
См= Росм/(1000*R*T)=2855/(1000*8,314*277)=0,00124 моль/л
2. Согласно определению молярная концентрация находится по формуле(2):
, отсюда 
11.Водный раствор NaOH кипит при температуре 102,65 о С. Кажущаяся степень ионизации электролита равна 70%.
Определите массу NaOH, растворённую в 100 г воды.
Решение
1.Согласно закону Рауля повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
ΔТкип. = i*Кэ*Сm, ( 1)
где i – поправочный изотонический коэффициент, Кэ – эбуллиоскопическая постоянная растворителя; для воды Кэ =0,52°; Сm –моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя. Согласно условию задачи ΔТкип=2,65°
Найдем величину i:
где α- кажущаяся степень ионизации электролита, согласно условию равна 0,7
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Т.О., для гидроксида натрия n=2. Тогда :
Из выражения (1) найдем величину Сm :
Сm= ΔТкип/( i*Кэ)=2,65/(1,7*0,52)=3 моль/кг
Масса NaOH, растворённая в 100 г воды, определяется по формуле (2):
m(NaOH)= Сm*M(NaOH)*100/1000 (2),
где M(NaOH)=40 г/моль.
Подставляя результаты расчетов в формулу (2), получаем:
11. Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при -0,514 о С.
Рассчитайте изотонический коэффициент и кажущуюся степень диссоциации.
Решение
Согласно закону Рауля понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
где i – поправочный изотонический коэффициент; К – криоскопическая постоянная растворителя; для воды К =1,86°; Сm –моляльная концентрация раствора; ΔТзам. = Тзам.р-рителя –Тзам. р-ра . Согласно условию задачи ΔТзам=0,514°
Найдем величину Сm. Согласно определению для моляльной концентрации:

2.Из выражения (1) найдем величину изотонического коэффициента:
I = ΔТзам./( К*Сm)= 0,514/(1,86*0,15)=1,84
3.Изотонический коэффициент и кажущаяся степень диссоциации связаны соотношением (2):
где α- кажущаяся степень ионизации электролита, n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для гидроксида калия n=2.
Выразим величину α:
12. Осмотическое давление 0,5 М раствора карбоната калия равно 2726 кПа при 0 о С.
Вычислите кажущуюся степень диссоциации K2CO3 в растворе.
Решение
1.Согласно закону Вант-Гоффа для электролитов осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
где i – изотонический коэффициент
Найдем величину i:
Изотонический коэффициент связан с кажущейся степенью ионизации соотношением :
где α- кажущаяся степень ионизации электролита,
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для карбоната калия n=3.
Выразим величину α:
Буферные системы
13. В состав крови входит буферная система, состоящая из двух анионов.
Приведите формулы её составных частей.
Назовите эту буферную систему.
Классифицируйте её по составу и природе компонентов.
Укажите зону буферного действия.
Напишите уравнения реакций, отражающих механизм действия (ионная форма).
Ответ
1. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Из этих систем только фосфатная состоит из двух анионов: Н2РО4 – (донор протонов) и НРО4 2– (акцептор протонов). Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных.
2. Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
3. Зона буферного действия буферной пары (Н2РО4 – –НРО4 2– )находится в интервале от 6,2 до 8,2.
4. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – :
а также ионов ОН – с ионами Н2РО4 – :
14. Аммиачная буферная система состоит из двух составных частей.
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови.
Решение
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония — слабый электролит, в растворе частично диссоциирует на ионы:
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью,рассчитывается по формуле:

где Кв – константа диссоциации NН4ОН=1,8*10 -5 , С0-концентрация основания, Сс-концентрация соли.
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
При добавлении щелочи ионы ОН — будут связывать ионы NН4 + , образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
Аммиачная буферная система не входит в состав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7,40 ± 0,05, т.е ниже области буферирования.
15. В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (Н2РО4 — ) и 1,6 моль солевого компонента (НРО4 2– ).
Установите рН буферного раствора.
Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6,2 – 8,2).
Ки (Н2РО4 — ) = 6,2×10 -8 моль/л; lg 2 = 0,3; lg 6,2 = 0,79.
Классифицируйте буферную систему по составу и природе компонентов.
Решение.
Подставим данные задачи в формулу для расчета рН фосфатного буфера:
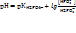
Рассчитанное значение рН входит в зону буферного действия( ЗБД) рН: 6,2 – 8,2
Фосфатная буферная система является кислотно-основной буферной системой, образованной анионами двух кислых солей
16. Концентрация ионов водорода в крови больного равняется 2,46∙10 -8 моль/л.
Рассчитайте рН крови (lg 2,46 = 0,39).
Назовите состояние, возникающее при данном нарушении КОС.
Укажите, чем характеризуется это состояние с точки зрения протолитического гомеостаза.
2. При данном нарушении КОС (рН> 7,4) возникает алкалоз
3. Под протолитическим гомеостазом принято понимать относительное постоянство соотношения кислота-основание внутренней среды живого организма. С точки зрения протолитического гомеостаза алкалоз — увеличение рН в крови (и других тканях организма) за счёт накопления щелочных веществ. Алкалоз может возникать вследствие гипервентиляции лёгких, приводящей к избыточному выведению СО2 из организма, вследствие больших потерь кислого желудочного сока при желудочных свищах, при длительном приёме диуретиков, при избыточном введении бикарбоната натрия с целью коррекции метаболического ацидоза или нейтрализации повышенной кислотности желудочного сока. При алкалозе уменьшается мозговой и коронарный кровоток, снижаются артериальное давление и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
Комплексные соединения
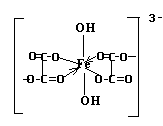
17. Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(C2O4)2(OH)2] 3- .
Изобразите графически его структурную формулу.
Классифицируйте этот ион по природе лигандов.
Напишите выражение константы нестойкости.
Пусть заряд иона-комплексообразователя Fe =(Х+). Заряды лигандов равны:(C2O4) 2- , (OH) — . Составим уравнение баланса зарядов:
Т.О. заряд комплексообразователя: Fe +3
Координационное число -число связей, образованных комплексообразователем, с лигандами. В данном ионе к.ч. железа равно 6, т.к. 4 связи железо образует с двумя двухвалентными группами C2O4 и две связи – с двумя одновалентными группами ОН)
1. Структурная формула комплексного иона:
2. Данный ион содержит различные по природе лиганды: оксалат – ион и нидроксид – ион. Т.о. комплексный ион является ацидокомплексом (за счет оксалатов – кислотных остатков щавелевой кислоты) и гидроксокомплексом ( за счет гидроксильных групп).
3. Выражение константы нестойкости:
18. Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
Изобразите графически структурную формулу внутренней сферы.
Классифицируйте соединение по заряду комплексной частицы, по электропроводности, по природе ионов внешней сферы и по природе лигандов.
Рассчитайте координационное число комплексообразователя.
Напишите выражение константы нестойкости.
1. Хлорид гексаамминхрома (III) имеет молекулярную формулу:
2. Cтруктурная формула внутренней сферы:
По заряду комплексной частицы хлорид гексаамминхрома является катионным комплексом; по электропроводности –сильным электролитом, по природе ионов внешней сферы-хлоридом, по природе лигандов –аммиакатом
Координационное число комплексообразователя равно 6
Выражение константы нестойкости:
[Cr(NH3)6] 3+ ↔ Cr 3+ +6 NH3
19. Рассчитайте DG процесса [Fe(CN)6] 4- ↔ Fe 2+ + 6CN — , если Кн в стандартных условиях равна 10 -35 .
Изобразите графически структурную формулу комплексной частицы.
Классифицируйте её по природе лигандов.
Напишите выражение константы нестойкости.
Изменение свободной энергии Гиббса ΔG и константа равновесия связаны соотношением:
Подставляя данные задачи и учитывая, что стандартные условия соответствуют Т=298 К,получаем:
ΔG=-8,31*298 *ln10 -35 =-2,3*8,31*298*lg10 -35 =-2,3*8,31*298*(-35)=199349 дж=199,349 кДж
Структурная формула комплексной частицы:
3.По природе лиганда данное соединение является ацидокомплексом, т.к. CN — — кислотный остаток синильной кислоты
4. Выражение константы нестойкости:
Физико-химия коллоидно-дисперсных систем и растворов ВМС
20. Напишите коллоидно-химические формулы мицелл золей полученных по реакциям:
А) AgNO3 + KI ®
В) FeCl3 + NaOH ®
Приведите строение мицелл.
Примечания:
В вариантах А – В необходимо написать формулы мицелл в избытке каждого из исходных веществ.
2.Коллоидно-химические формулы мицелл золей:
А) AgNO3 + KI ®AgI↓+К NO3
Состав мицеллы, полученной при избытке AgNO3, может быть представлен следующим образом:
Ядро — m AgI *nAg + ; адсорбционный слой противоионов -(n-x) NO3 — ; диффузный слой противоионов — х NO3 — .
Состав мицеллы, полученной при избытке KI, может быть представлен следующим образом:
[m AgI *nI — *(n-x) К + ] x — *х К +
Ядро — m AgI *nI — ; адсорбционный слой противоионов -(n-x) К + ; диффузный слой противоионов — х К + .
Состав мицеллы, полученной при избытке CaCl2, может быть представлен следующим образом:
[m Са C2O4 *nCa 2+ *2(n-x) Cl — ] 2 x + *2х Cl —
Ядро — m Са C2O4 *nCa 2+ ; адсорбционный слой противоионов 2(n-x) Cl — ; диффузный слой противоионов — 2х Cl —
Состав мицеллы, полученной при избытке H2C2O4, может быть представлен следующим образом:
[m Са C2O4 *nC2O4 2- *2(n-x) H + ] 2 x — *2х H +
Ядро — m Са C2O4 *nC2O4 2- ; адсорбционный слой противоионов 2(n-x) H + ; диффузный слой противоионов — 2х H +
В)FeCl3 + 3NaOH ®Fe(OH)3↓ +3NaCl
Состав мицеллы, полученной при избытке FeCl3, может быть представлен следующим образом:
[m Fe(OH)3*nFe 3+ *3(n-x) Cl — ] 3x+ *3х Cl —
Ядро — m Fe(OH)3*nFe 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
Состав мицеллы, полученной при избытке NaOH, может быть представлен следующим образом:
[m Fe(OH)3*nОН — * (n-x) Na + ] x- *х Na +
Ядро — m Fe(OH)3*n ОН — ; адсорбционный слой противоионов (n-x) Na + ; диффузный слой противоионов — х Na +
Г) FeCl3 + 2H2O ® Fe(OH)2Cl+ 2HCl
Состав мицеллы, полученной при гидролизе хлорида железа, может быть представлен следующим образом:
Ядро — m Fe(OH)3* nFeO + ; адсорбционный слой противоионов (n-x) Cl — ; диффузный слой противоионов — х Cl —
21. Имеются 3 коллоидных раствора: гидроксида железа (III), полученного гидролизом FeCl3, иодида серебра, полученного в избытке КI, и иодида серебра, полученного в избытке AgNO3.
Предложите два варианта взаимной коагуляции.
Объясните, используя формулы мицелл.
А)гидроксида железа (III), полученного гидролизом FeCl3:
Положительно заряженный золь
Б)иодида серебра, полученного в избытке КI:
[m AgI *nI — *(n-x) К + ] x — *х К +
Отрицательно заряженный золь
в)иодида серебра, полученного в избытке AgNO3:
Положительно заряженный золь
2.Взаимная коагуляция наблюдается при сливании растворов противоположно заряженных золей., а именно:
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя иодида серебра, полученного в избытке AgNO3.;
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя гидроксида железа (III), полученного гидролизом FeCl3.
22. Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л.
Рассчитайте объем 0,01М раствора дихромата калия, вызывающего коагуляцию золя объёмом 200 мл.
Определите заряд гранулы, учитывая, что коагулирующим действием обладает дихромат-анион.
Предложите соответствующий вариант формулы мицеллы золя Al(OH)3.
Рассчитаем объем раствора электролита-коагулятора дихромата калия (V) по формуле:
, где γ- пороговая концентрация коллоидного раствора гидроксида алюминия, равна 0,63 ммоль/л, V золя –объем золя, согласно условию равен 0,2 л, С- концентрация электролита-коагулятора дихромата калия, равна 10 ммоль/л. Подставляя значения в формулу, получаем:
V=0,63 ммоль/л *0,2л/10 ммоль/л=0,0126 л=12,6 мл
2.Поскольку коагулирующим действием обладает дихромат-анион, заряд гранулы (коллоидной частицы) противоположен, т.е. положителен.
3. Соответствующий вариант формулы мицеллы золя Al(OH)3, стабилизированного AlCl3:
[m Al(OH)3 *nAl 3+ *3(n-x)Cl — ] +x *3xCl —
3.Строение мицеллы:
Ядро — m Al (OH)3*n Al 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
23. ИЭТ альбумина плазмы крови равна 4,64.
Определите знак заряда частиц альбумина в 0,001М растворе HCl.
Укажите направление перемещения частиц альбумина при электрофорезе в данных условиях.
📹 Видео
В системе 2NO(Г) + O2(Г) = 2NO2(Г) начальные концентрации NO и O2 соответственно равны 5 mol/l и хСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Обратимая реакция второго порядка || Вывод уравнения || Разбор задачи || КинетикаСкачать

Основное уравнение динамики вращательного движения. 10 класс.Скачать

Химия | Cкорость химической реакцииСкачать

Кинематика механизма. Два способа решенияСкачать

Кинетика || Лекция 4 || Реакции второго порядка, общий интеграл кинетического уравненияСкачать

Введение в кинетикуСкачать

Механизмы химических реакций. Ч.2. Классификация механизмов. Электрофильные и нуклеофильные реакции.Скачать

Кинематика. Решение задач на равноускоренное движениеСкачать

ОЛИМПИАДНАЯ ЗАДАЧА ПО ТОЭ #3 | МЕТОД КОНТУРНЫХ ТОКОВСкачать
Классификация реакций: нуклеофилы, электрофилы, радикалыСкачать

Классификация реакций: ионные и радикальные реакцииСкачать

Задача на Резонанс Токов с Тремя реактивными элементамиСкачать

46. Вычисление пределов с помощью эквивалентных бесконечно малых функцийСкачать