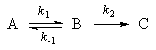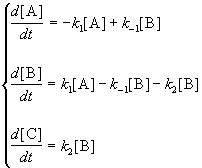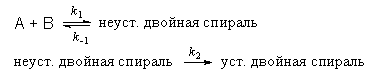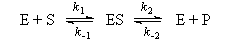Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
Мы рассмотрим два основных метода — метод квазистационарных (иногда просто — стационарных) концентраций и квазиравновесное приближение — на примере кинетической схемы:
1. Приближение квазистационарных концентраций применяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:
Если k2 >> k1, то B — неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
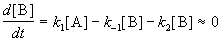
откуда 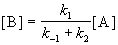
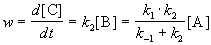
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближение применяют в том случае, когда одна из реакций — обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, что k2 . + H . + M (k1)
H . + п-H2 
H . + H . + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества — атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
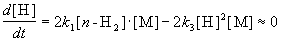
откуда 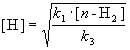
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
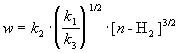
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2. Механизм ренатурации ДНК из двух ветвей спирали имеет вид:
Предполагая, что первая стадия — быстрая, а вторая — медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение. Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
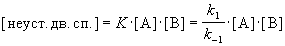
Скорость реакции определяется скоростью второй стадии:
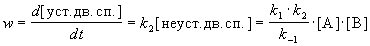
Образование устойчивой двойной спирали ДНК — реакция второго порядка с эффективной константой скорости k = k1 . k2 / k-1.
6-1. Механизм некоторой ферментативной реакции имеет вид:
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.(ответ)
6-2. Для реакции NO2Cl 
NO2Cl 
NO2Cl + Cl . 
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 
I2 
2I . 
2I . + H2 
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A 
дезактивация: A + A* 
распад: A* 
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5. Для тримолекулярной реакции 2NO + O2 
2NO 
(NO)2 + O2 
Определите порядок суммарной реакции, предполагая, что первая стадия — быстрая, а вторая — медленная.(ответ)
6-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O — . Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B 
A — + BH + 
A — + AH 
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
A 

Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях — по второму порядку.(ответ)
6-8. Химическая реакция N2O 
N2O + M 
N2O* 
N2O* + M 
N2O + O . 
Считая концентрации N2O* и O . стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + N2O5 
6-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + NO3 
Указание. Интермедиаты — NO и NO3.(ответ)
6-11. Дана схема цепной реакции:
AH 
A . 
AH + B . 
A . + B . 
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12. Дана кинетическая схема:
CH4 + M 
CH3 . + CH4 
H . + CH4 
H . + CH3 . + M 
(M — инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
6-13. Реакция разложения бромметана 2CH3Br 
CH3Br 
CH3 . + CH3Br 
Br . + CH3Br 
2CH3 . 
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 
R . + R2 
R’ . 
2R . 
где R2, PA, PB — устойчивые углеводороды, R . и R’ . — радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.(ответ)
6-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO 
CH3 . + CH3CHO 
CH2CHO . 
CH3 . + CH3 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 
развитие цепи: CH3 . + CH3CH3 
CH3CH2 . 
H . + CH3CH3 
обрыв цепи: H . + CH3CH2 . 
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17. Дана кинетическая схема дегидрирования этана:
C2H6 
CH3 . + C2H6 
C2H5 . 
H . + C2H5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18. Химическая реакция 2C2H6 
C2H6 
H . + C2H6 
C2H5 . + C2H6 
2C2H5 . 
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 
Cl . + C2Cl4 
C2Cl5 . + Cl2 
2C2Cl5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20. Реакция образования фосгена CO + Cl2 
Cl2 
2Cl . 
CO + Cl . 
COCl . 
COCl . + Cl2 
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Please wait.
Видео:Составляем кинетические уравненияСкачать

We are checking your browser. gomolog.ru
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Кинетика || Лекция 4 || Реакции второго порядка, общий интеграл кинетического уравненияСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df095852f5f4c67 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Здравствуйте, помогите решить с полным ответом.
1) Напишите кинетическое уравнение реакции:
S (тв) + 2N2O (г) = SO2 (г) + 2N2 (г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию оксида азота (I) в 3 раза; в) уменьшить концентрацию оксида азота (I) в 5 раз.
2) В каком направлении будет происходить смещение равновесия реакции
CO2 (г) + 4H2 (г) = CH4 (г) + 2H2O (г); ∆H^0 = — 164,7 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию водорода.
💥 Видео
ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Скорость реакции. Химия – ПростоСкачать

ЛЕКЦИЯ №1 || Химическая кинетика || Основные понятия, элементарный акт, стехиометрическое уравнениеСкачать

Введение в кинетикуСкачать

How to balance CH4 + O2 = CO2 + H2O (METHANE COMBUSTION REACTION)Скачать

Урок 134. Применения уравнения Бернулли (ч.1)Скачать

Химия | Cкорость химической реакцииСкачать

Как сбалансировать C2H4 + O2 = CO2 + H2O: реакция горения этиленаСкачать

25. Схема реакции и химическое уравнениеСкачать

Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

Кинетика || Лекция 2 || Химическая переменная, скорость реакции, ЗДМ, порядок реакцииСкачать
ЛЕКЦИЯ №3 || Химическая кинетика || Реакции первого, второго и произвольного порядкаСкачать

257. Как изменится скорость хим реакции, если увеличить концентрацию одного из реагирующих веществСкачать