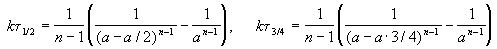6.1. Примеры решения типовых задач
Пример 1. Как изменится начальная скорость простой реакции образования NOСl2
2NO(г)+ Cl2(г) = 2NOCl2(г), если уменьшить объем газовой смеси в 2 раза? Решение. Скорость данной реакции равна
Если обозначить концентрации NO и Cl2 до изменения объема,
соответственно, через a и b, тогда υ = k ·a2·b.
В результате уменьшения объема в 2 раза концентрации NO и
Cl2 увеличиваются в 2 раза, и скорость реакции станет равна
υ *= k (2a)2 · 2b = 8 k ·a2·b = 8 υ .
Тогда υ */ υ = 8. Таким образом, скорость реакции увеличится в 8
Пример 2. Скорость разложения вещества А описывается кинетическим уравнением первого порядка. Определить концентрацию вещества А через 100 с после начала реакции, если известно, что начальная концентрация его составляла 0,01 моль/л, а константа скорости равна 0,023 с-1.
Решение. Используя интегральное кинетическое уравнение реакции первого порядка (2.9), имеем
ln[A]t = ln0,01 – 0,023 ⋅100;
ln[A]t = – 6,9; [A]t =0,001 моль/л.
Пример 3. Определить, за какое время израсходуется 90% исходного вещества, если известно, что скорость реакции описывается кинетическим уравнением первого порядка, а константа скорости равна 4,6 ⋅ 10-2 с-1.
Решение. Если вещества А было 100%, израсходовано 90%
(конверсия вещества), то к времени t останется 10% вещества. Подставляя эти значения в уравнение (2.9), найдем
ln10 = ln100 – 4,6 ⋅ 10-2 ⋅t
Пример 4. Известно, что скорость разложения вещества А описывается кинетическим уравнением первого порядка. Определить концентрацию вещества через 100 с после начала реакции, если известно, что исходная концентрация его была 0,4 моль/л, а время полупревращения
Решение. Для нахождения константы скорости реакции воспользуемся уравнением (2.12)



Тогда концентрация через 100 с после начала реакции
ln[A]t = ln 0,4 – 0,0231.100 = – 0,916 – 2,31 = – 3,226 [A]t = е 3,226 = 0,0397 моль/л.
Пример 5. Для некоторой реакции
n А + m В → продукты,
проводимой при различных исходных концентрациях реагирующих
веществ, экспериментально определяли скорость реакции: сначала при различных концентрациях вещества В и фиксированной концентрации вещества А (опыты 1-3), затем при различных начальных концентрациях А и постоянной концентрации В (опыты 4-6). Полученные данные представлены в табл. 1.
Определить вид дифференциального кинетического уравнения и константу скорости реакции.
Решение. Зависимость начальной скорости от концентрации для данной реакции выражается дифференциальным кинетическим уравнением
Прологарифмируем это выражение
ln υ = lnk + nln[A] + mln[B].
Величины k, n и m для рассматриваемой реакции (при Т= const)
являются постоянными и не зависят от концентрации реагентов.
Так как в трех опытах (1-3) концентрация вещества А постоянна (обозначим ее [A]0), то в уравнении сумма (lnk + nln[A]0) будет тоже величиной постоянной. Обозначим ее
Тогда уравнение можно переписать так:
Зависимость представляет собой в координатах ln[B] — ln υ
уравнение прямой линии, тангенс угла наклона которой к оси абсцисс
равен порядку реакции по веществу В.
В табл. 2 представлены значения логарифмов концентраций и скоростей для опытов (1-6).
По результатам опытов (1-3) построим график зависимости
ln υ от ln[B] (рис. 13) и найдем порядок реакции по веществу B




Рис. 13. Определение порядка реакции по веществу В
В последующих опытах (4-6) концентрация вещества B остается постоянной ([B]= [B]0), поэтому
По результатам опытов (4-6) построим график зависимости
ln υ от ln[А] (рис. 14) и найдем порядок реакции по веществу А




Рис.14. Определение порядка реакции по веществу А
Таким образом, зависимость скорости от концентрации для исследуемой реакции
В этом уравнении порядок реакции по веществу B равен 2, а порядок реакции по веществу A равен 1. Сумма порядков по реагирующим веществам, равная 3, дает общий порядок реакции.
Для определения константы скорости прологарифмируем дифференциальное кинетическое уравнение с учетом полученных порядков реакции по веществам A и B
lnk = ln υ – ln[А] – 2 ln[В].
Вычислив константу скорости реакции для каждого опыта (в
табл. 3 представлены данные для трех опытов), найдем среднее значение константы
= 0,3998 + 0,4000 + 0,3998 ≈ 0,4

Таким образом, дифференциальное кинетическое уравнение имеет вид
Пример 6. Определить энергию активации Еа реакции, для которой при повышении температуры от 22 до 32 °C константа скорости
возрастает в 2 раза.
Решение. Запишем уравнение Аррениуса для двух температур в


В результате вычитания первого уравнения из второго, получим
E = R ⋅ 1 2 ⋅ ln 2 .
Отношение k2 /k1= 2 по условию. Переводим температуру в Кельвины и подставляем значения в уравнение

⋅ ln 2 = 51826 Дж/моль .
Пример 7. Энергия активации некоторой реакции при отсутствии катализатора равна 75 кДж/моль, а с катализатором 50 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора,
если реакция протекает при 25°C?
Решение. Обозначим энергию активации реакции без катализакaт
Ea , а с катализатором – через Ea
; соответствующие константы скорости реакции обозначим через k и
k кaт . Предположим,
что величина А для данной реакции постоянна и не зависит от присутствия катализатора. Используя уравнение Аррениуса, находим

В результате вычитания первого уравнения из второго

Подставляя в последнее уравнение данные задачи, выражая энергию активации в Джоулях и учитывая, что Т= 298 К, получим


Таким образом, в присутствии катализатора скорость реакции
возрастет в 24 тысячи раз.
Пример 8. Приведенные ниже данные соответствуют температурной зависимости константы скорости реакции, имеющей первый порядок
Температура T, К
Определите энергию активации и значение предэкспоненциального множителя. Рассчитайте константу скорости при температуре
Решение. Согласно уравнению Аррениуса зависимость константы скорости от температуры имеет вид

поэтому необходимо построить график зависимости

Рис.15. Определение энергии активации
Энергию активации можно определить из тангенса угла наклона прямой (рис. 15)




= 8,31⋅ 7143 = 59358
Определим значения предэкспоненциального множителя. Для
произвольной точки на прямой зависимости


а, найдем соответствующие ей значения:
Еa в уравнение Аррениуса

− 4,5 = ln A − 59358 ⋅ 0,00337 ,

Подставляя найденные значения энергии активации и предэкспоненциального множителя в уравнение Аррениуса, получим зависимость константы скорости от температуры



Найдем значение константы скорости при температуре Т=303К

или по уравнению



Можно определить константу скорости и непосредственно из
графика (рис.15). Отложив на оси


находим по графику
Пример 9. Константа равновесия реакции А + В ↔ C + D равна единице. Исходные концентрации: [А]0 = 0,01моль/л, [В]0 =0,03
моль/л. Определить равновесные концентрации всех четырех веществ.
1. Пишем уравнение реакции.
2. Для каждого из участников реакции записываем начальные концентрации исходных веществ (в моль/л). Т.к. начальные концентрации продуктов реакции не оговариваются в условии задачи, то принимаем их равными нулю.
3. По уравнению реакции определяем изменение концентраций всех веществ к моменту достижения равновесия. Из уравнения реакции видно, что из каждого моля А и В образуется по одному молю С и D.
4. Принимаем, что в ходе реакции к моменту достижения равновесия прореагировало x моль/л вещества А. Если прореагирует х молей А, то должно прореагировать также х молей В, в то же время должно образоваться по х молей С и D.
5. Определяем равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
состояние 0,01 0,03 0 0
по уравнению 1 1 1 1
концентраций x x x x
состояние 0,01 – x 0,03 – x x x
6. Пишем выражение закона действующих масс. Подставляем в него найденные значения равновесных концентраций.


7. Решаем уравнение. При этом учитываем, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации. х = 0,0075 моль/л.
8. Находим равновесные концентрации.
[А] = [А]0 – x = 0,01 – 0,0075 = 0,0025 моль/л; [B] = [B]0 – x = 0,03 – 0,0075 = 0,0225 моль/л; [C] = x = 0,0075 моль/л;
[D] = x = 0,0075 моль/л.
Пример 10. В системе А(г) + В(г) ↔ 2С(г) равновесные концентрации равны: [А] = 0,018 моль/л, [В] = 0,011 моль/л, [С] = 0,016
моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением


Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моля А и 1 моля В образуется 2 моля С. Поскольку по условию задачи в каждом литре системы образовывалось 0,016 моля вещества С, то при этом было израсходовано
0,008 моля вещества А и 0,008 моля вещества В.
по уравнению 1 1 2
концентраций 0,008 0,008 0,016
состояние 0,018 0,011 0,016
Таким образом, исходные концентрации равны:
[А]0 = 0,018 + 0,008 = 0,026 моль/л; [В]0 = 0,011 + 0,008 = 0,019 моль/л.
Пример 11. Химическое равновесие гомогенной реакции
протекающей при T = const, установилось при следующих концентрациях реагирующих веществ: [А] = 0,4 моль/л; [В] = 0,2 моль/л; [D]=
=0,4 моль/л. Затем концентрацию вещества B увеличили до 0,5
моль/л. Рассчитайте новые равновесные концентрации реагирующих веществ.
Решение. Вычислим константу равновесия данной реакции:
После добавления вещества B возникло новое состояние системы с концентрациями [А]=0,4 моль/л; [В] = 0,5 моль/л; [D] = 0,4 моль/л.
В соответствии с принципом Ле Шателье при увеличении концентрации [В] равновесие сместится в сторону прямой реакции.
Движение системы к новому состоянию равновесия должно сопровождаться увеличением концентрации D и снижением концентрации A и B.
Если концентрация вещества A снизится на x моль/л, то в соответствии с уравнением реакции концентрация вещества B должна уменьшиться на такую же величину и концентрация вещества D – увеличиться на 2x моль/л. Тогда равновесные концентрации будут
равны: [А] = 0,4 – x; [В] = 0,5 – x; [D] = 0,4 + 2 x.
Реакция протекает при постоянной температуре, следовательно,
константа равновесия Kc
останется прежней, равной 2. Подставляем
новые равновесные концентрации реагирующих веществ в выражение константы равновесия:
состояние 0,4 0,2 0,4
Состояние системы после добавления
вещества B 0,4 0,5 0,4
по уравнению 1 1 2
концентраций x x 2x
состояние 0,4 – x 0,5 – x 0,4 + 2x
Новые равновесные концентрации:
[А] = 0,4 – x = 0,4 – 0,07 = 0,33 моль/л;
[В] = 0,5 – x = 0,5 – 0,07 = 0,43 моль/л;
[D] = 0,4 + 2 x = 0,4 + 0,14 = 0,54 моль/л.
Если в качестве проверки подставить значения новых равновесных концентраций в выражение константы равновесия, получим


Пример 12. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
PCl5 (г) ↔ PCl3 (г) + Cl2 (г); ΔН = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрации
реагирующих веществ, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
Решение. В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия.
1. Смещение равновесия при изменении температуры связано с тепловым эффектом реакции. Так как рассматриваемая реакция эндотермическая (ΔН > 0), то для смещения равновесия в сторону прямой
реакции нужно повысить температуру.
2. Так как в данной реакции разложение PCl5 ведет к увеличению объёма (из одного моля газа образуются два), то для смещения равновесия в сторону прямой реакции надо уменьшить давление.
3. Чтобы сместить равновесие в сторону прямой реакции, необходимо увеличить концентрацию PCl5.
6.2. Задачи для домашнего задания
1. Как изменится начальная скорость простой реакции, если:
2А(г) + В(г) → А2В(г) реакция для №1.1-1.8
концентрацию вещества А увеличить в 2 раза
концентрацию вещества В увеличить в 2 раза
увеличить давление в системе в 3 раза
уменьшить объем системы в 2 раза
уменьшить концентрацию веществ А и В в 3 раза
снизить давление в системе в 4 раза
увеличить объем системы в 2 раза
уменьшить концентрацию вещества А в 2 раза
А(г) + В(г) → АВ(г) реакция для №1.9-1.16
концентрацию вещества А увеличить в 2 раза
концентрацию вещества В увеличить в 2 раза
увеличить давление в системе в 3 раза
уменьшить объем системы в 2 раза
уменьшить концентрацию веществ А и В в 3 раза
снизить давление в системе в 4 раза
увеличить объем системы в 2 раза
уменьшить концентрацию вещества А в 2 раза
2. Скорость разложения вещества А описывается кинетическим уравнением первого порядка. Определить начальную концентрацию вещества [А]0, концентрацию вещества через t секунд
после начала реакции [A]t, константу скорости реакции k, время
Видео:Составляем кинетические уравненияСкачать

Практическое занятие 5, 6 «Методы кинетико-термодинамического анализа сложных химических реакций» (4 часа)
Практическое занятие 5, 6 «Методы кинетико-термодинамического анализа сложных химических реакций» (4 часа)
План занятия: Основные типы сложных реакций, кинетика обратимых реакций, кинетика параллельных реакций, кинетика последовательных реакций. Решение задач.
Сложной реакцией называют совокупность одновременно протекающих одностадийных реакций, в результате которых происходит превращение реагентов в продукты. В ходе сложной реакции часто образуются промежуточные вещества, которые подвергаются дальнейшему превращению. Часто — это активные частицы с неспаренными электронами — так называемые радикалы.
Большинство реакций являются сложными и состоят из нескольких элементарных стадий. Все многообразие сложных реакций можно свести к комбинации нескольких типов реакций: обратимые (двусторонние); параллельные; последовательные и др.
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости (1.17): если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Кинетика обратимых реакций
При протекании обратимых химических реакций необходимо учитывать принцип детального равновесия:
при равновесии скорость прямой реакции для каждой стадии равна скорости обратной реакции.
Рассмотрим этот принцип на примере следующего процесса. Пусть превращение А в B происходит как без участия ионов водорода, так и при их участии по схеме:
Для скорости образования вещества В можно записать кинетическое уравнение:
Поскольку при равновесии

Возникает кажущееся противоречие, так как константа равновесия не должна зависеть от концентрации ионов водорода. Парадокс устраняется, если использовать принцип детального равновесия. Согласно этому принципу, при равновесии скорости прямой и обратной реакций для каждого пути в отдельности должны быть равны. Следовательно, при равновесии справедливы равенства:
Тогда из (4.4) и (4.5) получим:
Подставляя k1= Kk2 и k 3= Kk 4 в (4.3) получим тождество K = K и, таким образом, противоречие будет снято.
Простейшими обратимыми реакциями являются изомерные превращения: переход цис-формы в транс-форму, изменение положения кратной связи в насыщенных соединениях, их циклизация-дециклизация, кето-енольная и другие виды таутомерии. Рассмотрим несколько примеров описания кинетики обратимых реакций с использованием принципа детального равновесия.
1. Обратимые реакции первого порядка состоят из прямой и обратной элементарных реакций первого порядка:
Общая скорость реакции равна разности скоростей прямой и обратной реакций: v = v1- v2 . Если начальные концентрации веществ А и В обозначить соответственно а и b, а концентрации в любой момент времени сА = а – х и cВ = b + х, то в дифференциальной форме уравнения кинетики имеют вид:
где х — убыль вещества А или прибыль вещества В к моменту времени t; k1 — константа скорости прямой реакции; k2 — константа скорости обратной реакции.
В момент равновесия скорость обратимой реакции равна нулю. Поэтому k1(a — x) = k2 + x) , откуда(b
где K — константа равновесия данной химической реакции; х∞ — убыль вещества А или прибыль вещества В к моменту равновесия.
Из этого уравнения можно выразить х∞:
Преобразуя уравнение (4.6), получим:
Интегральная форма этого уравнения имеет вид:
Уравнение для обратимой реакции первого порядка имеет такой же вид, как и для необратимой реакции первого порядка, с той лишь разницей, что вместо начальной концентрации фигурирует равновесная концентрация, а константу скорости заменяет сумма констант скоростей прямой и обратной реакции.
Кинетические кривые для обратимых реакций первого порядка приведены на рис. 4.1.
2. Типичным примером обратимой химической реакции, в которой обе реакции второго порядка, является реакция омыления сложного эфира:
Схема такой реакции
Рассмотрим решение задачи для случая, когда продукты реакции до начала реакции в реакционной смеси отсутствуют: cА,0 = cB,0 = а и cC,0 = cD,0 = 0. Аналогично предыдущему пункту уравнение скорости химической реакции можно записать в виде:
При достижении состояния равновесия выполняется следующее условие:
С учетом уравнения (4.13) уравнение скорости химической реакции запишется как:
Полином допускает наличие двух корней квадратного уравнения
Его записывают через произведение вида m(х – х1)(х – х2). Тогда уравнение скорости химической реакции запишется как:
Интегральная форма этого уравнения имеет вид:
Константы скоростей k1 и k2 можно определить из опытного значения кажущейся константы скорости:
Кинетика параллельных реакций
К параллельным реакциям относятся химические превращения, когда взятое для реакции вещество претерпевает изменение одновременно в двух и более направлениях.
К таким реакциям относятся, например, гидролиз сложных эфиров дикарбоновых кислот, или взаимодействие серной кислоты со смесью оксидов металлов. Рассмотрим несколько примеров кинетики таких реакций.
1. Из одного вещества получаются два новых:
Введем обозначения: а — начальная концентрация вещества А, х — изменение концентрации этого вещества к моменту времени t; у — концентрация вещества В; z — концентрация вещества C в момент времени t.
Тогда кинетическое уравнение записывается с учетом принципа независимости (rAv= -1 — v2):
Решение уравнения (4.18) имеет вид:
Откуда концентрация исходного вещества в любой момент времени t равна:
Тогда можно выразить изменение концентрации продуктов реакции:
Интегрирование уравнений (4.23) и (4.24) в пределах от 0 до t и, соответственно, от 0 до y и z дает:
Из уравнений (4.25) и (4.26) следует что, для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется отношением констант скоростей элементарных стадий:
Кинетические кривые для случая двух параллельных реакций первого порядка приведены на рис. 4.2.
2. Рассмотрим случай, когда параллельные реакции являются реакциями второго порядка.
Такой процесс можно представить общей схемой:
Если обозначить a и b начальные концентрации веществ A и B, то кинетическое уравнение в дифференциальной форме можно представить как:
Интегрирование этого уравнения позволяет оценить сумму констант скоростей:
Отношение концентраций продуктов, как и в первом случае, не зависит от времени и определяется отношением констант скоростей.
Кинетика последовательных реакций
Расчет кинетики последовательных реакций в общем виде довольно сложен, так как если процесс состоит из двух или нескольких последовательных реакций, то кинетика его описывается системой дифференциальных уравнений. Только для более простых реакций с последовательными стадиями первого порядка удается получить аналитические выражения для концентрации веществ в явном виде.
Примером такой простой последовательной реакции может служить гомогенная реакция в закрытой системе с двумя односторонними мономолекулярными элементарными стадиями (первого порядка):
Примерами таких реакций являются, в частности, радиоактивные превращения веществ или нуклеофильные замещения в ароматических соединениях.
Рассмотрим случай, когда константы скорости k1 и k2 двух последовательных стадий различаются не более чем на один порядок и, следовательно, обе стадии являются лимитирующими.
Решим прямую задачу, т. е. найдем зависимость концентрации от времени для всех трех веществ, считая известными механизм реакции и константы скорости обеих стадий:
Пусть в начальный момент времени t = 0 имеется а молей вещества А, а вещества В и С отсутствуют. Если к моменту времени t прореагировало х молей вещества А, то осталось cA = (а – х) молей. Обозначим через у количество В, превратившееся к этому времени в С. Следовательно, вещества В имеется cB = (х – у) молей, а вещества С имеется у молей.
Скорость превращения вещества А можно выразить:
или на основе формальной кинетики:
Интегрирование этого уравнения от 0 до t и от 0 до х приводит к следующим выражениям:
Скорость превращения вещества B описывается уравнениями:
Подставляя значение х из (4.32) в (4.33) и интегрируя полученное уравнение от 0 до t и от 0 до у, получаем:
Вычитая уравнение (4.34) из (4.32), получим:
Зависимость концентрации веществ от времени в системе двух последовательных реакций первого порядка приведена на рис. 4.3.
Как видно из рисунка, изменение концентрации промежуточного вещества во времени представляет собой кривую с максимумом. Величина этого максимума определяется различием в значениях констант:
При решении обратной задачи по кинетическим кривым необходимо определить k1 и k2. Константу скорости k1 легко можно определить на основании уравнения (4.31). Однако определение k2 несколько сложней, так как уравнение (4.35) является транцедентным, из которого в явном виде выразить k2 нельзя. Для расчета k2 лучше воспользоваться уравнениями (4.36) или (4.37), которые решаются численно. Для этого, зная k1, экспериментально определяют максимум концентрации вещества B, а затем рассчитывают k2.
Рассмотрим полезные соотношения между концентрациями В, С и А в случае, если лимитирующей стадией процесса является реакция с константой скорости k1.
Переходное равновесие. Если k2 >> k1, то после длительного промежутка времени выражение (4.35) упрощается:
Поделив уравнение (4.38) на (4.31), получим выражение для так называемого переходного равновесия:
То есть в стационарном состоянии отношение концентраций
В этом случае отношение концентраций
Вековое равновесие. Если k2 >> k1, то в уравнении (4.39) можно пренебречь в знаменателе k1, тогда получим уравнение, называемое вековым равновесием:
где t1 и t2 — средние времена жизни; t1/2(1) и t1/ 2(2) — периоды полураспада, соответственно, веществ А и В. В этом случае при t ®∞ сс/а=1.
Примеры решения задач
Пример 1. Реакция изомеризации β-оксикротонового эфира в ацетоуксусный эфир
при 25 °С протекает как в прямом, так и в обратном направлении. Изменение концентрации β-оксикротонового эфира во времени приведено в таблице.
В начальный момент времени ацетоуксусный эфир в системе отсутствовал. После установления равновесия в системе концентрация β-оксикротонового эфира составила 0,078 моль/дм3. Рассчитать константы скоростей прямой и обратной реакций.
Решение. Реакция изомеризации β-оксикротонового эфира в ацетоуксусный эфир относится к реакциям первого порядка.
1. Значения х и х∞, очевидно, можно рассчитать по соотношениям:
где (c0 – х) — концентрация исходного вещества для времени t.
Отсюда х∞ = 0,366 – 0,078 = 0,288 моль/дм3. Рассчитаем значения х∞ – х в разные моменты времени:
2. Сумму констант скоростей прямой и обратной реакции рассчитаем по формуле (4.10):
Рассчитаем k1 + k2 для различных моментов времени t:
Последние значения (k1 + k2) можно отбросить, так как точность расчета в значительной степени зависит от точности измерения концентрации при t®∞. Среднее значение (k1 + k2) = 0,005126 ч–1.
3. Константу равновесия реакции рассчитаем по соотношению (4.7):
4. Значения каждой из скоростей реакции k1 и k2 можно определить, решив систему уравнений:
Пример 2. Реакция взаимодействия гидропероксидов (ROOH) с кетонами представляет собой обратимую химическую реакцию, протекающую по схеме
Константа скорости прямого процесса k1 = 1 · 10–3 дм3/(моль с), константа равновесия K=
k1/k2 = 8 дм3/моль. Вычислить константу скорости обратной реакции и концентрации веществ А, В и С к моменту равновесия, если cA,0 = cB,0 = 0,02моль/дм3, а C c,0 =0 .
Решение. Значение константы скорости обратной реакции вычислим как
В момент равновесия
Это уравнение преобразуется к виду:
Решением этого квадратного уравнения является два корня: x∞ 1= 0,00246 моль/дм3 и x∞2 = 0,163 моль/дм3. Физический смысл имеет только первый корень.
Концентрации веществ A и B к моменту равновесия станут равны 0,0175 моль/дм3, а концентрация вещества C — 0,00246 моль/дм3.
Пример 3. Уксусная кислота при температуре 700 °С разлагается одновременно по двум направлениям:
Период полураспада уксусной кислоты не зависит от начальной концентрации и равен 0,087 с. Отношение числа молей образовавшихся метана и кетена в любой момент времени равно 0,8. Рассчитать значение суммарной константы скорости и значения констант скоростей каждой из реакций.
1. Определим порядок реакции разложения уксусной кислоты и суммарную константу скорости. Так как период полураспада не зависит от начальной концентрации, то это означает, что реакция разложения уксусной кислоты имеет порядок реакции равный единице. Общую
константу скорости можно рассчитать, исходя из времени полуреакции:
2. Для параллельных реакций справедливо соотношение:
3. Зная сумму констант и их отношение, рассчитаем каждую из констант:
Пример 4. Разложение оксида азота (II) при 1300 К протекает по двум параллельным реакциям:
Начальная концентрация оксида азота (II) равна 4 моль/дм3. Через 0,02 с она изменяется на 77,85 %. Отношение концентраций N2 и N2O в любой момент времени равно 1,4. Рассчитать значения констант скоростей, считая, что этот процесс является реакцией второго порядка.
Решение. По условию задачи через 0,02 с разложится 4×0,7785 = 3,114 моль/дм3 оксида азота (II), а останется (4 – 3,114) = 0,886 молей.
Кинетическое уравнение для разложения оксида азота (II) при протекании параллельных химических реакций в случае реакции второго порядка имеет вид:
Это уравнение позволяет рассчитать сумму констант скоростей:
Для параллельных химических реакций отношение концентраций продуктов реакции в любой момент времени равно отношению констант скоростей:
k2 = 18,3 дм3/моль с; k1 = 25,6 дм3/моль с.
Задачи для самостоятельного решения
1. Цис-транс-изомеризация стильбена (1,2-дифенилэтилена) — обратимая реакция первого порядка. Рассчитайте значения средних констант скоростей прямой и обратной реакций, используя следующие экспериментальные данные:
2. Реакция взаимодействия этанола с соляной кислотой
протекает в органическом растворителе, содержащем 80 % этанола и отвечает обратимой реакции первого порядка типа 
Определите численные значения констант скоростей k1 и k2.
3. Кинетика реакции этерификации этанола муравьиной кислотой
отвечает реакции первого порядка в обоих направлениях (изучение проводили при большом избытке этанола и воды). При температуре 25 °С константы скорости реакций, соответственно, равны: k1 = 1,85 · 10–3 мин–1, k2 = 1,76 · 10–3 мин–1. Начальная концентрация муравьиной кислоты равна 0,1 М. Рассчитайте процентное содержание образующегося продукта (этилформиата) при достижении равновесия и вычислите время, необходимое для протекания реакции этерификации на 80 % от равновесного состояния.
4. Образец радиоактивного урана массой 100 г распадается по схеме
(над стрелкой указаны периоды полураспада). Рассчитайте массы нептуния и плутония через: а) 20 мин; б) 20 суток после начала распада.
5. Реакция превращения γ-оксимасляной кислоты в лактон представляет собой обратимую реакцию первого порядка как в прямом, так и в обратном направлениях (концентрация воды постоянная):
Начальная концентрация γ-оксимасляной кислоты была равна 0,1823 моль/дм3. Ниже приведены данные изменения концентрации лактона во времени:
Рассчитайте константу равновесия данной реакции и значения констант скоростей прямой и обратной реакций.
протекает при 0 °С и может быть представлена общей схемой:
Начальная концентрация вещества А была равна 0,0348 моль/дм3; константы скоростей равны: k1 = 1,78 · 10–3 с–1 и k2 = 5,80 · 10–5 с–1. Рассчитайте концентрации всех участников реакции к моменту времени t = 500 с. Вычислите время достижения максимума концентрации промежуточного вещества В.
7. Реакция взаимодействия уксусной кислоты (c0 = 1.00 моль/дм3) с этиловым спиртом проводилась в среде 40%-го этилового спирта. Образованию этилацетата соответствует уравнение реакции:
Кинетику этой реакции изучали, титруя 1,00 см3 раствора 0,0612 моль/дм3 NaOH. Получены следующие результаты:
Рассчитайте константу равновесия и константы скоростей прямой и обратной реакций.
была измерена доля распавшегося HI при различных временах нагревания:
Начальная концентрация иодистого водорода была равна 0,0446 моль/дм3. Рассчитайте константу равновесия данного процесса и значения констант скоростей прямого и обратного процессов.
9. Реакция разложения изопропилового спирта протекает в присутствии катализатора (триоксида ванадия) при 588 К по следующей схеме:
Концентрации веществ, измеренные через 4,3 с после начала опыта, оказались следующими: c (C3H7OH) = 0,0274 моль/дм3; c (C3H6O) = 0,0075 моль/дм3; c (C3H6) = 0,081 моль/дм3; c (C3H8) = 0,017 моль/дм3. Рассчитайте константу скорости каждой из стадий реакции.
10. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению реакции первого порядка (спирт взят в большом избытке):
Константа равновесия этой реакции равна 1,05. За изменением концентрации кислоты следили путем титрования проб одинакового объема:
Концентрация продукта реакции в начальный момент времени равна нулю. Вычислите численные значения констант скоростей k1 и k2 в этом растворе.
11. Превращение роданида аммония в тиомочевину — обратимая реакция первого порядка
Экспериментально оценивалась доля NH4 SCN (a), прореагировавшего к моменту времени t. Рассчитайте скорости прямой и обратной реакций, используя следующие экспериментальные данные:
12. В газовой фазе протекает реакция
Для опыта были взяты 2 моля газа А. Константы скоростей отдельных стадий реакции соответственно равны: k1 = 18 · 10–2 с–1 и k2 = 2 · 10–3 с–1. Рассчитайте количества молей каждого газа к моменту времени t = 180 с. Какого из веществ в газовой смеси будет больше к этому моменту времени?
13. Реакция разложения вещества А может проходить параллельно по трем направлениям:
Начальная концентрация вещества А была равна 5 моль/дм3. Через десять минут от начала реакции концентрация вещества B стала равной 1 моль/дм3, а соотношение концентраций продуктов C и D — С : D = 6 : 1. Период полураспада вещества А равен 8 мин. Определите константы скоростей k1, k2 и k3.
14. Муравьиная кислота на окисных катализаторах разлагается в соответствии со схемой:
В одном из опытов за 15,4 c выход CО2 составил 77,5 % от теоретического, а СО — 2,6 %. Вычислите константы скоростей дегидратации и дегидрирования муравьиной кислоты.
15. В газовой фазе протекает реакция
Для опыта были взяты 5 молей газа А. Константы скоростей отдельных стадий реакции соответственно равны: k1 = 18 · 10–2 с–1 и k2 = 2 · 10–3 с–1. Рассчитайте, к какому моменту времени концентрация вещества В будет максимальна. Какова будет концентрация веществ А и С к этому моменту времени?
16. Разложение закиси азота при 1300 К протекает по двум параллельным реакциям:
Начальная концентрация закиси азота равна 4 моль/дм3. Сколько азота и закиси азота образуется через 0,1 с, если константы скорости параллельных реакций имеют следующие значения: k1 = 25,7 дм3/(моль с) и k2 = 18,27 дм3/(моль с)?
17. В системе протекают две параллельные реакции:
Отношение k1 / k 2= 5. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50 % вещества В. Какая часть вещества С прореагировала к этому времени?
18. Термическое разложение циклобутанона приводит к образованию смеси продуктов, согласно реакции
Начальное количество циклобутанона равно 10 моль. При температуре 383 К отношение концентраций С2Н4 и С3Н6 в любой момент времени протекания процесса оставалось постоянным и равным 125. Через 50 с от начала реакции в газовой смеси содержалось 0,7 молей СО. Рассчитайте значения констант скоростей обоих процессов.
19. Реакция этерификации этилового спирта уксусной кислотой
является обратимой химической реакцией второго порядка в обоих направлениях. При определенной температуре для начальных концентраций обоих реагентов, равных 1 моль/дм3, было установлено, что концентрация образующегося эфира равна 0,25 моль/дм3 через t = 65 сут и 2/3 моль/дм3 — при установлении равновесия (t ® ∞). Рассчитайте константу равновесия данного процесса и значения констант скоростей прямого и обратного процессов.
20. Константа равновесия реакции
при температуре 2400 К и p = 1,013 · 105 Па равна 398,4, а константа скорости k1 = 6,03×109 дм3/(моль с). Рассчитайте константу скорости k2 данной реакции и концентрацию всех компонентов к моменту времени t = 200 с, если начальное давление NO равно 2,026 × 103 Па.
21. Реакция взаимодействия гидропероксидов (ROOH) с кетонами представляет собой обратимую химическую реакцию, протекающую по схеме
Константа скорости прямого процесса k1 = 1 · 10–3 дм3/(моль с), константа равновесия K = 7 дм3/моль. Вычислите концентрацию веществ А, В и С через 10 ч от начала реакции и к моменту равновесия, если c A 0= c B 0=0,03 моль/дм3, а c C0 = 0 .
22. С помощью масс-спектрометрического метода изучалась кинетика реакций:
Было найдено, что отношение констант скоростей отвечает соотношению k1 : k2 : k3 = 0,62 : 0,11 : 0,27. Оцените отношение концентраций продуктов реакции ко времени t.
23. Константы скоростей прямой и обратной реакций соответственно равны 2 с–1 и 30 с–1. Исходные концентрации веществ А и В взяты равными 0,04 моль/дм3. Найдите концентрации этих веществ через 0,04 с.
при температуре Т протекают параллельно. Вычислите константы скорости каждой реакции, если концентрации, измеренные в одном из опытов продолжительностью 240 мин, следующие (этилен взят в избытке):
Видео:Скорость химических реакций. 9 класс.Скачать

Кинетические уравнения реакции 2а в имеющей константу скорости 0 018 с 1 имеют вид
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
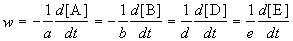
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
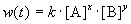
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
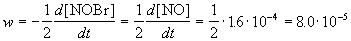
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
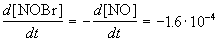
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
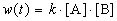
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
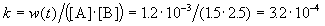
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
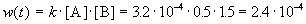
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
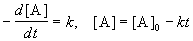
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
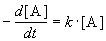
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
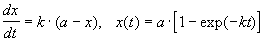
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
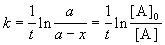
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
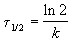
Реакции 2-го порядка. В реакциях типа A + B 
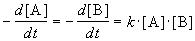
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
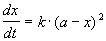
Решение этого уравнения записывают в различных формах:
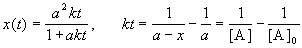
Период полураспада веществ A и B одинаков и равен:
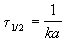
2) Начальные концентрации веществ A и B различны: a 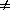
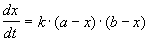
Решение этого уравнения можно записать следующим образом:
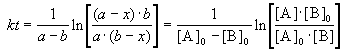
Периоды полураспада веществ A и B различны: 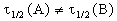
Реакции n-го порядка nA 
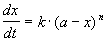
Решение кинетического уравнения:
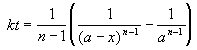
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
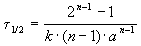
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
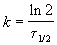
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
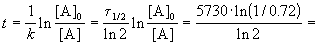
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
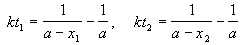
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
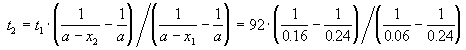
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
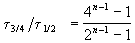
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
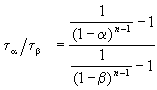
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
🔥 Видео
Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Химическая кинетика / Скорость химической реакцииСкачать

Скорость химической реакции/ Страницы 147 - 154/ № 1 - 85/Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Скорость химической реакции. Гомо- и гетерогенные реакции. Механизм реакции.Скачать

Скорость реакции. Химия – ПростоСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

6 Уравнение Аррениуса, ч 2Скачать

Решение задач по теме Скорость химической реакцииСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Химия, 12-й класс, Скорость химических реакций. Закон действующих массСкачать

Вычисление константы скорости реакции | Задачник по химии ГлинкаСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать