При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n + , OH — и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H + ½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что 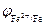
анод (Fe): Fe 0 ® Fe 2+ + 2ē
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe 0 + 2H + ® Fe 2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 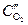
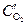
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 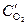
катод (Cu( 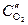
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al 0 ® Al 3+ + 3ē
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:

Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 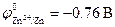
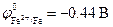
анод (Zn): Zn 0 ® Zn 2+ + 2ē
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
Видео:Электрохимическая коррозияСкачать

Катодное и анодное покрытия металлов как способ защиты их от коррозии
Видео:Коррозия металла. Химия – ПростоСкачать

Решение задач по химии на защиту металлов от коррозии
Задание 290.
Какое покрытие металла называется анодным и какое — катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытий железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
Решение:
По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий можно привести Cu, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии при отсутствии пор и повреждений покрытия. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия могут служить Zn, Cr.
При покрытии железа медью возникает коррозионная пара, в которой медь является катодом, а железо – анодом, так как железо имеет более отрицательный стандартный электродный потенциал (-0,44 В), чем медь (0,34 В). При этом будут протекать следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Fe 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Fe 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы железа Fe 2+ с хлорид-ионами Cl – будут образовывать соль FeCl2 – сильного электролита, т. е. железо будет разрушаться с образованием ионов железа Fe 2+ .
Таким образом, при покрытии железа медью при повреждении или при образовании пор разрушается основной металл – железо. Это пример катодного покрытия металла.
Задание 291.
Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте, Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
При покрытии железа кадмием образуется гальваническая пара, в которой кадмий является катодом, а железо – анодом. Объясняется это тем, что стандартный электродный потенциал кадмия (-0,40 В) немного больше, чем стандартный электродный потенциал железа (-0,44 В). Поэтому при нарушении кадмиевого покрытия будут происходить следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Fe 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Fe 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы железа Fe 2+ с хлорид-ионами Cl – будут образовывать соль FeCl2 – сильного электролита, т. е. железо будет разрушаться с образованием ионов железа Fe 2+ .
Таким образом, кадмий является катодом в гальванической паре Fe — Cd, значит, это катодное покрытие. При катодном покрытии во время коррозии разрушается основной металл .
Задание 292.
Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
При покрытии железного изделия свинцом образуется гальваническая пара Fe — Pb, в которой свинец является анодом, а железо – катодом. Объясняется это тем, что свинец имеет более электроотрицательный стандартный электродный потенциал (-0,126 В), чем железо (-0,44 В). Значит, это покрытие – анодное. При нарушении свинцового покрытия будут происходить следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Pb 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Pb 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии свинца будет Pb(OH)2.
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Pb 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы свинца Pb 2+ с хлорид-ионами Cl – будут образовывать соль PbCl2 – сильного электролита, т. е. свинец будет разрушаться с образованием ионов свинца Pb 2+ .
Таким образом, свинец является анодом в гальванической паре Fe — Pb, значит, это анодное покрытие. При анодном покрытии во время коррозии разрушается само покрытие, а основная конструкция не разрушается.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Катодный и анодный процессы
Процессы, которые протекают в расплавах или растворах электролитов во время прохождения сквозь них постоянного электричества и сопровождаются окислительно-восстановительными реакциями. Раздел химии, который изучает данные процессы, называется электрохимия, а электрохимические превращения — электролизом.
Процесс электролиза всегда протекает с применением электродов (как положительно, так и отрицательно заряженных). Они участвуют в переносе электронов на границе расплав или раствор электролита, то есть на границе двух фаз. Превращения исследуют в электрохимических ячейках, которые включают в себя сосуд с расплавом (раствором электролита) и пропускающими постоянный электрический ток электродами. Нерастворимые состоят из платины, графита или золота, растворимые могут состоять из различных материалов.
В процессе диссоциации электролита выходит распад на катионы (положительно заряженные частицы) и анионы (отрицательно заряженные частицы).
Например,хлорида натрия распадается:
Когда мы поместим расплав данного электролита в электрохимическую ячейку, пропустим через электрический ток, то следовательно из нашей схемы — на катоде восстанавливаются катионы, а на аноде окисляются анионы. Сделаем вывод, что процесс электролиза это ничто иное как катодный и анодный процессы или окислительно-восстановительные реакции.
Продукты реакции зависят от того, в каком виде находится электролит (расплав или раствор), от материала электрода (инертный или растворимый), также от положения металла, который в составе соли и ряду напряжения.
- Если катион электролита в ряду напряжения расположен до алюминия включительно, то на катоде идёт выделяется водород.
- Если катион металла находится в ряду напряжения между алюминием и водородом, то на катоде одновременно восстанавливаются ионы металла и молекулы воды.
- Если катион металла расположен в ряду напряжения после водорода, то на катоде восстанавливается металл.
- Если в растворе содержатся катионы разных металлов, то сначала восстанавливаются катионы металла, стоящего в ряду напряжения правее.
- При электролизе растворов бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона.
- При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идёт процесс окисления воды. Анионы не окисляются.
Видео:Cистема для контроля катодной защитыСкачать

Электролиз расплавов электролитов
Электролиз осуществляется для соединений с ионным типом связей (соли, щёлочи).
В растворах электролитов присутствуют катионы, анионы, а также молекулы воды. При электролизе воды происходят следующие процессы:
Рассмотрим электролиз на примере хлорида натрия в случае нерастворимого и растворимого анода.
а) Анод нерастворимый.
на катоде (-) ионы натрия не восстанавливаются, остаются в растворе: 2H2O + 2ē → H2 + 2OH-
на аноде (+): 2Cl- — 2ē → Cl2
Суммарное ионное уравнение:
2H2O + 2Cl- = H2 + Cl2 + 2OH-
Учитывая присутствие ионов натрия в растворе, составим молекулярное уравнение:
2NaCl + 2H2O → H2 + Cl2 + 2NaCl
б) Анод растворимый (например, медный).
Если анод растворимый, то металл анода будет окисляться:
Cuо — 2ē → Cu2+
на катоде (-): Cu2+ + 2ē → Cuо
на аноде (+): Cuо — 2ē → Cu2+
Видео:Электрохимическая защита. Катодная защитаСкачать

Обобщение:
Электролиз — окислительно-восстановительный процесс при прохождении электрического тока через раствор либо расплав электролита. На катоде протекают процессы восстановления, на аноде процессы окисления. При электролизе водных растворов могут участвовать также молекулы воды.
🎦 Видео
Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Электролиз. 10 класс.Скачать

Антикоррозионные покрытия: металлические, лакокрасочные, полиуретановые, силикатно-эмалевыеСкачать

Электрохимическая коррозия (алюминий — медь)Скачать

Коррозия металловСкачать

ЭлектролизСкачать

Антикоррозионные покрытия: эпоксидные, полиэтиленовые, полипропиленовыеСкачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Покрасил Металл Электричеством! Цветное Анодирование!Скачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Защита от блуждающих токовСкачать

Технология цинкования 2 - Травление и цинкованиеСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

7. ЭлектролизСкачать

Электролиз растворов. 1 часть. 10 класс.Скачать