Содержание:
Катализ (греч. κατάλυσις от καταλύειν «разрушение») — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
- Катализ
- Гомогенно-каталитические процесс
- Каталитические уравнения реакций органических веществ
- Каталитическая реакция — это что такое? Основные принципы и типы
- Понятие катализа
- Виды каталитических реакций
- Виды катализаторов
- Свойства катализаторов
- Скорость каталитической реакции
- Стадии каталитических реакций
- Примеры каталитических реакций
- 📸 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Катализ
Катализ—процесс увеличения скорости химической реакции при участии катализаторов. Катализаторами могут быть вещества в состоянии атомов, молекул, ионов или поверхности раздела фаз, которые взаимодействуют с исходными химическими соединениями, резко изменяют скорость реакции и выделяются на последующих стадиях в химически неизменном виле. Вещества, которые не ускоряют, а замедляют реакцию (увеличивают E*), называют ингибиторами.
Катализ может быть гомогенным, если реагирующие вещества и катализатор находятся в одной фазе. Примером гомогенного катализа может служить реакция
которая идет при высоких температурах и резко ускоряется в присутствии небольшой примеси паров воды.
Катализ называют гетерогенным, если реагирующие вещества и катализатор находятся в разных фазах и имеют границу раздела, например процессы окисления аммиака на платиновом катализаторе
и разложение пероксида водорода в присутствии твердого оксида марганца (IV)
Для некоторых веществ термодинамически допустимо не одно, а несколько направлений превращения. С помощью специально подобранных катализаторов можно ускорять одни и замедлять другие превращения. Так, одно и то же вещество—этиловый спирт—в присутствии оксидов алюминия или тория разлагается с образованием этилена и воды
а в присутствии серебра и меди разлагается с образованием уксусного альдегида и водорода
Каталитическая активность различных катализаторов может резко изменяться в присутствии некоторых веществ иной химической природы, которые сами не являются катализаторами, но резко увеличивают его каталитическую активность—такие вещества называют промоторами или активаторами. Так, каталитическая активность твердого оксида 


ядом является ничтожная примесь соединений мышьяка.
Впервые явление катализа было открыто в 1806 г. Н. Клеманом и Ш. Дезормом в камерном процессе получения серной кислоты. Они установили каталитическое действие оксидов азота на скорость окисления 



Первым промышленным производством, в котором был использован гетерогенный катализ, явился процесс Дикона (получение хлора)
хорошо идущий в присутствии солей меди.
В промышленном синтезе газообразного водорода используют процессы
И
в первом, из которых катализаторами служат оксилы железа, во втором—различные никелевые катализаторы.
Особенно большие успехи в деле промышленного использования катализа были достигнуты в процессах органического синтеза. Каталитическая гидрогенизация соединений с двойными связами; синтетическое моторное топливо; крекинг нефти; десульфуризация нефтепродуктов; синтез каучука, этанола и метанола, окиси этилена, изопропилового спирта, ацетона, акролеина, дивинила, изопрена, бензола, толуола; получение синтетических волокон и других высокополимерных веществ; каталитическая очистка технологических газов—вот далеко не полный перечень продуктов, которые получают в промышленном масштабе с использованием широкого ассортимента катализаторов.
Каталитические реакции бывают одностадийными (слитными) и многостадийными, проходящими через последовательные стадии, из которых одна является лимитирующей, т. е. стадией с наименьшей скоростью. Рассмотрим слитный механизм каталитического процесса на примере бимолекулярной реакции
где X — катализатор; (А— X)* — активированный комплекс. Скорость этой реакции v — 

Константа скорости такой каталитической реакции может быть существенно больше константы той же реакции в отсутствие катализатора из-за уменьшения энергии активации.
В случае двустадийной реакции

Если 
Скорость второй односторонней стадии равна

Объединив выражения (16.1) и (16.2), получаем
Вещество АХ, которое иногда называют промежуточным веществом Аррениуса, реально существует, его можно экспериментально определить методами спектрального анализа, ЭПР и др. Обычно концентрация этого вещества мала (в этом случае мало значение константы 
Гомогенно-каталитические процесс
Гомогенно-каталитические процессы в газовой фазе встречаются редко, так как газообразные катализаторы почти неизвестны. Примером может служить процесс пиролиза ацетальдегида, катализируемый парообразным иодом,
В этом процессе катализатор снижает энергию активации с 198 до 134 кДж/моль.
Гомогенный катализ наиболее распространен в растворах. В связи с большим числом конкретных примеров гомогенно-каталитические реакции этого типа принято делить на кислотно-основные и окислительно-восстановительные с участием комплексных соединений. К кислотноосновному катализу относят процессы изомеризации, гидратации и дегидратации, гидролиза, этерификации, алкилирования, деполяризации. В зависимости от типа основания или кислоты эти реакции условно делят на четыре группы:
1) специфический кислотный катализ ионами
2) специфический основной катализ ионами ОН-;
3) общий кислотный катализ (любыми кислотами);
4) общий основной катализ (любыми основаниями).
Если процесс, катализируемый кислотой или основанием, идет в растворе, то общая скорость реакции будет равна сумме скоростей реакций, катализируемых соответствующими катализаторами, а именно:
где 
(здесь 



первая стадия 
вторая стадия (промежуточная)

Первая стадия — быстрая, почти мгновенная, идет до равновесия 
вторая стадия — медленная, лимитирующая, для нее

подставив (16.4) в (16.5), получим
третья стадия, процесс распада активированного комплекса, приводит к образованию продуктов реакции.
Перейдем к рассмотрению гомогенного катализа комплексными соединениями переходных металлов. При таком катализе в присутствии комплексных катализаторов (чаще всего катионов переходных металлов) осуществляют реакции восстановления и окисления, гидрирования и гидратации, полимеризации и изомеризации. Примером может служить метод промышленного окисления этилена до ацетальдегида в водной среде в присутствии палладиевого катализатора
Окисление образующегося металлического палладия осуществляется ионом
и, наконец, Си4- окисляется кислородом воздуха до
Этот процесс в промышленных условиях идет сначала без доступа воздуха, образовавшийся ацетальдегид отгоняют, после чего ведут продувку воздуха. Если в этом процессе заменить хлор на бром, скорость реакции возрастет в 17 раз; если вести процесс в уксуснокислой среде, из эгилена образуется винилацетат. Приведенный пример показывает, что, воздействуя на катализатор, можно изменить не только скорость, но и химическую схему каталитической реакции.
Остановимся на характеристике гомогенно-каталитического ферментативного катализа, который осуществляется при использовании биологических катализаторов—ферментов, представляющих собой природные белки, входящие в состав тканей. Ферментативный катализ является основой управления сложных жизненных процессов в растениях и животных организмах. Так, фотосинтез, брожение, дыхание, пищеварение, синтез белков, сокращение мышц являются каталитическими процессами, использующими в качестве катализаторов различные ферменты.
Среди других видов каталитических реакций ферментативный катализ является самым высокоорганизованным, поскольку ферменты отличаются высокой избирательностью, специфичностью и каталитической активностью. Ферменты—это высокомолекулярные белки, состоящие из различных аминокислот, связанных пептидными связями. Нативная конформация молекулы фермента образует активный каталитический центр, содержащий полярные


Гетерогенно-каталитические процессы занимают особое место в кинетике, они протекают на границе раздела фаз твердое тело — газ, твердое тело—жидкость. Эти процессы широко используют в промышленной практике. В табл. 16.1 приведены примеры таких каталитических процессов и катализаторов.
Преимущество гетерогенно-каталитических процессов перед гомогенным катализом объясняется большим удоб-
ством гетерогенных катализаторов, легкостью их отделения от реагирующих веществ. Важнейшая характеристика гетерогенного катализатора—величина его активной поверхности. Часто катализаторы получают нанесением активной формы на пористый носитель (трегер) с высокоразвитой поверхностью. В качестве таких носителей применяют активированный уголь, силикагель, оксид хрома(Ш) и др. Многие катализаторы получают осаждением из растворов в виде гидроксидов 
Большая роль в гетерогенном катализе принадлежит процессам адсорбции —физической адсорбции и хемосорбции. Физическая адсорбция является результатом межмолекулярного взаимодействия между частицами (атомами, ионами, молекулами) поверхностного слоя твердой фазы и молекулами газовой фазы или раствором. Хемосорбция (химическая сорбция) завершается химическим взаимодействием адсорбированного вещества с поверхностью твердой фазы. Адсорбирующее твердое вещество называют адсорбентом; вещество, которое адсорбируется,—адсорбтивом. Адсорбция—экзоэргический процесс, сопровождающийся ростом концентрации упорядоченности адсорбтива на поверхности адсорбента. В табл. 16.2 приведены значения тепловых эффектов хемосорбции. Величину адсорбции (Г), т. е. концентрацию веществ на адсорбирующей поверхности, измеряют в молях на м2.
Гетерогенно-каталитические процессы идут через несколько стадий: например, процесс

протекающий на железо-оксидных катализаторах, можно разделить на следующие стадии: подход молекул СО и





где 
реакции, которая пропорциональна 
Первичной стадией гетерогенно-каталитического процесса является процесс адсорбции (т. е. увеличение концентрации реагирующих веществ), однако главная сущность каталитического влияния заключена в химическом взаимодействии реагирующих молекул с поверхностью катализатора по схеме 
Гетерогенный катализ—сложное явление, требующее глубокого теоретического анализа. Наиболее распространенные варианты теории были развиты в работах академика А. А. Баландина (мультиплетная теория катализа) и Н. И. Кобозева (теория активных ансамблей).
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Каталитические уравнения реакций органических веществ
Катализ — химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
Здесь MnO2 — катализатор реакции. Можно заметить, что в химическом уравнении катализатор не присутствует среди реагентов или продуктов, его не нужно учитывать и при уравнивании реакции. Поэтому обычно катализатор в уравнении указывают над стрелкой. Если у вас под рукой нет диоксида марганца, его вполне можно заменить двумя-тремя крупинками марганцовки из домашней аптечки: KMnO4 при действии Н2О2 быстро превратится в MnO2 (полезно написать уравнение этой реакции). Дальше полученный катализатор, вне зависимости от его количества, будет работать до тех пор, пока не закончится весь реагент — перекись водорода. Этот опыт можно проводить дома только с разбавленным (аптечным) раствором перекиси водорода. С концентрированным раствором реакция идет очень бурно. Диоксид марганца — не единственный катализатор реакции разложения перекиси водорода. Биологические катализаторы (ферменты), содержащиеся в крови, действуют так же. Именно поэтому слабый раствор перекиси водорода, нанесенный на царапину, начинает пузыриться (выделяющийся при этом кислород дезинфицирует ранку).
Другой домашний опыт — каталитическое окисление сахарозы кислородом воздуха. Обычный кусковой сахар или сахар-рафинад представляет собой практически чистую сахарозу С12Н22О11. Кусочек сахара не удается поджечь на открытом огне — он плавится, но не загорается. Но если сахар «испачкать» катализатором — табачным пеплом — его удается поджечь.
Этот опыт иногда показывают как фокус — кусочек сахара «случайно» роняют в пепельницу, а затем поджигают. Предполагают (хотя это не установлено точно), что катализатором реакции окисления сахарозы служат соединения цезия, в очень небольшом количестве присутствующие в пепле от сигарет.
Удивительным в явлении катализа является то обстоятельство, что катализаторы, активно участвуя в реакции, сами в итоге не изменяются. Другими словами, катализаторы не расходуются в ходе химической реакции. Поскольку катализатор способен многократно участвовать в промежуточных химических взаимодействиях с реагентами, его часто берут в небольшом количестве — значительно меньшем по сравнению с реагентами.
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Различают положительный катализ (ускорение реакций) и отрицательный катализ (замедление реакций). Обычно термин «катализ» относят именно к положительному катализу, а отрицательный называют ингибированием. Соответственно «отрицательные катализаторы» называются ингибиторами. Например, в качестве ингибитора реакции разложения перекиси водорода используют очень небольшую (1 : 10000) добавку пирофосфата натрия Na4P2O7. Его роль заключается в связывании следов примесей, которые являются хорошими катализаторами реакции разложения перекиси водорода — соединений Cu, Mn и некоторых других тяжелых металлов.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
В качестве примера рассмотрим реакцию разложения этилового спирта СН3СН2ОН (этанола). Без катализатора эта реакция идет с трудом (нужна высокая температура) и не селективно. Один путь реакции приводит к образованию этилена Н2С=СН2 и воды Н2О, другой — уксусного альдегида СН3СНО и водорода Н2:
При пропускании паров этанола через накаленную до 700 о С стеклянную трубку обе реакции идут параллельно. Примерно 20% этанола превращается в этилен и воду, а 80% — в уксусный альдегид и водород. Такие жесткие условия характерны для реакций с высокой энергией активации Еа. В свою очередь, Еа тем выше, чем более неустойчивыми являются промежуточные соединения, образующиеся на пути от реагентов к продуктам.
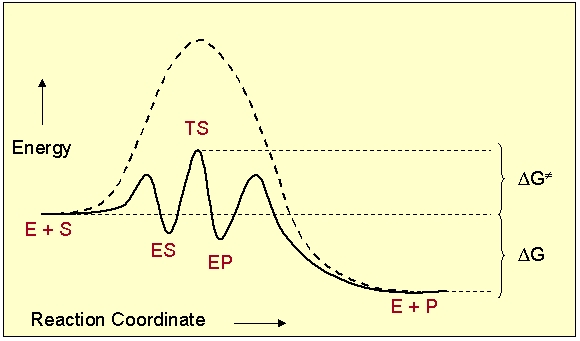
Образование этилена из этанола без катализатора идет с образованием очень неустойчивых промежуточных продуктов. Применение катализатора — твердого оксида алюминия Al2O3 — заставляет реакцию идти по другому пути, где промежуточные продукты уже более устойчивы и, следовательно, меньше энергия активации реакции (рис. 9-12).
Рис. 9-12. В присутствии катализатора Al2O3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.
В присутствии Al2O3 реакция заметно ускоряется и уже нет необходимости нагревать наполненную катализатором трубку до 700 о С — реакция с хорошей скоростью идет при 300 о С. Но это еще не весь эффект от применения катализатора! Реакция теперь идет с образованием этилена и воды, а уксусный альдегид и водород в этом случае не образуются. Таким образом, катализатор позволяет проводить реакцию разложения этанола селективно:
В приведенном примере реагент (этанол) и катализатор (порошкообразный оксид Al2O3) при 300 о С находятся в разных фазах — газообразной и твердой. В этом случае мы имеем дело с гетерогенным катализом. Если же реагенты и катализатор находятся в одной фазе — например, оба являются газами или оба растворены в каком-либо растворителе — то говорят о гомогенном катализе.
Как же работают катализаторы? Ответ на этот вопрос известен далеко не всегда. Однако в ряде случаев каталитические превращения изучены хорошо и химикам понятен механизм этих реакций. Термин «механизм реакции» раньше нам не встречался, поэтому необходимо объяснить его значение. Выяснение механизма реакции – это установление строения короткоживущих промежуточных частиц, возникающих на пути от реагентов к продуктам реакции. Такие неустойчивые промежуточные вещества часто невозможно выделить, но они могут быть изучены косвенными методами. Именно от строения и устойчивости (или неустойчивости) промежуточных частиц зависит скорость любой реакции и выбор того или иного её направления.
Например, использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 о С. Это говорит о еще более значительном снижении энергии активации и ускорении реакции:
Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н + (первая строчка в приведенной ниже схеме):
Разрыв связи С-О в этаноле происходит с образованием двух частиц, из которых неустойчива только одна (карбокатион), а вторая (Н2О), напротив, очень устойчива. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц.
Далее образовавшийся карбокатион способен превращаться в устойчивое нейтральное соединение (этилен), отщепляя ион водорода Н + (последняя строчка в схеме). Таким образом, катализатор Н+ возвращается в среду и опять готов к работе. Мы видим, что в реакционную среду в виде иона Н + вернулся уже не тот атом водорода, который начинал реакцию. Но серной кислоте безразлично происхождение своих водородных атомов — в ходе реакции она осталась неизменной.
** Читателям, уже знакомым с органической химией, может показаться странным, что мы называем эту реакцию гомогенной. Каким образом этанол при 170 о С может оставаться в растворе? Ведь температура его кипения даже ниже, чем у воды: 78 о С. Однако ошибки здесь нет. Дело в том, что серную кислоту при получении этилена используют не только как катализатор, но и как растворитель. Отогнать этанол из такого раствора практически невозможно — раньше начинается реакция его разложения (дегидратации). Выделяющаяся вода поглощается серной кислотой с выделением энергии, поэтому энергетический профиль реакции, строго говоря, уже не такой, как показан на рис. 9-12. Но сути дела это не меняет: ускорение реакции достигается за счет снижения энергии активации реакции дегидратации по сравнению с такой же реакцией без катализатора.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 23 Мб).
Итак, катализатор не только увеличивает скорость реакции за счет снижения энергии активации Еа, но и задает строго определенный механизм (строение промежуточных частиц), заставляющий реакцию протекать селективно — в данном случае с образованием этилена и воды. Уксусный альдегид и водород в присутствии серной кислоты не образуются.
Интересно, что при использовании в качестве катализатора металлической меди превращение этанола удается селективно направить по другому пути — с образованием уксусного альдегида и водорода. В данном случае мы имеем дело уже с гетерогенным катализом:
** Эта реакция называется реакцией дегидрирования (отщепления водорода). Она такая же эндотермическая, как и реакция дегидратации (отщепления воды). Однако при каталитическом дегидрировании, по сравнению с реакцией без катализатора, возникает новый, весьма важный фактор: выделяющийся в реакции водород тут же окисляется на меди кислородом воздуха с выделением большого количества теплоты. Это приводит к тому, что суммарный тепловой эффект всей последовательности реакций оказывается экзотермическим. Избыточной теплоты выделяется так много, что медная спираль (катализатор) в ходе реакции раскаляется.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 16 Мб).
Такую же реакцию дегидрирования (отщепления молекулы водорода) можно осуществить и с другим гетерогенным катализатором — нагретой серебряной сеткой. Приведенные выше примеры показывают, как с помощью катализаторов можно управлять селективностью реакций.
Если механизмы многих гомогенных каталитических реакций с участием кислот (кислотный катализ) или оснований (основной катализ) хорошо изучены, то о гетерогенном катализе этого сказать нельзя. Однако некоторые его закономерности все же известны.
Во-первых, в гетерогенном катализе большую роль играет адсорбция, то есть концентрирование веществ на поверхности раздела между ними. Например, адсорбция молекул газа происходит на поверхности твердого пористого катализатора. Благодаря адсорбции на поверхности катализатора растет концентрация реагирующих частиц, что уже само по себе может приводить к ускорению реакции. Поэтому важным фактором в гетерогенном катализе является площадь поверхности катализатора, его пористость. Чем больше поверхность, тем выше каталитическая активность твердого катализатора. Количество взятого катализатора тоже влияет на скорость реакции.
Во-вторых, еще более важную роль играет повышение химической активности адсорбированных молекул по сравнению с их обычным состоянием. Каким образом происходит повышение активности, понятно не всегда. Однако можно предположить, что образуются непрочные промежуточные соединения реагента с катализатором, в которых химические связи внутри реагента ослаблены и тем самым повышена его химическая активность. Вероятно, нечто похожее происходит в реакции присоединения водорода к соединениям с тройной связью (алкинам) на гетерогенном катализаторе — металлическом палладии с некоторыми добавками:
В этих реакциях образуются цис-алкены. Геометрическое строение продуктов реакции позволяет предположить, что молекула водорода присоединяется к алкину с поверхности катализатора. Если бы это было не так, то образовывался бы более устойчивый транс-алкен:
** Справка для тех, кто еще не изучал органическую химию: цис-бутен и транс-бутен — разные соединения, хотя имеют одинаковую молекулярную формулу С4Н8 и даже одинаковую последовательность связывания атомов в молекулах. Это геометрические изомеры. Они отличаются геометрической формой своих молекул, поэтому их физические и даже некоторые химические свойства отличаются. В отличие от простых С-С связей, свободное вращение вокруг двойных С=С связей не происходит, поэтому цис— и транс-изомеры не переходят друг в друга в обычных условиях и существуют как индивидуальные соединения.
Еще одна особенность гетерогенного катализа заключается в том, что около поверхности работающего катализатора всегда концентрируются как исходные вещества, так и продукты реакции. Если продукты адсорбируются на катализаторе слишком прочно, то они плохо вытесняются с поверхности и катализатор постепенно теряет активность. В этом случае говорят, что катализатор отравляется продуктами реакции. Однако во многих случаях каталитическими ядами являются даже не продукты реакции, а различные примеси в исходных веществах. Например, для платиновых катализаторов такими каталитическими ядами являются примеси HCN, H2S, соединений As, Se, Te.
В ряде случаев катализатор специально «отравляют» — то есть частично подавляют его активность дозированным введением каталитических ядов, чтобы заставить реакцию идти в нужном направлении. Например, рассмотренная выше реакция присоединения водорода к тройной связи с не «отравленным» палладиевым катализатором не останавливается на стадии получения алкенов (соединений с двойной связью) и дает алканы:
Добавление к измельченному палладию оксида свинца PbO и некоторых других каталитических ядов позволяет остановить реакцию гидрирования на стадии получения соединений с двойной связью. Поиск и приготовление таких катализаторов — настоящее искусство, поэтому не удивительно, что многие катализаторы носят имена своих создателей. Например, палладиевый катализатор для неполного восстановления алкинов называется катализатором Линдлара.
Наибольшее применение гетерогенный катализ находит в промышленном производстве органических веществ. Однако не менее необходим он и при получении таких важных неорганических продуктов, как аммиак NH3 и оксид серы SO3 (последний нужен для производства серной кислоты).
Обе эти промышленные реакции — экзотермические, то есть энергетически выгодные. Но есть и осложняющее обстоятельство: обе реакции обратимы, то есть одновременно протекают как в прямом, так и в обратном направлении. Более подробно такие реакции мы рассмотрим в следующем параграфе. Здесь лишь скажем, что сдвиг равновесия в сторону NH3 или SO3 становится возможен только при отводе образующегося в реакциях тепла, то есть при относительном снижении температуры этих реакций. Однако с понижением температуры реакции настолько замедляются, что равновесие устанавливается очень медленно. Поэтому необходимо применение катализаторов. Катализатор не способен влиять на положение равновесия, так как он одинаково хорошо ускоряет как прямую, так и обратную реакции. Однако благодаря катализатору равновесие устанавливается быстрее.
В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al2O3 и K2O. Эти оксиды служат промоторами.
Промоторы — это вещества, сами по себе не являющиеся катализаторами данной реакции, но усиливающие действие основного катализатора.
В производстве серной кислоты для получения SO3 раньше в качестве катализатора использовали металлическую платину. На современных сернокислотных заводах работают значительно более дешевые ванадиевые катализаторы (V2O5) с добавками SiO2 и K2О.
Среди веществ, которые не следует путать с катализаторами, следует упомянуть инициаторы химических реакций. В отличие от катализаторов, инициаторы расходуются в ходе реакции, но их требуется очень немного, поскольку они служат всего лишь «спусковым крючком» начала химического процесса. Например, полимеризацию этилена можно осуществить в присутствии небольшого количества вещества-инициатора, способного распадаться с образованием свободных радикалов — частиц с неспаренным электроном. Такой активный радикал (например, RO . ), присоединяясь к единственной молекуле этилена, способен вызвать множество последующих реакций присоединения других молекул этилена:
В более короткой форме реакцию получения полиэтилена можно выразить уравнением:
Индекс n в формуле полимера называется степенью полимеризации (значение n может достигать десятков тысяч). В результате происходящей сшивки молекул этилена образуются длинные макромолекулы полиэтилена с молекулярной массой от 30000 до 800000 в зависимости от условий реакции. На конце каждой такой гигантской молекулы имеется «пришитый» к ней инициатор, однако его содержание в общей массе полиэтилена ничтожно мало.
Инициаторы — вещества, в ряде случаев необходимые для возбуждения химической реакции, которая далее происходит без посторонней помощи. Инициаторы расходуются в ходе реакции, однако их требуется намного меньше, чем реагентов.
Впрочем, инициирование возможно и на поверхности гетерогенного катализатора. В этом случае говорят уже не об инициаторах, а о катализаторах полимеризации — такие тоже широко применяются в химической промышленности.
В одном параграфе невозможно рассмотреть все многообразие каталитических реакций, известных в неорганической и органической химии, в биохимии (ферментативный катализ), в технике (автомобильные катализаторы дожигания выхлопных газов) и т.д. Здесь мы ставили задачу разобраться лишь в некоторых ключевых вопросах, а именно:
- Что общего в действии всех катализаторов?
- На что способен влиять катализатор (энергия активации, механизм реакции), а на что повлиять не может (тепловой эффект реакции).
- Каким образом катализатор способен оставаться неизменным в ходе реакции, хотя активно в ней участвует?
- В чем различие между гомогенным и гетерогенным катализом?
- От чего зависит активность гетерогенного катализатора?
- Влияет или не влияет катализатор на положение равновесия в обратимых реакциях?
- Что такое ингибиторы?
- В чем различие между катализаторами, промоторами и инициаторами?
Рекомендуем читателю еще раз вернуться к этим вопросам и ответить на них самостоятельно для закрепления пройденного материала.
Видео:Уравнивание реакций горения углеводородовСкачать

Каталитическая реакция — это что такое? Основные принципы и типы
Большую часть процессов, лежащих в основе химической технологии, составляют каталитические реакции. Это связано с тем, что при введении катализатора скорость взаимодействия веществ существенно увеличивается. При этом производителям удается сократить расходы или же получить большее количество продуктов реакции за тот же период времени. Именно поэтому изучению катализа уделяется много внимания при подготовке технологов. Однако это явление играет важную роль и в природе. Так, особые вещества регулируют протекание биохимических реакций в живых организмах, влияя тем самым на обмен веществ.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Понятие катализа
Суть этого химического явления заключается в регулировании скорости превращения веществ с использованием особых реагентов, способных замедлять или ускорять этот процесс. При этом говорят о положительном или отрицательном катализе. Существует также явление автокатализа, когда на скорость реакции влияет один из промежуточных продуктов химической реакции. Каталитические процессы разнообразны, отличаются они механизмами, агрегатным состоянием соединений и направлением.
Вещества, которые замедляют химические взаимодействия, называют ингибиторами, а ускоряющие каталитические реакции — катализаторами. И те, и другие изменяют скорость реакции путем многократного промежуточного взаимодействия с одним или несколькими ее участниками. При этом они не входят в состав продуктов и восстанавливаются после окончания цикла превращения веществ. Поэтому участие катализатора не отражают в уравнении реакции стехиометрически, а лишь указывают как условие взаимодействия веществ.
Видео:Катализ. 10 класс.Скачать

Виды каталитических реакций
По агрегатному состоянию веществ, принимающих участие в химической реакции, различают:
- гомогенные реакции — реагирующие вещества, продукты и катализатор находятся в одном агрегатном состоянии (фазе), при этом молекулы веществ равномерно распределены по всему объему;
- межфазные каталитические реакции — происходят на границе раздела несмешивающихся жидкостей, а роль катализатора сводится к переносу реагентов через нее;
- гетерогенные каталитические реакции — в них катализатор имеет отличное от реагентов агрегатное состояние, а сама она осуществляется на поверхности раздела фаз;
- гетерогенно-гомогенные реакции — инициируются на поверхности раздела с катализатором, а продолжаются в реакционном объеме;
- микрогетерогенные реакции — мелкие частички твердого катализатора образуют мицеллы по всему объему жидкой фазы.
Существует также окислительно-восстановительный катализ, сопровождающийся изменением степени окисления катализатора при взаимодействии с реагентами. Такие превращения называют каталитическими реакциями окисления и восстановления. Наиболее распространено в химическом производстве окисление диоксида серы до триоксида при получении серной кислоты.
Видео:Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

Виды катализаторов
По агрегатному состоянию катализаторы бывают жидкие (H2SO4, Н3РО4), твердые (Pt, V2О5, Al2О3) и газообразные (BF3).
По типу вещества катализаторы классифицируют на:
- металлы — могут быть чистыми, сплавами, цельными или нанесенными на пористую основу (Fe, Pt, Ni, Cu);
- соединения металлов типа МmЭn — наиболее распространены оксиды MgO, Al2О3, МоО3 и др.;
- кислоты и основания — используются для кислотно-основных каталитических реакций, это могут быть кислоты Льюиса, Бренстеда и др.;
- комплексы металлов — в эту группу включают также соли переходных металлов, например PdCl2, Ni(СО)4;
- ферменты (они же энзимы) — биокатализаторы, ускоряющие реакции, идущие в живых организмах.
По специфике электронного строения различают d-катализаторы, имеющие d-электроны и d-орбитали, а также s,р-катализаторы, центром которых является элемент с валентными s и р-электронами.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Свойства катализаторов
Для эффективного использования к ним применяется довольно обширный список требований, изменяющийся для конкретного процесса. Но наиболее значимы следующие два свойства катализаторов:
- Специфичность, заключается в способности катализаторов влиять только на одну реакцию или ряд однотипных превращений и не воздействовать на скорость других. Так, платина чаще всего используется в органических реакциях гидрирования.
- Селективность, характеризуется способностью ускорять одну из нескольких возможных параллельно протекающих реакций, тем самым увеличивать выход наиболее важного продукта.
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Скорость каталитической реакции
Причиной ускорения взаимодействия веществ является образование активного комплекса с катализатором, приводящее к снижению энергии активации.
Согласно основному постулату химической кинетики, скорость любой химической реакции прямо пропорциональна произведению концентраций исходных веществ, которые взяты в степенях, соответствующих их стехиометрических коэффициентам:
где k — константа скорости химической реакции, численно равная скорости этой же реакции, при условии, что концентрации исходных соединений равны 1 моль/л.
По уравнению Аррениуса k зависит от энергии активации:
Указанные закономерности справедливы и для каталитических реакций. Это подтверждает и уравнение, для отношения констант скоростей:
где переменные с индексом К относятся к каталитическим реакциям.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Стадии каталитических реакций
Для гомогенных каталитических реакций достаточно двух основных стадий:
- Образование активированного комплекса: А + К ―> АК.
- Взаимодействие активированного комплекса с другими исходными веществами: АК + В ―> С + К.
В общем виде записывают уравнение вида А + В ―> С.
Механизм гетерогенных каталитических реакций сложен. Выделяют следующие шесть стадий:
- Подведение к поверхности катализатора исходных соединений.
- Адсорбция исходных реагентов поверхностью катализатора и образование промежуточного комплекса: А + В + К ―> АВК.
- Активация образовавшегося комплекса: ΑВК ―> ΑВК * .
- Распад комплексного соединения, при этом образовавшиеся продукты адсорбированы катализатором: ΑВК * ―> CDK.
- Десорбция полученных продуктов поверхностью катализатора: CDK ―> С + D + К.
- Отвод продуктов от катализатора.
Видео:Каталитические реакцииСкачать

Примеры каталитических реакций
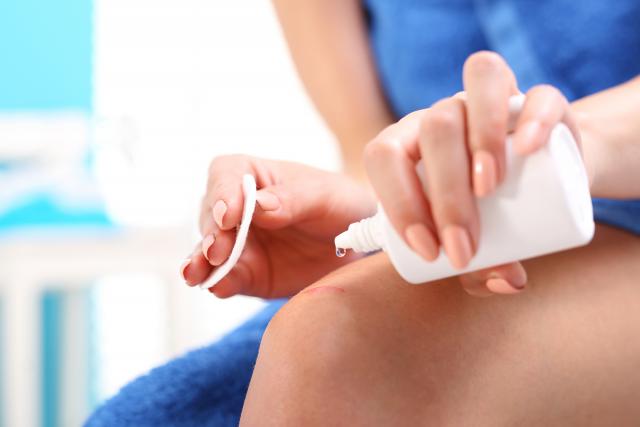
Катализаторы используют не только в химической промышленности. Любой человек в своей повседневной жизни сталкивается с различными каталитическими реакциями. Это, например, использование перекиси водорода при обработке ран. Пероксид водорода при взаимодействии с кровью начинает разлагаться под влиянием фермента каталазы:
В современных автомобилях система выхлопа снабжена особыми каталитическими камерами, способствующими разложению вредных газообразных веществ. Например, платина или родий помогают снижать уровень загрязнения окружающей среды оксидами азота, которые разрушаются с образованием безвредных О2 и N2.
В некоторых зубных пастах содержатся ферменты, инициирующие разложение зубного налета и остатков пищи.
📸 Видео
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Видеоурок по химии "Типы химических реакций в органической химии"Скачать

Каталитические и некаталитические реакции. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Решение цепочек превращений по химииСкачать

Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать