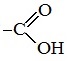
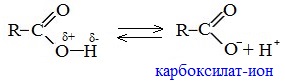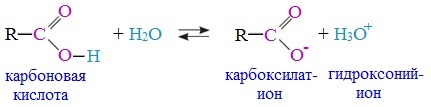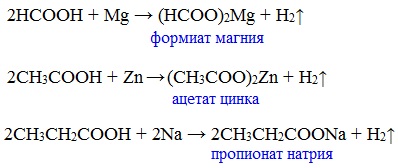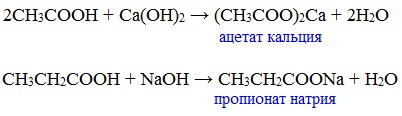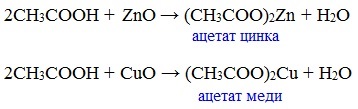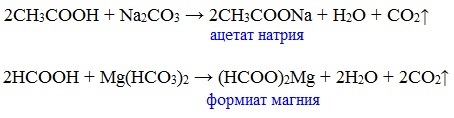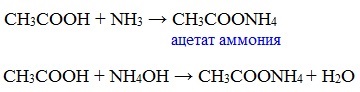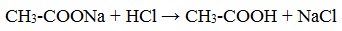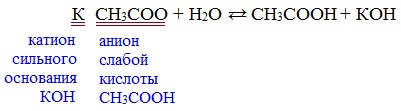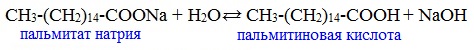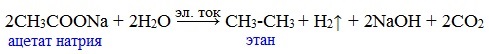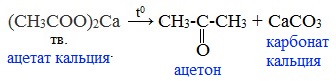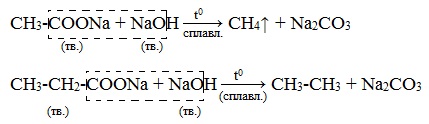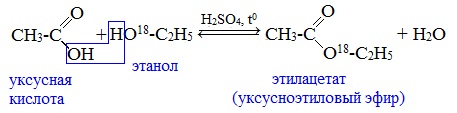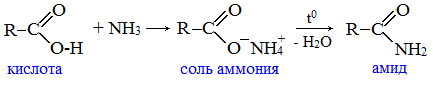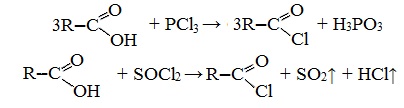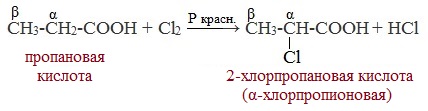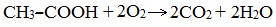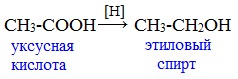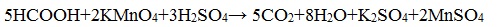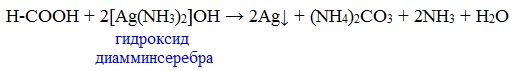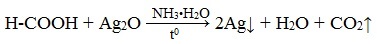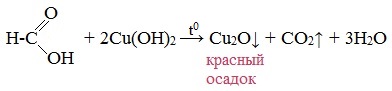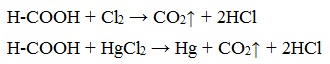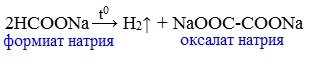Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
- Карбоновые кислоты лакмус уравнение реакции
- I. Реакции с разрывом связи О-Н
- Свойства солей карбоновых кислот
- II. Реакции с разрывом связи C-О
- III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
- V.Реакции каталитического восстановления
- Особенности строения и свойства муравьиной кислоты
- Карбоновые кислоты лакмус уравнение реакции
- Органическая химия
- Качественные реакции в органической химии
- Качественные реакции на алканы
- Качественные реакции на алкены
- Качественные реакции на алкины
- Качественные реакции на альдегиды
- Качественные реакции на спирты
- 🌟 Видео
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
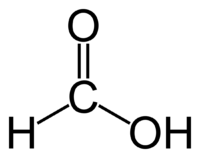
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
- Окисление алканов
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
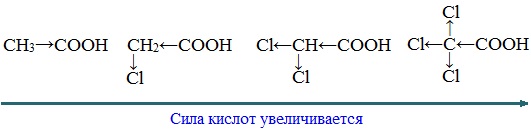
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
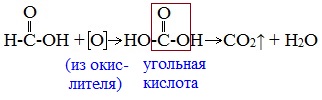
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Карбоновые кислоты. Химические свойства. Все 25 реакций ЕГЭ.Скачать

Карбоновые кислоты лакмус уравнение реакции
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Она определяется в основном наличием в их структуре карбоксильной группы.
Карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы (р,π-сопряжение). Вследствие +М-эффекта со стороны группы –ОН электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы 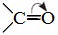
Но в то же время за счет +М-эффекта со стороны группы –ОН в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд (δ+) на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами.
Кроме того, вследствие –I-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению СН-кислотного центра у α-углеродного атома.
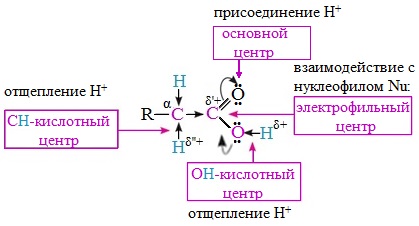
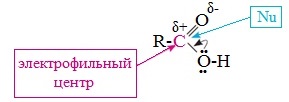
Исходя из строения, в молекулах карбоновых кислот можно выделить реакционные центры, определяющие возможные реакции с их участием.
1. Кислотные свойства кабоновых кислот проявляются в реакциях с основаниями за счет ОН-кислотного центра.
2. С участием электрофильного центра (атома углерода карбоксильной группы) происходят реакции нуклеофильного замещения в карбоновых кислотах и их функциональных производных.
3. Основный центр – карбонильная группа (оксогруппа) со своей электронной парой – протонируется на стадии катализа в реакциях нуклеофильного замещения.
4. СН-кислотный центр определяет возможность замещения атома водорода в алкильном радикале и реакции конденсации.
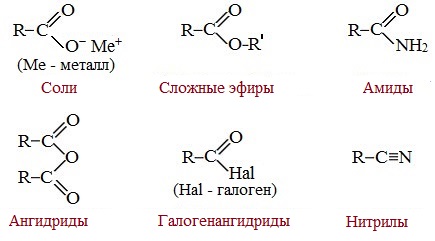
Карбоновые кислоты вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
I. Реакции с разрывом связи О-Н
(кислотные свойства карбоновых кислот обусловлены подвижностью атома водорода карбоксильной группы и их способностью отщеплять его в виде протона)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
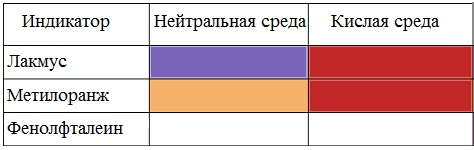
Карбоновые кислоты изменяют окраску индикаторов.
1. Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: они диссоциируют с образованием протона (Н + ) и кислотного остатка (карбоксилат-иона):
Уравнение реакции, учитывающее участие молекулы воды:
Растворы карбоновых кислот изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток.
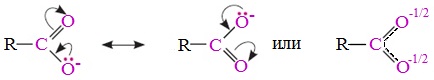
В карбоксилат-ионе оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован (рассредоточен) между ними.
В результате делокализации отрицательного заряда карбоксилат-ион обладает высокой устойчивостью. Сила кислоты определяется устойчивостью образующегося аниона, поэтому карбоновые кислоты превосходят по кислотным свойствам спирты и фенолы, где возможность делокализации заряда в анионе меньшая.
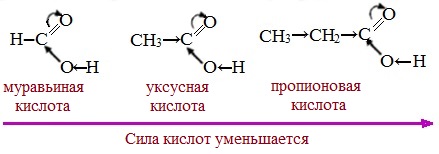
Тем не менее, монокарбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода.
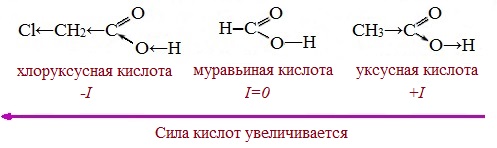
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индукционного эффекта.
Алкильные радикалы, связанные с карбоксильной группой, обладают положительным индукционным эффектом (+І). Они отталкивают от себя электронную плотность, тем самым уменьшая частичный положительный заряд (δ+) на атоме углерода карбоксильной группы. Положительный индукционный эффект возрастает по мере увеличения длины углеводородного радикала, что в свою очередь ослабляет полярность связи О-Н. Алкильные группы понижают кислотность.
В гомологическом ряду предельных монокарбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам.
Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индукционный эффект (— I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты.
Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации сильно смещено влево, об этом свидетельствует тот факт, что даже сильноразбавленные водные растворы кислот имеют резкий запах.
Видеоопыт «Растворимость в воде различных карбоновых кислот»
Видеоопыт «Карбоновые кислоты — слабые электролиты»
2. Образование солей
Карбоновые кислоты проявляют все свойства минеральных кислот. Карбоновые кислоты при взаимодействии с активными металлами, основными оксидами, основаниями и солями слабых кислот образую соли.
а) взаимодействие с активными металлами
Цинк и уксусная кислота
Карбоновые кислоты реагируют с металлами, стоящими в ряду напряжений до водорода.
Видеоопыт «Взаимодействие уксусной кислоты с металлами»
б) взаимодействие c основаниями (реакция нейтрализации)
Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи»
в) взаимодействие с основными и амофтерными оксидами
Оксид меди(II) и уксусная кислота
Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)»
г) взаимодействие с солями более слабых кислот
Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия»
д) взаимодействие с аммиаком или гидроксидом аммония
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
Видеоопыт «Свойства карбоновых кислот»
Свойства солей карбоновых кислот
1) Взаимодействие с сильными кислотами
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
Из неорганических кислот лишь угольная кислота слабее рассматриваемых кислот и может вытесняться ими из её солей — карбонатов и гидрокарбонатов.
Качественная реакция на ацетат-ион СН3СОО — ! Запах уксусной кислоты.
2) Гидролиз по аниону
Натриевыс и калиевые соли карбоновых кислот в водных растворах находятся частично в гидролизованном состояния.
Этим объясняется щелочная реакция мыльного раствора.
Видеоопыт «Гидролиз ацетата натрия»
3) Электролиз солей активных металлов (реакция Кольбе)
Одним из применений солей карбоновых кислот является электролиз их водных растворов, в результате которого образуются насыщенные углеводороды:
Электролизом раствора соли карбоновой кислоты можно получить алкан с удлиненной цепью.
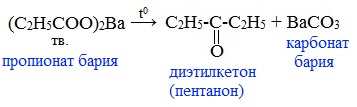
4) Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны:
4) Декарбоксилирование солей щелочных металлов (реакция Дюма)
В процессе сплавления солей карбоновых кислот с твердой щелочью происходит расщепление углеродной связи и образуются алканы с числом атомов углерода на один меньше, чем у исходной кислоты:
II. Реакции с разрывом связи C-О
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов).
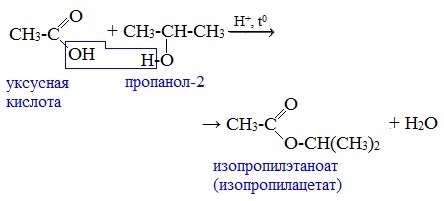
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации)
Карбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя сложные эфиры:
Механизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18 О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира.
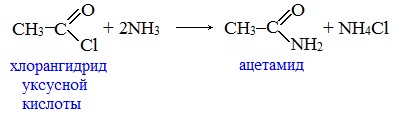
2. Взаимодействие с аммиаком с образованием амидов
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
Вместо карбоновых кислот чаще используют их галогенангидриды:
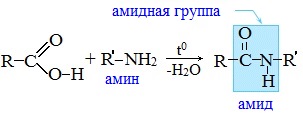
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп — пептидных связей.
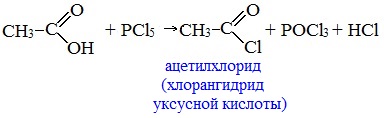
3. Взаимодействие с галогенидами фосфора или тионилхлоридом с образованием галогенангидридов карбоновых кислот
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2.
Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты.
Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе.
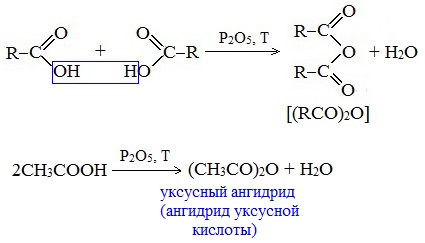
4. Образование ангидридов кислот (межмолекулярная дегидратация)
Ангидриды кислот образуются в результате межмолекулярной дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в качестве водоотнимающего средства.
Вещества, которые образуются при отщеплении воды от органических кислот, называются ангидридами.
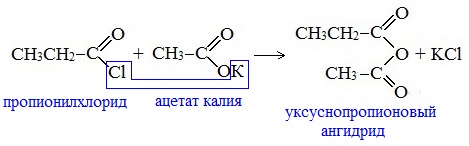
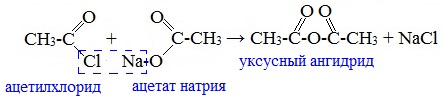
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты с безводной солью другой карбоновой кислоты:
Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к образованию оксида углерода (II).
Наиболее широкое применение находит уксусный ангидрид. Большое количество его расходуется для синтеза ацетилцеллюлозы, которая идет на изготовление искусственного шелка. Уксусный ангидрид используется также для получения аспирина.
III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
(реакции с участием радикала)
1. Реакции замещения (с галогенами)
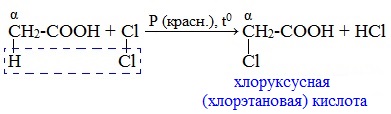
Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот.
Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля-Фольгарда-Зелинского):
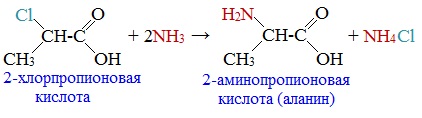
2-Хлорпропионовая кислота – промежуточный продукт для получения аминокислот. Действием на 2-хлорпропионовую кислоту аммиака получают 2-аминопропионовую кислоту (аланин):
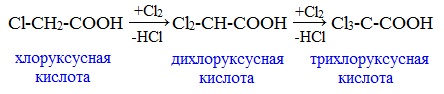
Дальнейшее хлорирование приводит к образованию дихлоруксусной и трихлоруксусной кислот:
IV. Реакции окисления (горение)
В атмосфере кислорода карбоновые кислоты сгорают с образованием оксида углерода (IV) СО2 и Н2О:
Видеоопыт «Горение уксусной кислоты на воздухе»
В отличие от альдегидов, карбоновые кислоты достаточно устойчивы к действию даже такого сильного окислителя, как перманганат калия. Исключение составляет муравьиная кислота, которая проявляет восстановительные свойства благодаря наличию альдегидной группы.
V. Реакции каталитического восстановления
Карбоновые кислоты с трудом восстанавливаются каталитическим гид-рированием, однако при взаимодействии с алюмогидридом лития (LiAlH4) или дибораном (В2Н6) восстановление осуществляется достаточно энергично:
Особенности строения и свойства муравьиной кислоты
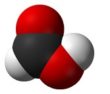
В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа
связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиная кислота является более сильной кислотой по сравнению с другими членами своего гомологического ряда.
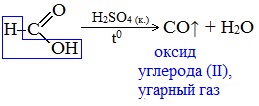
Все предельные карбоновые кислоты устойчивы к действия концентрированной серной и азотной кислот. Но муравьиная кислота при нагревании с концентрированной серной кислотой разлагается на воду и монооксид углерода (угарный газ).
1. Разложение при нагревании
При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:
Данную реакцию используют в лаборатории для получения чистого оксида углерода (II).
Видеоопыт «Разложение муравьиной кислоты»
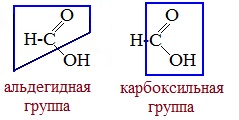
Молекула муравьиной кислоты, в отличие от других карбоновых кислот, наряду с карбоксильной группой содержит в своей структуре и альдегидную группу.
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Как и альдегиды, НСООН проявляет восстановительные свойства. Проявляя свойства альдегида, муравьиная кислота легко окисляется до угольной кислоты:
2. Окисление перманганатом калия
Видеоопыт «Окисление муравьиной кислоты раствором перманганата калия»
Муравьиная кислота окисляется аммиачным раствором Ag2О и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные реакции на альдегидную группу!
3. Реакция «серебряного зеркала»
или в упрощенном виде
4. Окисление гидроксидом меди (II)
5. Окисление хлором, хлоридом ртути
Муравьиная кислота окисляется и другими окислителями (Сl2, HgCl2).
Формиаты щелочных металлов при сплавлении образуют соли щавелевой кислоты — оксалаты:
Видеоопыт «Взаимодействие бромной воды с олеиновой кислотой»
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Карбоновые кислоты лакмус уравнение реакции
Органическая химия
Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
🌟 Видео
11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать

Карбоновые кислотыСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Карбоновые кислоты. 9 класс.Скачать

Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Карбоновые кислоты | Органическая химия | Химия ЕГЭ, ЦТСкачать

Ароматические карбоновые кислоты. Химические свойства. Все 4 реакции ЕГЭ.Скачать

Карбоновые кислотыСкачать

7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Ржавый лак из хозтоваров. Экспериментальный состав для кислотного воронения.Скачать

Свойства карбоновых кислот. 1 часть. 11 класс.Скачать
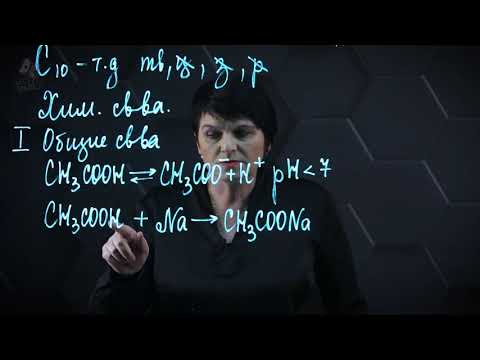
Соли карбоновых кислот. Химические свойства. Все 8 реакций ЕГЭ.Скачать

Химия 9 класс (Урок№31 - Карбоновые кислоты. Сложные эфиры. Жиры.)Скачать

Карбоновые кислоты. Тема 25. Химические свойства насыщенных одноосновных карбоновых кислот (часть 1)Скачать

Карбоновые кислотыСкачать

Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать