4.1 Аналитические реакции катионов кальция Са 2+
1.Катионы кальция Са 2+ образуют с анионами сульфата SO4 2− белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов минерала гипса CaSO4 ∙ 2 H2O:
Для увеличения полноты осаждения к раствору добавляют равный объем этанола, поскольку в водно-спиртовом растворе растворимость сульфата кальция понижается по сравнению с растворимостью в воде.
Для проведения реакции микрокристаллоскопическим методом каплю раствора, содержащего катион Са 2+ , помещают на предметное стекло, затем добавляют каплю раствора H2SO4 и смесь упаривают. При этом образуются игольчатые кристаллы гипса (CaSO4 ∙ 2 H2O), хорошо видимые в микроскоп (рис. 4.1).
Крупные кристаллы гипса легко отличить от мелких кристаллов BaSO4 и SrSO4. В присутствии катионов Ba 2+ и Sr 2+ к анализируемому раствору добавляют каплю раствора серной кислоты H2SO4, смесь выпаривают досуха. Осадок нагревают с дистиллированной водой. Сульфат кальция, как наиболее растворимый сульфат катионов II группы, переходит в раствор. При упаривании полученного раствора выпадают кристаллы гипса, хорошо видимые под микроскопом.
Рис.4.1. Кристаллы гипса (CaSO4 ∙ 2 H2O) под микроскопом.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса:
что позволяет отделить катионы Са 2+ от катионов Ba 2+ и Sr 2+ .
При нагревании с растворимыми карбонатами осадок CaSO4 переходит в белый осадок карбоната кальция:
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образовавшегося CaCO3 используют для отделения катионов кальция вместе с катионами стронция и бария (II группа) от катионов других аналитических групп и для перевода их в раствор.
2.Катионы Са 2+ образуют с анионом оксалата (C2O4 2− ) белый кристаллический осадок оксалата кальция CaC2O4:
Реакцию проводят в слабокислой среде (рН ≈ 6,0-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. Осадок CaC2O4 не растворяется в аммиаке, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты Н2C2O4:
Данной реакции мешают катионы Ba 2+ , Sr 2+ , Mg 2+ , которые с оксалатом образуют аналогичные осадки.
3.Катионы Са 2+ образуют с гексацианоферратом (II) калия K4[Fe(CN)6] при нагревании раствора в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата (II) аммония и кальция (NH4)2Ca[Fe(CN)6]:
белый крист. осадок
Осадок не растворяется в уксусной кислоте. Данной реакции мешают катионы Ba 2+ и другие, образующие осадки ферроцианидов.
4.При взаимодействии концентрированных растворов солей Са 2+ с раствором хромата калия K2CrO4 образуется желтый осадок хромата кальция:
В присутствии уксусной кислоты или ацетата натрия осадок не образуется.
Испытывают его растворимость в уксусной кислоте и ацетате калия: в обоих случаях осадок растворяется.
5.Другие реакции катионов Са 2+ . Катионы кальция образуют осадки: с растворимыми карбонатами — белый осадок CaCO3 (растворим в кислотах); с гидрофосфатом натрия Na2HPO4 – белый осадок CaHPO4 (растворим в кислотах).
4.2 Аналитические реакции катионов стронция Sr 2+
1.Катионы Sr 2+ образуют с анионами сульфата белый осадок сульфата стронция SrSO4:
Осадок не растворяется в щелочах, а также в растворе сульфата аммония (NH4)2SO4 (в отличие от осадка сульфата кальция – см. реакцию 4.2).
Испытывают растворимость осадка в растворах щелочи и сульфата аммония (осадок не растворяется).
Осадок SrSO4 образуется также при действии на растворимые соли стронция “гипсовой воды” (насыщенный водный раствор CaSO4), поскольку растворимость в воде сульфата стронция меньше, чем сульфата кальция:
Реакция солей стронция с гипсовой водой протекает при нагревании раствора, ей мешает наличие катиона бария Ва 2+ .
При нагревании осадка SrSO4 с насыщенным раствором соды он, как и сульфат кальция, переходит в осадок карбоната стронция SrСO3, растворимый в кислотах.
2.Катионы Sr 2+ образуют при нагревании с анионами карбоната белый кристаллический осадок карбоната стронция:
Осадок растворим в кислотах (СН3СООН, HCl, HNO3).
3.При взаимодействии концентрированных растворов солей стронция с раствором хромата калия K2CrO4 образуется осадок хромата стронция желтого цвета:
В присутствии уксусной кислоты или ее соли осадок не образуется.
Испытывают растворимость осадка в уксусной кислоте или растворе ацетата калия – осадок растворяется.
4.При взаимодействии солей стронция с оксалатом калия (аммония) образуется белый кристаллический осадок оксалата стронция SrC2O4:
Осадок оксалата растворим в кислотах.
5.Реактив гексацианоферрат (II) калия K4[Fe(CN)6] не образует осадка при взаимодействии с солями стронция:


6.Другие реакции катионов стронция. Катионы Sr 2+ образуют белый осадок SrHPO4 при реакциях в растворах с гидрофосфатом натрия Na2HPO4. Осадок гидрофосфата стронция растворим в кислотах.
4.3 Аналитические реакции катионов бария Ва 2+
1.При взаимодействии с анионами сульфата катионы Ва 2+ образуют белый кристаллический осадок сульфата бария:
Осадок не растворяется в кислотах и щелочах, за исключением концентрированной серной кислоты. В последнем случае образуется раствор гидросульфата бария:
При нагревании с растворами карбонатов осадок сульфата бария переходит в малорастворимый в воде карбонат бария ВаСО3, который хорошо растворим в кислотах (СН3СООН, HCl, HNO3).
Проведению данной реакции мешают катионы Са 2+ , Sr 2+ , Pb 2+ , которые также образуют нерастворимые сульфаты.
2.Катионы бария Ва 2+ образуют с анионами хромата CrO4 2− или бихромата Cr2O7 2− (в присутствии раствора ацетата натрия) желтый осадок хромата бария:
Образование хромата, а не бихромата бария в случае реакции (4.16) объясняется тем, что хромат ВаCrO4 обладает меньшей растворимостью, чем бихромат Ва2Cr2O7. В водном растворе устанавливается равновесие:
Равновесие смещено вправо, поэтому в растворе накапливаются катионы водорода Н + . Для их нейтрализации в раствор вносят ацетат натрия СН3СООNa. Анионы ацетата связывают катионы водорода. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Проведению данной реакции мешают катионы Ag + , Pb 2+ , Cd 2+ , Co 2+ , Ni 2+ . Катионы кальция Са 2+ и стронция Sr 2+ не мешают открытию катионов бария с помощью бихромата.
3.При взаимодействии солей бария с оксалатом натрия (аммония) выпадает белый кристаллический осадок оксалата бария:
Осадок растворяется в кислотах: HCl, HNO3.
Испытывают растворимость осадка в кислотах (HCl, HNO3).
4.Катионы бария в присутствии солей аммония образуют с раствором гексацианоферрата (II) калия белый кристаллический осадок двойной соли:
белый крист. осадок
5.Другие реакции катионов бария. Растворимые соли бария образуют осадки: при взаимодействии с гидрофосфатом натрия Na2HPO4 – белый осадок ВаHPO4 (растворим в кислотах); с карбонатами щелочных металлов – белый осадок карбоната бария ВаСО3 (растворим в кислотах); с сульфитами щелочных металлов – белый осадок ВаSO3 (растворим в кислотах).
В табл. 4.1 представлены продукты некоторых аналитических реакций катионов II аналитической группы по кислотно-основной классификации и свойства данных продуктов.
Продукты некоторых аналитических реакций катионов II группы
Видео:Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать

Кальций: способы получения и химические свойства
Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
Видео:Реакция НИТРАТА КАЛЬЦИЯ и ЩАВЕЛЕВОЙ КИСЛОТЫ. Получение ОКСАЛАТА КАЛЬЦИЯ. Опыты по химии.Скачать

Способ получения
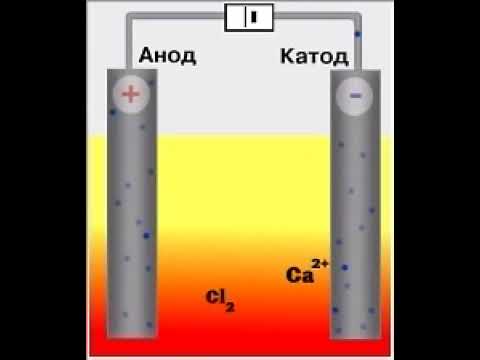
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Видео:Качественная реакция ионов кальция с оксалатом аммонияСкачать

Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Видео:СЕминар "Качественные реакции на s-элементы"Скачать

Химические свойства
1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли :
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Видео:Реакция КАЛЬЦИЯ и СЕРНОЙ КИСЛОТЫ. Химические опыты дома. Chemical experiment with sulfuric acid.Скачать

Оксалатно-кальциевая кристаллурия — основа возникновения оксалатной нефропатии и уролитиаза
Оксалатно-кальциевая кристаллурия может быть вызвана нарушением обмена щавелевой кислоты или фосфорно-кальциевого обмена. Приведены алгоритмы действий врача при выявлении оксалатной кристаллурии и оксалатно-кальциевой кристаллурии при отсутствии повышенно
Calcium oxalate crystalluria may be caused by metabolic disorders of oxalic acid or calcium-phosphorus metabolism. The algorithms of the doctor’s actions in revealing the oxalate crystalluria and calcium oxalate crystalluria in the absence of increased urinary oxalate and calcium were considered.
За последние годы появилось большое количество публикаций, посвященных проблеме обменных или, как их часто называют, дисметаболических нефропатий (ДН). Этот термин возник в нашей стране в 1970-е гг. и был предложен московскими детскими нефрологами, среди которых следует, прежде всего, назвать таких ученых, как профессора М. С. Игнатова, Ю. Е. Вельтищев, В. А. Таболин, Н. А. Коровина, Э. А. Юрьева, доцент В. П. Лебедев и др. Этот термин получил свое распространение лишь в педиатрической среде. Это объясняется тем, что у взрослых данная патология трансформируется в интерстициальный нефрит дисметаболического генеза или в мочекаменную болезнь (МКБ), но эти заболевания могут возникать и в детском возрасте. Однако и на сегодня отсутствуют четкие критерии, позволяющие выделить эту патологию как отдельную нозологическую форму. Некоторые рассматривают ее как синдром обменной нефропатии [1]. В связи с существующей расплывчатостью в трактовке диагноза обменной нефропатии, на что указывалось еще в 1990-х гг. М. С. Игнатовой и Г. А. Маковецкой [2], необходимо с современных позиций дать характеристику патологии, которую следует обозначать как «дисметаболическая нефропатия на примере оксалатно-кальциевой кристаллурической нефропатии».
Среди ДН особое место занимает патология, обусловленная образованием оксалатно-кальциевых кристаллов, которые практически нерастворимы в биологических жидкостях и тканевых структурах. Это способствует развитию оксалатно-кальциевой кристаллурической нефропатии, которая при соответствующих условиях реализуется чаще всего в хронический интерстициальный нефрит и/или в МКБ. Последние часто осложняются вторичным как необструктивным, так и обструктивным пиелонефритом соответственно. Возникновение оксалатно-кальциевой кристаллурии может быть обусловлено как нарушением обмена щавелевой кислоты (ЩК), так и патологией фосфорно-кальциевого обмена.
Существуют первичные и вторичные нарушения обмена ЩК. Первичная форма вызвана наследственно обусловленным отсутствием ферментов, препятствующих превращению глиоксиловой и гликолевой кислот в ЩК, что приводит к гипероксалемии и гипероксалурии. Вторичные гипероксалурии имеют различный генез. Одни могут быть обусловлены поражением цитомембран, способствующим распространенному или местному повышенному мембранолизу, наблюдаемому при различных интоксикациях, приводящих к активации перекисного окисления липидов и образованию ряда метаболитов, конечным продуктом которых является ЩК [3–5]. При этом гипероксалурия, возникающая на фоне острых интеркуррентных заболеваний, бывает транзиторной и исчезает после выздоровления от основного заболевания. Как правило, такого генеза вторичная гипероксалурия не приводит к возникновению ДН, если поддерживается нормальный мочеток и не возникает дефицита ингибиторов кристаллизации солей. В других случаях причиной вторичной гипероксалурии является нестабильность почечных цитомембран, которая часто носит семейный характер, но может возникать и спорадически в связи с воздействием различных неблагоприятных факторов, в том числе и экологического характера [4, 6, 7].
Продолжает привлекать внимание вторичная гипероксалурия в связи с поступлением экзогенных оксалатов с пищевыми продуктами. Однако если раньше акцентировалось внимание на количестве оксалатов, поступавших с пищей, то в настоящее время придается большее значение степени нарушения полостного и пристеночного пищеварения, при котором может усиливаться абсорбция оксалатов [8–10]. В связи с этим изменился подход к проведению диетотерапии и диетопрофилактики детям с абсорбтивной формой гипероксалурии. Так, нецелесообразно во всех случаях ограничивать продукты, содержащие ЩК и витамин С, а также молочные продукты, богатые кальцием. Более того, при абсорбтивном типе гипероксалурии необходимо не только не ограничивать поступление с пищей кальция (Ca), но и рекомендовать его потребление, а иногда и назначать плохо всасываемые препараты кальция, ограничив поступление витамина D.
Усиление абсорбции оксалатов наступает и при дисбиозе кишечника, когда исчезает присутствующий в норме анаэробный микроб Oxalobacter formigenеs, способствующий разрушению ЩК [11–15]. Следует отметить, что гипероксалурия может встречаться у совершенно здоровых лиц, но она будет носить кратковременный характер и бывает связана с особенностями сезонного пищевого рациона.
Помимо первичной и вторичной гипероксалурии причиной возникновения оксалатной кристаллурии может быть присутствие в моче большого количества кальция. Гиперкальциурия, также как и гипероксалурия, периодически может возникать и в норме, если потребляются в большом количестве продукты, богатые кальцием. При патологии, обусловленной повышенной абсорбцией кальция в кишечнике (при гипервитаминозе D, повышенной продукции активных метаболитов витамина D или нарушении их перехода в неактивные формы), наблюдается абсорбтивная форма гиперкальциурии, которая способствует образованию в мочевых путях оксалатно-кальциевой кристаллурии. Кроме абсорбтивной формы встречается почечная форма гиперкальциурии из-за нарушения реабсорбции кальция в канальцах, носящая как первичный характер, так и вторичный в связи с различной приобретенной патологией почек, осложненной тубулоинтерстициальным синдромом. Существует и третий вариант гиперкальциурии, вызванный гиперпаратиреоидизмом.
Вместе с тем хорошо известно, что далеко не всегда кристаллурия возникает при избыточной экскреции с мочой оксалатов и кальция. Даже у лиц, страдающих оксалатным уролитиазом, часто отсутствует как гипероксалурия, так и гиперкальциурия.
Иными словами, отсутствует прямая связь между уровнем экскреции оксалата кальция и нефролитиазом [16]. В этом случае причиной возникновения кристаллов оксалата кальция является отсутствие или недостаточное содержание в моче тех или иных ингибиторов кристаллообразования, которые, находясь в моче в малых концентрациях, способны подавлять как образование, так и дальнейший рост уже возникших кристаллов за счет их агрегации. Установлено, что выпадение кристаллов оксалата кальция связано не столько с количеством общего кальция, содержащегося в моче, сколько с наличием в ней ионизированной его фракции [17–19]. Только ионизированный кальций способен вступать в химическую связь с анионом ЩК, образуя нерастворимую соль оксалата кальция в виде моногидрата или дигидрата. У здоровых лиц содержание ионизированного кальция контролируется присутствием в моче лимонной кислоты, выделяемой в необходимом количестве канальцевым эпителием. Гипоцитратурия — одна из частых причин повышенной оксалатно-кальциевой кристаллурии. Она может быть первичной у лиц, родственники которых страдают МКБ, и вторичной — при почечной патологии, протекающей с поражением тубулоинтерстиция. Однако не у всех пациентов с поражением тубулоинтерстиция возникает гипоцитратурия. Вероятно, имеется нарушение обмена органических кислот, а также их транспортировка почечными канальцами [20]. Это наблюдается, прежде всего, у тех больных, у которых имеется наследственная предрасположенность, реализующаяся при почечном заболевании.
И все же почему кристаллурия возникает не у всех, у кого имеется гипероксалурия или отмечается повышенный мембранолиз? Кроме того, почему не у всех лиц, проживающих в экологически неблагоприятных регионах, наблюдается повышенная кристаллизация солей? Это можно объяснить только одним, а именно наличием предрасположенности к выпадению кристаллов, в частности оксалата кальция. Этому способствует наличие оксалатного диатеза [20, 21], который может способствовать возникновению пограничного состояния, характеризующегося появлением изменений на клеточном и субклеточном уровне под влиянием неблагоприятных факторов эндо- и экзогенного характера, когда клинические проявления патологии могут еще отсутствовать [21]. Можно предположить, что в основе как щавелевокислого диатеза, так и других видов кристаллурических диатезов лежат сниженные антикристаллизирующие свойства мочи. Применительно к рассматриваемому диатезу можно говорить о возможно латентно протекающей гипоцитратурии.
Персистирующее воздействие неблагоприятных факторов способствует у этих лиц развитию уже патологического состояния, которое следует обозначить как оксалатно-кальциевая нефропатия — наиболее частому варианту ДН. Многие считают, что специфических симптомов для ДН нет, и диагноз ставится на основе анамнеза, включая обязательно клинико-генетическое обследование [3]. Несомненно, тщательный сбор анамнеза с учетом характера семейной патологии чрезвычайно важен для постановки диагноза. Вместе с тем, на наш взгляд, основой для постановки данного диагноза должна быть соответствующая клиника. Она характеризуется склонностью к частому появлению в осадке мочи кристаллов оксалата кальция в сочетании с периодической микрогематурией, лейкоцитурией и обязательно проявлениями дизурии. Данная симптоматика обусловлена травматизацией слизистой мочевых путей образующимися микролитами. Основным признаком, который определяет данную патологию, является кристаллурия. Однако солевой осадок в виде кристаллов оксалата кальция следует считать патологическим не столько в зависимости от степени его выраженности, сколько с учетом объема данной ночной порции мочи и ее относительной плотности. Для патологической кристаллурии характерно ее наличие при достаточном объеме данной порции мочи и невысокой относительной плотности.
Для ДН не характерна протеинурия, ибо еще нет воспалительного поражения интерстиция почки. При данной патологии отсутствуют отчетливые признаки нарушения функции почек и изменения могут быть лишь на клеточном и субклеточном уровне. В литературе это состояние обозначается как «предболезнь» [21]. Можно предполагать, что на этой стадии можно выявить снижение содержания в моче ингибиторов кристаллообразования, а для оксалатно-кальциевой нефропатии прежде всего цитратов.
Появление даже небольшой, но стойкой протеинурии свидетельствует уже о наличии интерстициального нефрита дисметаболического генеза, обусловленного при наличии оксалатной кристаллурии возникновением абактериального воспалительного процесса в интерстиции почки в ответ на раздражение ткани образующимися микролитами. При этом уже может быть выявлено нарушение концентрационной функции почек по пробе Зимницкого, а также функции аммониогенеза по пробе с лазиксом [22, 23].
Клинически оксалатная нефропатия может долгое время протекать бессимптомно или маскироваться под заболевания, имеющие одинаковые с ней симптомы. Так, учащенные, а подчас и болезненные мочеиспускания часто расцениваются как нейрогенная дисфункция МП или цистит, тем более что при этом в анализе мочи может наблюдаться лейкоцитурия. Обнаружение в осадке мочи только кристаллов оксалата кальция еще не является признаком патологии даже при наличии их в большом количестве, если относительная плотность данной порции мочи будет выше 1025. И, наоборот, при большом объеме ночной порции мочи и низких цифрах относительной плотности даже небольшое количество кристаллов является признаком или оксалатного диатеза, или, при наличии микрогематурии, а нередко лейкоцитурии и дизурии, свидетельством уже развившейся патологии в виде оксалатно-кальциевой нефропатии.
Ниже приводится алгоритм действий врача при выявлении оксалатной кристаллурии.
Алгоритм действий врача при выявлении оксалатной кристаллурии в общем анализе мочи
1. Оценить обстоятельства, при которых сдавалась моча на анализ:
- ночная ли эта порция мочи;
- характер питания за предшествующие 4–5 суток;
- не было ли накануне лихорадочного состояния;
- не получал ли пациент витамин С;
- нет ли нарушения со стороны ЖКТ;
- нет ли признаков нейродермита, экземы, псориаза и др. поражений кожи;
- не было ли признаков дизурии, болевого синдрома.
2. Обратить внимание на ряд параметров общего анализа мочи:
- относительная плотность;
- реакция мочи;
- при мутной моче выяснить, как быстро появилась мутность после мочеиспускания;
- наличие лейкоцитурии и гематурии.
3. Назначается анализ суточной мочи на:
4. При обнаружении повышенной экскреции оксалатов для уточнения причины резко ограничить поступление оксалатов с пищей и через 4–5 дней повторно исследовать суточную мочу на соли.
- Если экскреция оксалатов резко уменьшилась (на нижней границе нормы), то имеет место пищевая оксалатурия.
- Если экскреция оксалатов уменьшилась незначительно, необходимо:
а) оценить работу ЖКТ;
б) провести копрологическое исследование;
в) при выявленных нарушениях необходимо назначение средств, улучшающих полостное и пристеночное пищеварение;
г) при подозрении на абсорбтивный тип оксалурии рекомендуется назначение продуктов, богатых кальцием, и повторное исследование суточной мочи на оксалаты и кальций.
5. При наличии оксалатной кристаллурии и отсутствии гипероксалурии следует оценить суточную экскрецию кальция.
При подозрении на абсорбтивный тип оксалурии рекомендуется назначение продуктов, богатых кальцием, но при исключении поступления в организм витамина D. Кальций необходим для связывания ЩК в просвете кишечника в целях ограничения поступления оксалатов в кровь, а затем в мочу. Однако при этом необходимо контролировать кальциурез, по крайней мере, с помощью пробы Сулковича. Ранее рекомендуемые ограничения в приеме молочных продуктов, как основных источников кальция, при абсорбтивной гипероксалурии не только не показаны, а даже противопоказаны. При этом следует учитывать, что молочные продукты являются важнейшими продуктами питания для растущего и формирующегося организма ребенка.
После исключения гипероксалурии как причины кристаллурии следует оценить суточную экскрецию кальция (рис.). Частота гиперкальциурии у детей различного возраста достигает 15% [11]. При избыточном поступлении кальция с пищей при наличии витамина D возникает пищевая гиперкальциурия, что может приводить к образованию кристаллов оксалата кальция при нормальном содержании ЩК в моче. Абсорбтивный вариант гиперкальциурии возникает при гипервитаминозе D или при нарушении механизма превращения активной формы метаболита витамина D в неактивную.
Существует также ренальная форма гиперкальциурии, возникающая при нарушении механизма реабсорбции кальция в канальцевой системе нефрона. Реабсорбция его происходит на протяжении как проксимальной, так и дистальной части тубулярного аппарата, но дистальный нефрон представляет собой главный участок, где реализуется действие паратгормона, усиливающего реабсорбцию кальция [24, 25]. Поэтому как гипопаратиреоз, так и снижение в дистальных отделах нефрона количества рецепторов к паратгормону при поражении тубулоинтерстиция могут вызвать гиперкальциурию.
Кроме того, выделяют резорбтивную форму гиперкальциурии, возникающую в результате вымывания кальция из костной ткани вследствие развития гиперпаратиреоза или вторичного гиперпаратиреоидизма.
Вместе с тем оксалатно-кальциевая кристаллурия может наблюдаться при отсутствии нарушений в обмене оксалатов и кальция в том понимании, как это принято на сегодняшний день. Иными словами, у этих пациентов отсутствует как гиперкальциурия, так и гипероксалурия. По этой причине термин «обменная нефропатия» не вполне соответствует возникающей кристаллурии. Причиной кристаллообразования оксалата кальция является в этом случае отмеченное выше недостаточное образование и поступление в просвет канальцев лимонной кислоты, что способствует повышению содержания Са ++ , который легко вступает в химическое взаимодействие с анионом ЩК. Возможно, это и определяет сущность так называемого оксалатно-кальциевого диатеза, который в дальнейшем может трансформироваться в дисметаболическую нефропатию с последующим развитием интерстициального нефрита или МКБ. Важное место в диагностике и в качестве контроля за эффективностью лечения и проведения профилактических мероприятий, включая фитотерапию, должно быть отведено регулярному проведению теста по оценке антикристаллических свойств мочи. Ниже приводятся рекомендации по обследованию лиц с оксалатно-кальциевой кристаллурией при отсутствии повышенного содержания в моче оксалатов и кальция.
Алгоритм действий врача при выявлении оксалатно-кальциевой кристаллурии при отсутствии повышенной экскреции оксалатов и кальция
- Проанализировать объем диуреза как суточного, так и особенно за ночное время.
- Провести тест на ингибицию кристаллообразования.
- Исключить инфекцию мочевыводящих путей.
- Оценить экскрецию уратов, которые могут стимулировать гетерогенное зародышеобразование и/или вызывать эпитаксиальный рост кристаллов оксалата кальция на ядре уратного зародыша.
- Установить содержание Са ++ в моче и/или содержание в ней цитратов.
Таким образом, причины и механизмы возникновения оксалатно-кальциевой кристаллурии весьма различны и это диктует необходимость индивидуального подхода к профилактике и лечению того или иного состояния, проявляющегося данным видом кристаллурии.
Литература
- Рычкова С. В. Дисметаболические нефропатии в педиатрической практике // Леч. Врач. 2010. № 8. С. 11–15.
- Игнатова М. С., Маковецкая Г. А. Диагноз и дифференциальный диагноз в детской нефрологии. Самара, 1993. С. 60–67.
- Вельтищев Ю. Е., Юрьева Э. А. Дисметаболическая нефропатия. В кн.: Детская нефрология. Под ред. Игнатовой М. С., Вельтищева Ю. Е. Л., 1989. С. 276–292.
- Клембовский А. И., Баландина Е. К., Брыдун А. В., Бурова В. Я. Характеристика вариантов патологии клеточных мембран у детей при воспалении. В кн.: Проблемы мембранной патологии в педиатрии. М., 1984. С. 136–150.
- Юрьева Э. А. Повреждение клеточных мембран при заболеваниях почек у детей. Автореферат. дис. … докт. мед. наук. М. 1979. 32 с.
- Харина Е. А., Аксенова М. Е., Длин В. В. Лечение спорадической и экозависимой дизметаболической нефропатии с оксалатно-кальциевой кристаллурией у детей. В кн.: Рук-во по фармакотерапии в педиатрии и детской хирургии: Нефрология. М., 2003. С. 180–188.
- Османов И. М., Длин В. В. Диагностика и лечение дизметаболических нефропатий и мочекаменной болезни у детей. В кн.: Лекции по педиатрии: Нефрология. М., 2006. Т. 6. С. 108–125.
- Томах Ю. Ф., Клепиков Ф. А. Кристаллурические диатезы. Харьков, 1992. С. 56–57.
- Фрейтаг Д., Хруска К. Патофизиология нефролитиаза. В кн.: Почки и гомеостаз в норме и патологии. Под ред. С. Клара. М., 1987. С. 390–419.
- Коровина Н. А., Захарова И. Н., Гаврюшова Л. П. и др. Дисметаболические нефропатии у детей: диагностика и лечение (рук-во для врачей). М., 2007. С. 17–23.
- Коровина Н. А., Захарова И. Н. Гаврюшова Л. П. и др. Дисметаболические нефропатии у детей // Consilium Medicum. 2009. Т. 11, № 7. С. 29–41.
- Гордеева Е. А. Дизметаболические нефропатии (оксалурии): современный подход к лечению // Лечащий Врач. 2009, № 6, с. 42–44.
- Goldfarb D. S. Microorganisms and Calcium Oxalate Stone Disease // Nephron Physiology. 2004, vol. 98, № 2: p. 48–54.
- Stewart Colin S, Duncan Sylvia H., Cave David R. Oxalobacter formigenes and its role in oxalate metabolism in the human gut // FEMS Microbiology Letters. 2004, vol. 230, № 1: 1–7.
- Troxel Scott A., Harmeet Sidhu, Poonam Kaul, Low Roger K. Intestinal Oxalobacter formigenes Colonization in Calcium Oxalate Stone Formers and Its Relation to urinary Oxalate // J. of Endourology, 2003, 17 (3): 173–176.
- Смирнова Н. Н., Сергеева К. М., Клочко Л. А. Особенности клинических проявлений мочекаменной болезни у детей / Педиатрия: из XIX в XXI век. Материалы конференции. СПб: ВМА, 2010. С. 59.
- Томах Ю. Ф. Ионизированный кальций мочи при нефролитиазе / Материалы V111 Всесоюзной конференции по физиологии почек и водно-солевого обмена. Харьков, 1989. С. 186–187.
- Langley S. E. M., Fry C. H. Differences in the free Ca2+ in undiluted urine from stone formers and normal subjects using a new generation of ion-selective electrodes // British J. of Urology. 1995, 75, 288–295.
- Laube N., Hergarten S. Can the BONN-Risk-Index be replaced by a simple measurement of the urinary concentration of free calcium ions? // J. of Urology. 2005, vol. 173, p. 2175–2177.
- Вельтищев Ю. Е., Игнатова М. С. Профилактическая и превентивная нефрология (генетические и экопатологические факторы развития нефропатий). Лекция. М., 1996. 61 с.
- Игнатова М. С., Коровина Н. А. Дизметаболические нефропатии. В кн.: Диагностика и лечение нефропатий у детей. М., 2007. С. 152–163.
- Архипов В. В., Ривкин А. М. Фуросемид в оценке функции почек при исследовании состояния различных отделов мочевой системы (обзор литературы) // Урология и нефрология. 1991, 2: 63–66.
- Архипов В. В., Ривкин А. М. Диагностика функционального состояния почек с использованием фуросемида. Методические рекомендации. СПб, 1996. 13 с.
- Златопольский Э. Патофизиологи магния, кальция и фосфора. В кн.: Почки и гомеостаз в норме и патологии. Под ред. С. Клара. 1987, с. 217–278.
- Бабарыкин Д. А. Обмен кальция, магния, фосфата и их регуляция. В кн.: Физиология водно-солевого обмена и почки. Отв. ред. Ю. В. Наточин. СПб: Наука, 1993. С. 144–176.
Г. А. Новик, доктор медицинских наук, профессор
А. М. Ривкин 1 , кандидат медицинских наук
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
📺 Видео
Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)
Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция на карбонаты кальция. Задание 15. Химия ОГЭ.Скачать

КальцийСкачать

Подлинность ГЛЮКОНАТА КАЛЬЦИЯ. Реакция с ХЛОРИДОМ ЖЕЛЕЗА. Опыты по химии домаСкачать

Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

Качественная реакция на ион кальция I ЕГЭ по химииСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Опыты по химии. Взаимодействие кальция с водойСкачать

Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Химия, 12-й класс, Реакции идентификации катионов (I-III)Скачать

хлорид кальция ; электролизСкачать
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать


.gif)