- Кремниевая кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Силикаты
- Кремниевая кислота: свойства и применение
- Физические свойства
- С чем реагирует кремниевая кислота?
- Получение в лабораторных условиях
- Использование в промышленности
- Кремниевая кислота в организме человека
- Силикаты, оксид кремния — их применение
- Кремниевая кислота — формула, физические и химические свойства
- Общая информация
- Особенности силикатов
- Физические и химические свойства
- Способы получения
- Применение в различных отраслях
- 💡 Видео
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Видео:Кремниевая кислота и её соли. 9 класс.Скачать

Кремниевая кислота: свойства и применение
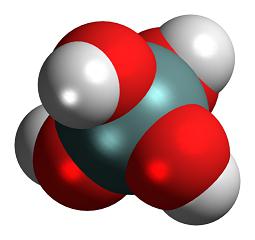
Неорганические вещества делятся на три касса: кислоты, гидроксиды и соли. К разряду первых относится такое вещество, как кремниевая кислота. Ее молекула состоит из двух атомов гидрогена, одного — силиция и трех — оксигена.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Физические свойства
Кремниевая кислота — это практически нерастворимое в воде вещество. При взаимодействии с Н2О оно образует коллоидный раствор, но не диссоциирует. Это очень неустойчивое химическое соединение, которое может распадаться даже при нормальных условиях.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

С чем реагирует кремниевая кислота?
Данное химическое соединение является не очень активным — это слабая кислота. Ее свойства выражены неярко. Однако она все же обладает почти всеми особенностями, которые присущи кислотам. Слабость данного вещества проявляется в том, что оно, в отличие от других соединений данного класса, не окрашивает индикаторы. Если, к примеру, под воздействием других кислот метилоранж станет розовым, а лакмус — красным, то при взаимодействии с кремниевой они оба не изменят свой цвет. Также оно неспособно разъедать ткани или вызывать ожоги на коже, как другие кислоты. Это очень неустойчивое вещество — частичное разложение кремниевой кислоты может произойти даже при невысокой температуре. Но для того чтобы эта реакция произошла в полной мере, используют нагревание данного соединения. Вследствие такого рода реакции образуется вода и оксид кремния, который широко используется в промышленности, а также очень распространен в природе в виде песка и разнообразных минералов, к примеру, кварца. При распаде одной молекулы кремниевой кислоты можно получить одну молекулу воды и одну — оксида. Как и все кислоты, кремниевая может давать соли. Для этого к ней нужно добавить металл, который в ряду активности стоит левее, чем водород. При этом произойдет реакция замещения, при которой образуется определенный силикат, а также выделяется водород в виде газа. Например, при взаимодействии одной молекулы кремниевой кислоты с двумя молекулами натрия образуется одна натрий силиката и одна водорода.
А при реакции одной молекулы кислоты с одной кальция получается одна кальций силиката и одна водорода. Также для получения силикатов можно использовать реакцию растворения кремниевой кислоты в щелочах. Для этого чаще всего используется калий или натрий гидроксид. При таком взаимодействии из одной молекулы кислоты и двух щелочи можно получить одну молекулу силиката и две — воды. Вещества, образующиеся при химических реакциях, в которых может участвовать данное соединение, широко применяются в различных сферах промышленности.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение в лабораторных условиях
Чаще всего кремниевую кислоту добывают путем добавления к силикату натрия хлорной (соляной) кислоты. Для проведения реакции вещества нужно смешать в таких пропорциях, чтобы на одну молекулу соли приходилось две молекулы кислоты, при этом получится, что на две молекулы образовавшегося натрий гидроксида будет приходиться одна кремниевой кислоты.
Видео:Кремниевая кислота | ХимияСкачать

Использование в промышленности
Применение кремниевой кислоты сводится к тому, что она выступает в роли адсорбента — поглотителя других веществ. При добывании данного химического соединения при помощи смешивания силиката натрия и соляной кислоты образуется студенистая масса, высушив которую, можно получить так называемый силикагель, который и используют в промышленности. Также данное вещество применяется в медицине. Кроме того, ее используют в химической отрасли для получения таких соединений, как оксид кремния и различные силикаты.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Кремниевая кислота в организме человека
Данное вещество является крайне важным для человеческого организма. Оно необходимо для нормального функционирования соединительных тканей, ногтей, волос, кожи, сухожилий, связок. Медицинские препараты либо продукты, содержащие кремниевую кислоту, полезны тем, у кого нарушен обмен веществ, а также применяются для лечения варикозного расширения вен, используются в качестве антицеллюлитных средств. Кремниевая кислота содержится в некоторых растениях, накапливаясь там как компонент клеточного сока. Травы, в которых она присутствует, — это ланцетный подорожник и полевой хвощ.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Силикаты, оксид кремния — их применение
Сырьем для получения данных веществ служит кремниевая кислота. Данные химические соединения разнообразны по своим физическим свойствам и используются в разных целях. Некоторые из них встречаются в природе в виде драгоценных и полудрагоценных камней. К примеру, изумруд, гранат и топаз — это силикаты. Оксид кремния распространен в виде песка и кварца. Данное вещество чаще всего используется в промышленности для производства стекла, которое является силикатом.
Его химическая структура состоит из молекул кальция, оксигена, натрия и силиция. Добывают стекло путем соединения таких веществ, как оксид кремния, карбонат кальция и натрия. Такого рода реакция может произойти только под воздействием высокой температуры. В ее результате получают стекло, в строение которого входят молекулы оксидов силиция, кальция и натрия, а также углекислый газ. Для получения стекла карбонаты натрия и кальция и оксид кремния смешивают в таких пропорциях, чтобы на шесть молекул последнего приходилось по одной двух первых веществ. Для окрашивания его в разные цвета используют такие вещества: кобальт — для придания синей окраски, железо — коричневой, манган — лилово-красной, хром — зеленой.
Видео:Образование кремниевой кислотыСкачать

Кремниевая кислота — формула, физические и химические свойства
Видео:Получение кремниевой кислотыСкачать

Общая информация
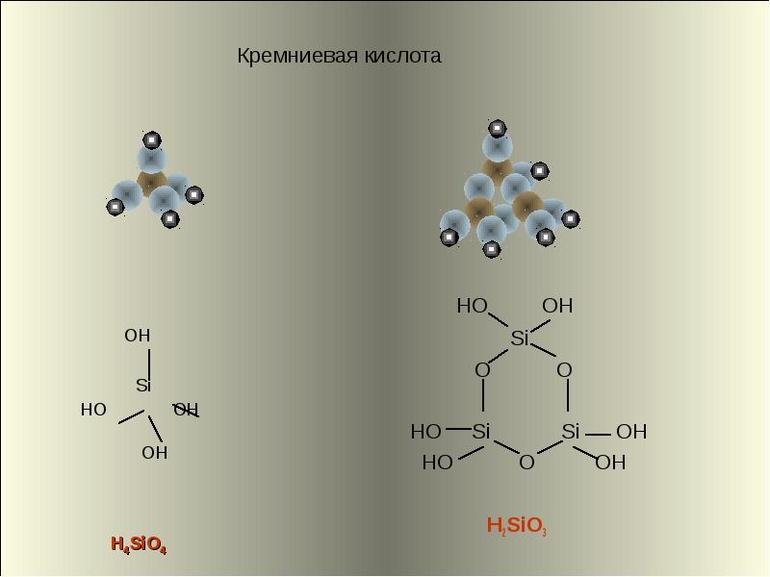
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Видео:Кремниевая кислотаСкачать

Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия). Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода. Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Физические и химические свойства
Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора. Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку). Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10 , K2 = 1,6•10 -12 , а для ортокремниевой K1 = 2•10 -10 , K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2). Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества. Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:
- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3. Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена. Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:
- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях
Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.
Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни. К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами. Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем. Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды. Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.
💡 Видео
Кремниевая кислота получениеСкачать

Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции ионного обмена. 9 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Неметаллы. Тема 28. Оксид кремния(IV). Кремниевая кислота. Видеоопыт «Получение кремниевой кислоты»Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать