Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
- Способ получения
- Качественная реакция
- Химические свойства
- Реакция взаимодействия калия и кислорода
- Реакция взаимодействия калия и кислорода
- Реакция термического разложения карбида кальция
- Реакция взаимодействия магния и хлороводорода
- Реакция взаимодействия оксида неодима (III) и кальция
- Выбрать язык
- Популярные записи
- Предупреждение.
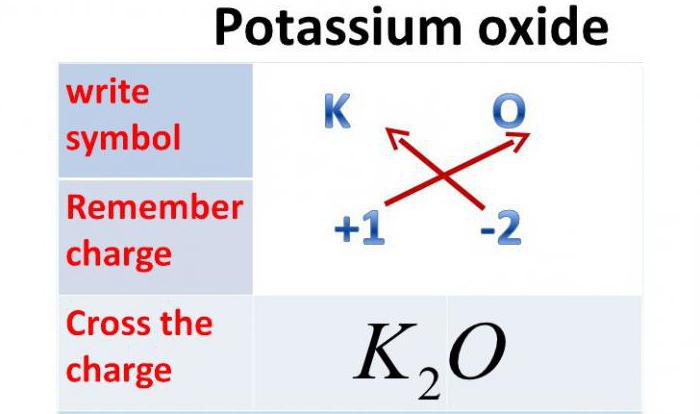
- Оксид калия: формула, взаимодействие
- Что такое оксид?
- Оксид калия: формула
- Физические свойства
- Химические свойства К2О
- Реакция с водой
- С другими оксидами
- Взаимодействие с кислотами
- К2О и галогены
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Получение К2О
- Использование К2О в промышленности
- 💥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Видео:Опыты по химии. Получение кислорода из перманганата калияСкачать

Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Видео:Перманганат калия разложениеСкачать

Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Видео:Получение кислорода из перманганата калияСкачать

Реакция взаимодействия калия и кислорода
Видео:Опыты по химии. Получение кислорода каталитическим разложением хлората калияСкачать

Реакция взаимодействия калия и кислорода
Уравнение реакции взаимодействия калия и кислорода:
Реакция взаимодействия калия и кислорода.
В результате реакции образуется надпероксид калия. Также образуется примесь: пероксид калия K2O2.
Реакция протекает при условии: при нагревании.
Реакция представляет собой сгорание калия на воздухе.
Формула поиска по сайту: K + O2 → KO2.
Реакция термического разложения карбида кальция
Реакция взаимодействия магния и хлороводорода
Реакция взаимодействия оксида неодима (III) и кальция
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Оксид калия: формула, взаимодействие
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Оксид калия: формула
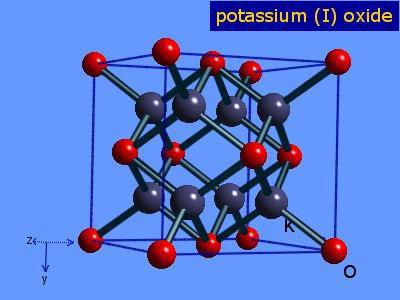
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Видео:получение кислородаСкачать

Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Видео:Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Видео:Опыты по химии. Получение кислорода из перманганата калия и собирание его способом вытеснения водыСкачать

Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
Видео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
Видео:ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Видео:Разложение перманганата калия. Химический опытСкачать

Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Видео:Кислород. 8 класс.Скачать

Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Видео:Получение кислорода в лаборатории и проба на кислород. Задание 13. Химия ОГЭСкачать

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
💥 Видео
Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать