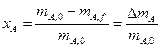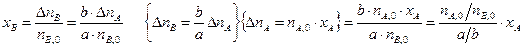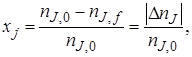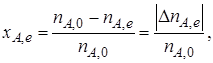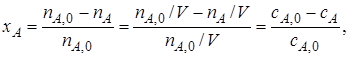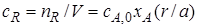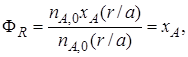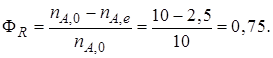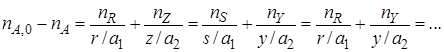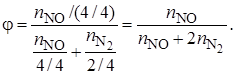Работу химических производств в целом оценивают по экономическим показателям, таким как, прибыль, себестоимость продукции, капитальные затраты и т.д.
Экономические показатели процесса в значительной мере зависят от технологических: конверсия (степень превращения), селективность, выход продукта, расходные коэффициенты по сырью, вспомогательным материалам (растворители, катализаторы) и др. Эти показатели с разных сторон характеризуют глубину протекания химико-технологического процесса, его полноту и направленность в сторону образования целевого продукта.
1. Конверсия X (степень превращения) исходного реагента это доля исходного реагента, использованного на химическую реакцию – показывает, насколько полно в ХТП используется исходное сырье.
Для реакции аА + bВ ® rR + sS
степень превращения реагента А:
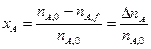
Или через концентрации
через массы
Зная конверсию одного из реагентов можно выразить конверсии других реагентов, участвующих в реакции.
Из конечного уравнения следуют частные случаи:
а) если 
б) если 
Пределы конверсии: 0
(индекс е от лат. equilibrium – «равновесие»).
Степень превращения ХА характеризует процесс не полностью: даже прореагировав целиком, реагент может послужить образованию не целевого, а побочного продукта.
2. Селективность (j — позволяет оценить эффективность целевой реакции по сравнению с побочными).
Полная, или интегральная селективность j – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству реагента, расходуемого на целевую и побочную реакции вместе:

Пределы селективности: 0
4. Расходные коэффициенты РК (Ктеор, Кпр.) по сырью количество сырья или энергии каждого вида, затрачиваемое на производство единицы массы или объема готовой продукции. РК по сырью выражаются в т/т, кг/кг, и т.д.; по энергии, соответственно, в кВт×ч/т.
Теоретические РК рассчитываются на основе стехиометрического уравнения целевой реакции, как отношение молярной массы реагента к молярной массе целевого продукта с учетом стехиометрических коэффициентов.
Практические РК рассчитывают из практических данных по материальным балансам производств.
РК показывает расход чистого реагента при полной конверсии без протекания побочных реакций и без учета потерь на получение единицы продукции.
5. Показателем, характеризующим эффективность работы машин, аппаратов, цехов и заводов в целом, служит производительность. Производительность – это количество выработанного продукта или переработанного сырья в единицу времени:
где П – производительность; m – количество продукта; τ – время.
Производительность измеряется в килограммах в час (кг/ч), тоннах в сутки (т/сут), или, кубических метрах в сутки (м 3 /сут) и т.д. Максимально возможная в данных условиях производства производительность называется мощностью.
Производительность может быть отнесена к отдельному аппарату, технологической линии, цеху, предприятию в целом.
6. Для сравнения работы аппаратов и установок различного устройства и размеров, в которых протекают одни и те же химические процессы, используется понятие интенсивность. Интенсивность I аппарата (машины, реактора) это его производительность, отнесенная к единице величины, характеризующей размеры рабочей части аппарата объема V или площади сечения S:
где V – объем аппарата (реактора).
Интенсивность может измеряться количеством продукта, получаемого в течение единицы времени с единицы объема аппарата. Например, (кг/ч×м 3 ), или с единицы сечения аппарата (т/сут×м 2 ) и т.д.
Интенсивность по катализатору
7. Качество продукции – совокупность технических, эксплуатационных, экономических и других свойств, обуславливающих ее пригодность для удовлетворения личных или производственных потребностей в соответствии с ее назначением. В большинстве случаев качество химических продуктов определяется их чистотой или содержанием в них основного вещества. Производство высокочистых или концентрированных продуктов важно не только с точки зрения качества конечного продукта, идущего на народное потребление, но и по многим другим причинам. Например, применение концентрированных продуктов повышает интенсивность процессов, в которых они используются в качестве сырья. Это приобретает особое значение для химической промышленности, продукция которой представляет собой главным образом сырье или средство производства, а не непосредственного потребления.
Особенно большие требования к чистоте химических продуктов предъявляются при производстве химических реактивов и особо чистых веществ, применяемых в некоторых технологических процессах. Так, например, содержание окислов азота и хлора в реактивной серной кислоте должно быть не более 10 -4 %, а содержание мышьяка – не более 3×10 -6 %.
Качество продукции измеряется системой показателей, охватывающих различные области использования продукции: надежности, долговечности. Эти показатели задаются государственными стандартами (ГОСТ) и техническими условиями (ТУ) на продукцию.
По мере совершенствования химико-технологических процессов, а также по требованию потребителей химических продуктов стандарты систематически пересматриваются. При этом проводится большая исследовательская работа по оценке возможностей промышленности, вырабатывающей тот или иной продукт, а также по установлению обоснованности выдвигаемых потребителями требований. В результате такой работы составляется новый стандарт, в котором предусматриваются более качественные показатели продукции (все или некоторые из них).
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Технологические критерии эффективности химико-технологического процесса
Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т. д. Естественно, что окончательная оценка эффективности химико-технологического процесса выводится из этих критериев. Однако они характеризуют весь процесс в целом, его конечный результат, не входя в детальное рассмотрение внутренней сущности, особенностей процесса.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы.
В качестве таких показателей принято, прежде всего, использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции.
Степень превращения.Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Степень превращения – это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента J
где nJ, 0 – количество реагента J в исходной реакционной смеси;
пJ, f– количество реагента J в реакционной смеси, выходящей из аппарата или находящейся в реакторе; ∆nJ – изменение количества реагента J в ходе химической реакции.
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). Степень превращения может быть рассчитана по первому, второму или третьему реагенту, причем в общем случае не обязательно получаются равные результаты.
Если протекает реакция (I), то в соответствии с ее стехиометрическим уравнением изменения количеств ее участников ∆nJ связаны между собой следующими соотношениями:
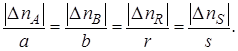
Степени превращения реагентов А и В, участвующих в реакции (I):
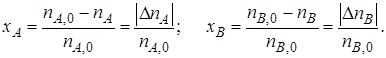
Из уравнений (1.3) и (1.4) следует
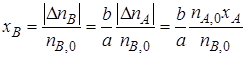
или 
Уравнение (1.5) устанавливает связь между степенями превращения реагентов А и В и позволяет рассчитать неизвестную степень превращения одного реагента, зная степень превращения другого.
Если 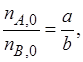
Если 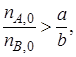
Необходимо помнить, что степень превращения – это доля первоначального количества реагента, т. е. пределы изменения х определяются соотношением
Следовательно, если один из реагентов (например, реагент В) взят в избытке, то с учетом выражений (1.5) и (1.6) всегда хВ
где nА,е – количество реагента А в условиях равновесия; | nА,е | – изменение количества реагента А к моменту наступления равновесия (максимально возможное при данных условиях осуществления химической реакции).
Используя степень превращения реагентов, можно определить количество продуктов R и S, образовавшихся в результате реакции (I), не осложненной наличием побочных взаимодействий. Изменение количества продукта реакции (I), например продукта R, в соответствии со стехиометрическими соотношениями (1.2) можно выразить через изменение количества реагента А или реагента В. Если первоначальное количество продукта R равно нулю (пR,0 = 0), то
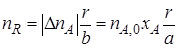
или 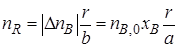
В качестве ключевого реагента, через степень превращения которого выражают количества продуктов, удобно брать реагент, взятый либо в недостатке, либо в стехиометрическом соотношении к другому реагенту. Например, если в качестве такого выбран реагент А, должно выполнятся условие
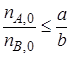
Максимально возможное количество продукта R, которое может быть получено при проведении обратимой реакции
аА+ bB 
рассчитывают как равновесное количество этого продукта R, e:
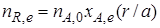
Если реакционный объем V – постоянная величина (V = const), то во всех приведенных выше соотношениях количества реагентов и продуктов могут быть заменены молярными концентрациями. Например,
Выход продукта.Степень превращения характеризует эффективность проведения процесса с точки зрения использования исходного сырья, но этой величины не всегда достаточно для характеристики процесса с точки зрения получения продукта реакции. Поэтому вводят еще один критерий эффективности – выход продукта.
Выход продукта – отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
Обозначим выход продукта R через ФR. Тогда
Величина nR,max в уравнении (1.10)зависит от типа осуществляемой химической реакции. Рассмотрим несколько различных реакций.
Необратимая химическая реакция (I). Максимально возможное количество продукта R в такой реакции будет получено, если весь реагент А (nА,0) вступит в реакцию [при этом в качестве реагента А должен быть выбран такой, который удовлетворяет условию (1.8)]
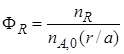
т. е. для простых необратимых реакций выход продукта и степень превращения реагента совпадают. Однако для других типов химических реакций эти два критерия эффективности различаются.
Обратимая химическая реакция (III). Для такой реакции максимально возможное количество продукта R определяется по уравнению (1.9) как равновесное количество продукта R при данных условиях осуществления реакции (температура, давление, соотношение начальных концентраций реагентов). Тогда с учетом уравнения (1.7)
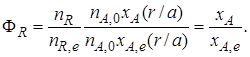
Таким образом, для обратимых реакций выход продукта равен доле, которую составляет реально достигнутая степень превращения от равновесной для данных условий проведения реакции.
Пример 1.1.Пусть протекает реакция
А + 2В 
Начальное количество реагентов nА,0 = 10 кмоль; nB,0 = 25 кмоль. В реакционной смеси, выходящей из реактора, содержится 12 кмоль продукта R. Известно, что в равновесной смеси при данных условиях проведения реакции содержится 2,5 кмоль продукта А.
Определим выход продукта R (ФR). В соответствии с уравнением (1.12)
Определим степень превращения хА, используя уравнение (1.7):
Равновесная степень превращения
Параллельные и последовательные реакции. Рассмотрим две параллельно протекающие реакции, в которых наряду с целевым продуктом R получаются продукты побочной реакции:
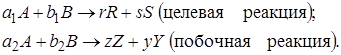
Максимально возможное количество продукта R будет получено в том случае, если весь исходный реагент А при соблюдении условия (1.8) будет реагировать только по целевой реакции. Тогда
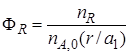
Следует помнить, что выразить nR через степень превращения и начальное количество А в случае сложной реакции нельзя, так как расходование вещества А происходит не только в целевом направлении, но и в побочном.
Так же будет выглядеть и выражение для выхода целевого продукта R для последовательных реакций, например реакций типа
aА 

При протекании обратимых параллельных и последовательных реакций максимально возможным количеством целевого продукта будет то количество R, которое было бы получено, если бы реагент А расходовался только на целевую реакцию и в момент равновесия продуктов побочных реакций не было бы.
Таким образом, для обратимых сложных реакций

Как и степень превращения, выход продукта для реакционных систем с постоянным объемом может быть определен как отношение концентраций. Следует также помнить, что выход, выражаемый как доля от некоторой предельно возможной величины, изменяется от 0 до 1.
Селективность.Выход продукта характеризует полученный результат, как долю от предельно возможного результата. Целесообразно оценить и реальную ситуацию, т. е. дать количественную оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием для такой оценки является селективность. Селективность, как и два предыдущих критерия эффективности, выражают в долях единицы или процентах.
Полная, или интегральная, селективность φ– это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные):
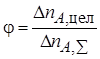
Мгновенной, или дифференциальной, селективностью φ / называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов:
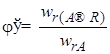
где 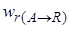
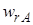
Использование дифференциальной селективности при анализе технологических процессов будет описано в гл. 3. Здесь рассмотрим только полную селективность.
Для реакций (III) полная селективность по целевому продукту R может быть выражена через количество полученного продукта R и количество реагента А, суммарно израсходованного на реакцию.
С учетом стехиометрических соотношений количество реагента А, вступившего в реакцию образования целевого продукта, равно (a/r) nR.
Тогда полная селективность
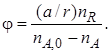
Знаменатель в уравнении (1.15) можно заменить через количество полученных продуктов целевой и побочной реакции с учетом стехиометрических соотношений:
Пример 1.2.Рассмотрим в качестве примера параллельные реакции
4NH3 + 5О2 
4NH3 + ЗО2 
Целевой является реакция получения оксида азота NO.
Селективность можно рассчитать по количеству полученных на выходе из реактора продуктов целевой реакции (оксида азота) и побочной реакции (азота):
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь. Рассмотрим ее сначала на примере необратимых параллельных реакций (IV).
В соответствии с уравнением (1.13) выход продукта R
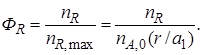
Реально полученное количество продукта R можно выразить через селективность, пользуясь уравнением (1.15)
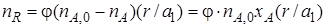
После подстановки уравнения (1.17) в уравнение (1.16) получим
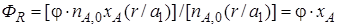
Если параллельные реакции обратимы, то максимально возможное количество продукта R, которое могло бы получиться при отсутствии побочной реакции, определяется условиями равновесия. Тогда для определения выхода продукта нужно применить уравнение (1.14). Подставляя в него значение количества реально полученного продукта R, выраженного с помощью уравнения (1.17), будем иметь более общее уравнение связи между выходом, селективностью и степенью превращения:
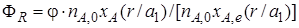

Из уравнений (1.18)и (1.19)следует, что при выборе условий проведения сложных химических реакций недостаточно обеспечить только высокое значение степени превращения реагентов или только высокую селективность; высокое значение выхода целевого продукта определяется некоторой совокупностью этих критериев эффективности.
Оптимальными значениями выхода, селективности и степени превращения будут, как правило, такие, достижение которых позволяет обеспечить максимальную экономическую эффективность процесса.
Производительность и интенсивность.Важным критерием эффективности работы отдельных аппаратов, цехов или заводов в целом является производительность.
Производительность – это количество продукта, полученное в единицу времени:
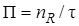
где П – производительность; nR – количество продукта; τ – время. Производительность измеряется в кг/ч, т/сут, т/год и т. д. Например, производительность современного агрегата синтеза аммиака составляет 1360 т аммиака в сутки; производительность агрегата по производству серной кислоты – 1 млн т серной кислоты в год и т. д. Иногда производительность оценивают по количеству переработанного сырья, например производительность печи обжига колчедана – 450 т колчедана в сутки. Если известны концентрация продукта в реакционной смеси, для определения производительности удобно воспользоваться следующей формулой:
где cR – концентрация продукта; v – объемный расход реакционной смеси.
Максимально возможная для данного агрегата, машины производительность (проектная) называется мощностью. Одним из основных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к снижению удельных капитальных затрат, повышению производительности труда.
Для сравнения работы аппаратов различного устройства и размеров, в которых протекают одни и те же процессы, используют понятие «интенсивность».
Интенсивностью называется производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, – его объему, площади поперечного сечения и т. д.
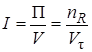
где V – объем аппарата. Интенсивность измеряется в кг/(ч · м 3 ), т/(сут · м 3 ) и т. д.
При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно при создании таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью.
При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора, или его напряженностью.
Вопросы и упражнения для повторения и самостоятельной работы
1. Из каких основных стадий состоит химико-технологический процесс? В каких стадиях химико-технологического процесса участвуют химические реакции?
2. Что такое химический процесс? Почему химический процесс как единичный процесс химической технологии сложнее по сравнению с тепловыми и массообменными процессами?
3. Объясните взаимное влияние химической реакции и явлений тепло- и массопереноса на примерах:
а) сгорание в потоке воздуха частицы колчедана;
б) разложение фторапатита Ca5F(PO4)3 серной кислотой;
в) получение аммиачной селитры при взаимодействии газообразного аммиака с раствором азотной кислоты.
4. Какие технологические критерии эффективности химико-технологического процесса вы знаете? Дайте их определения.
5. Каковы пределы изменения степени превращения, выхода продукта, селективности?
6. Что означает выражение «реагенты взяты в стехиометрическом соотношении»?
7. Выведите уравнение связи между степенями превращения двух реагентов, вступающих в реакцию
аА + bВ 
8. В химической реакции участвуют два реагента А и В, причем на каждый моль реагента А взято по 2 моль реагента В. В каком случае будет справедливо утверждение, что степень превращения хА реагента А больше степени превращения хВ реагента В?
9. В чем различия между действительной и равновесной степенями превращения реагента?
10. С какой целью при проведении химических процессов в промышленных условиях один из реагентов часто берут в избытке по отношению к стехиометрии реакции? Каковы пути использования реагента, взятого в избытке и не вступившего в реакцию?
11. Определите состав смеси (сА, сВ, cR, cS) и степень превращения jcb для реакции А + 2В 
сB,0 = 1,5 кмоль/м 3 .
12. Выведите уравнение связи между выходом продукта и степенью превращения одного из реагентов для обратимой химической реакции, не сопровождающейся побочными взаимодействиями.
13. Рассчитайте выход продукта Р, если известно, что при проведении последовательных реакций
А+ В 
Р + М 
получено 12 моль продукта Р, 4 моль продукта S, а для проведения реакций было взято по 20 моль реагентов А и В.
14. В чем различие между полной (интегральной) и мгновенной (дифференциальной) селективностями?
15. Выведите уравнение взаимосвязи между выходом целевого продукта R, степенью превращения реагента А и полной селективностью φ при проведении двух необратимых последовательных реакций
А 
R 
16. Выведите уравнение взаимосвязи между выходом целевого продукта, степенью превращения реагента и полной селективностью при проведении параллельных обратимых реакций
а1А + b1В 
a2А + b2B 
17. Рассчитайте полную селективность, если при проведении последовательных реакций
A 
R 
получено 6 моль продукта R и 2,5 моль продукта S.
18. Протекают последовательные реакции А 

19. Определите выход продукта R и степень превращения хА реагента А, если обратимая реакция А 
20. Протекают параллельные реакции
2А 
А 
Определите выход продукта R, степень превращения хА реагента А и полную селективность φ, если на выходе из реактора сА,f = 2 кмоль/м 3 , cR, f = 3 кмоль/м 3 , cS, f = 3,5 кмоль/м 3 .
21. Что называется производительностью, мощностью, интенсивностью?
22. Как связаны между собой:
а) производительность и степень превращения реагента;
б) производительность и выход целевого продукта?
23. Определите понятия «технологический режим», «технологическая схема процесса».
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ВАРИАНТЫ ТЕСТОВЫХ ЗАДАНИЙ БАЗОВОГО УРОВНЯ ПО ДИСЦИПЛИНЕ «ХИМИЧЕСКИЕ РЕАКТОРЫ» 1. Критерии эффективности функционирования химических реакторов
1 ВАРИАНТЫ ТЕСТОВЫХ ЗАДАНИЙ БАЗОВОГО УРОВНЯ ПО ДИСЦИПЛИНЕ «ХИМИЧЕСКИЕ РЕАКТОРЫ». Критерии эффективности функционирования химических реакторов.к каким веществам относится понятие степень превращения? а) к полупродуктам; б) к отходам производства; в) к концентрату; г) к сырью..к каким веществам относится понятие степень конверсии? а) к полупродуктам; б) к отходам производства; в) к концентрату; г) к сырью 3.Что обозначает технологический показатель ХА: а) неизвестное количество вещества А; б) выход продукта А; в) количество прореагировавшего вещества А; г)степень превращения реагента А 4.Степень превращения реагента рассчитывается по уравнению: а) ; б) ; в) ; г). 5.Выход продукта рассчитывается по уравнению: max max а) ; б) ; в) ; г) max ; max max 6.Что обозначает технологический показатель φ: а) количество полученного продукта ; б) выход продукта ; в) долю прореагировавшего сырья; г) селективность переработки реагента А в продукт. 7.Что означает понятие «дифференциальная селективность»? а) Долю от переработанного сырья, пошедшего на получение целевого продукта при проведении сложных реакций; б) Отношение скоростей прямой и обратной реакций при проведении простой обратимой реакции; в) Отношение скорости переработки реагента А по одной из реакций к общей скорости его переработки по всем одновременно идущим реакциям; г) Отношение скорости переработки реагента А к скорости образования целевого продукта. 8.Что в технологических критериях эффективности ХТС характеризует понятие «интегральная селективность»? а) Долю переработанного сырья при проведении простой необратимой реакции; б) Долю переработанного сырья при проведении простой обратимой реакции; в) Суммарную долю переработанного сырья при проведении сложных параллельных реакций; г) Долю от переработанного сырья, пошедшего на получение целевого продукта при проведении сложных реакций; 9.Интегральная селективность процесса рассчитывается по уравнению: а) ; б) ; в) ; г) ;.Какое уравнение описывает связь между технологическими критериями для необратимых сложных реакций? а) ; б) ; в) ; г) ; p max Ê p
2 .Какое уравнение описывает связь между технологическими критериями для обратимых сложных реакций? а) ; б) ; в) ; г) ; p.какое уравнение описывает связь между технологическими критериями для необратимых простых реакций? а) ; б) ; в) ; г) ; p 3.Какое уравнение описывает связь между технологическими критериями для обратимых простых реакций? а) ; б) ; в) ; г) ; p. Гомогенные химические процессы 4.Математическое выражение скорости гомогенного процесса имеет вид: p p p а) d б) d S j d d V j в) d г) d S j d d V j 5.Уравнение скорости реакции второго порядка типа АГ ДГ + СГ имеет вид: E T а) kb б) k e ) E T в) k e ) ) B г) ) Е Ао ) T k д) kое ) ) E е) T k e ) ) B 6.Уравнение скорости реакции первого порядка типа АГ ДГ + СГ имеет вид: E T а) kb б) k e ) E T в) k e ) ) B г) k E T ое ) ) Е Ао ) д) T kое )
3 E е) T k e ) ) B 7.Уравнение скорости реакции второго порядка типа Аг+ Вг Дг имеет вид: а) k B k E T б) k e ) B ) k в) k ) B ) k ) ) B ) E г) k д) T ke ) B ) ) 8.Уравнение скорости реакции первого порядка типа АЖ ДЖ + СЖ имеет вид: E T а) kb б) k e ) E T в) k e ) ) B г) ) Е ) T k д) kое ) ) е) k E T e ) 9.Уравнение скорости реакции второго порядка типа АЖ ДЖ + СЖ имеет вид: E T а) kb б) k e ) E T в) k e ) ) B г) ) Е ) T k д) kое ) ) е) k E T e ).Уравнение скорости реакции типа Аж+ Вж+ Кат ж) ж имеет вид: а) k B k E T б) k e А ) B ) k E T в) k e ) ) B k e ) ) С E T г) А B кат.скорость гомогенного процесса, протекающего в жидкой фазе, можно увеличить, если:
4 а) уменьшить температуру, б) увеличить давление, в) уменьшить давление, г) увеличить температуру..уравнение изобары Вант-Гоффа имеет вид: d ln аав. Q а) б) dt T d ln K p H dt T ; d ln K p d ln K p H в) г) д) G T ln K p dp T dt T 3.Уравнение показывающее влияние давления на константу равновесия имеет вид:: d ln аав. Q а) б) dt T d ln K p H dр T ; в) d ln K p dp T d ln K p H г) д) G T ln K p dt T 4.Уравнение изобары Вант-Гоффа дает зависимость между: а) Р и Т; б) ХА равн. и Р ; в) Н и Т ; г) КР и Т ; д) G и КР 5.К каким последствиям приведет повышение температуры при проведении обратимой экзотермической реакции: а) увеличению равновесной степени превращения сырья; б) увеличению равновесного выхода продукта; в) уменьшению равновесной степени превращения; г) уменьшению скорости процесса. 6.К каким последствиям приведет повышение температуры при проведении необратимой эндотермической реакции: а) уменьшению скорости процесса; б) увеличению равновесного выхода продукта; в) увеличению скорости процесса; г) уменьшению равновесной степени превращения. 7.К каким последствиям приведет повышение температуры при проведении обратимой эндотермической реакции: а) увеличению равновесной степени превращения сырья и уменьшению скорости процесса; б) уменьшению выхода продукта и увеличению давления; в) увеличению выхода продукта и скорости реакции; 8.Если протекает обратимая экзотермическая реакция, то повышение температуры: а) приводит к увеличению равновесной степени превращения реагента; б) приводит к уменьшению равновесной степени превращения реагента; в) приводит к увеличению равновесного выхода продукта; г) не влияет на смещение равновесия реакции. 9.Линия оптимальных температур может быть построена в координатах: а) ХА-Т; б) — ; в)- ; г) — 3.К каким последствиям приведет повышение давления при проведении реакции типа АГ ДГ +
5 СГ: а) никаким; б) увеличению равновесного выхода продукта; в) увеличению равновесной степени превращения реагента А; г) уменьшению равновесной степени превращения реагента А и увеличению скорости реакции; д) уменьшению скорости реакции. 3.К каким последствиям приведет понижение давления при проведении реакции типа АГ ДГ + СГ: а) никаким; б) увеличению скорости реакции; в) увеличению равновесной степени превращения реагента А; г) уменьшению равновесной степени превращения реагента А. 3.К каким последствиям приведет понижение давления при проведении реакции типа АГ + ВГ ДГ: а) никаким; б) увеличению скорости реакции; в) увеличению равновесной степени превращения реагента А; г) уменьшению равновесной степени превращения реагента А. 33.К каким последствиям приведет повышение давления при проведении реакции типа АЖ ДЖ + СЖ: а) никаким; б) увеличению скорости и равновесного выхода продукта; в) увеличению равновесной степени превращения реагента А и уменьшению скорости реакции; г) уменьшению равновесной степени превращения реагента А и увеличению скорости реакции; д) уменьшению равновесной степени превращения реагента А и уменьшению скорости реакции. 34.К каким последствиям приведет пропорциональное увеличение концентрации реагирующих веществ при проведении реакции типа АГ + ВГ Дг: а) никаким ; б) увеличению скорости реакции; в) увеличению равновесной степени превращения реагента А; г) уменьшению равновесной степени превращения реагента А; д) уменьшению скорости реакции. 35.Как повлияет пропорциональное увеличение концентрации реагирующих веществ на степень превращения реагента А при проведении реакции типа АГ + ВГ Дг : а) никак; б) степень превращения реагента А увеличивается; в) степень превращения реагента А уменьшается. 36.К каким последствиям приведет значительное увеличение концентрации реагента В при проведении реакции типа АГ + ВГ Дг : а) никаким; б) увеличению степени превращения реагента А; в) уменьшению степени превращения реагента А.; г) уменьшению скорости реакции. 37.К каким последствиям приведет добавление в реакционную смесь инертного компонента при проведении реакции типа АГ ДГ + КГ: а) никаким; б) увеличению равновесного выхода продукта; в) уменьшению равновесной степени превращения реагента А; г) уменьшению равновесного выхода продукта. 38.К каким последствиям приведет добавление в реакционную смесь инертного компонента при проведении реакции типа АГ + ВГ ДГ : а) никаким; б) увеличению равновесного выхода продукта; в) увеличению равновесной степени превращения реагента А; г) уменьшению равновесной степени превращения реагента А.
6 3. Гетерогенные химические процессы 39.В чем заключается особенность квазигомогенной модели гетерогенного процесса в системе Г- Т: а) рассматривается твердая частица шарообразной формы, наружный размер которой не изменяется в процессе реакции, а на месте прореагировавшей части образуется слой золы; б) рассматривается твердая частица шарообразной формы, наружный размер которой изменяется в процессе реакции от до r ; в) рассматривается твердая частица шарообразной формы, наружный размер которой изменяется в процессе реакции от до r без образования слоя золы; г) рассматривается твердая частица шарообразной формы, реакция в которой протекает сразу во всем объеме. 4.В чем заключается особенность модели гетерогенного процесса в системе Г-Т с фронтальным перемещением зоны реакции: а) рассматривается твердая частица шарообразной формы, наружный размер которой не изменяется в процессе реакции, а на месте прореагировавшей части образуется слой золы; б) рассматривается твердая частица шарообразной формы, наружный размер которой изменяется в процессе реакции от до r ; в) рассматривается твердая частица шарообразной формы, наружный размер которой изменяется в процессе реакции от до r без образования слоя золы; г) рассматривается твердая частица шарообразной формы, реакция в которой протекает сразу во всем объеме. 4.Стадия гетерогенного процесса, определяющая его скорость, характеризуемая минимальным значением коэффициента интенсивности и максимальной движущей силой называется: а) медленной; б) определяющей; в) наблюдаемой г) лимитирующей 4.Математическое выражение скорости гетерогенного процесса имеет вид: а) d б) d S j d в) d V j d г) d S j d d V j 43.Константа скорости гетерогенного процесса в системе Г-Т согласно модели с фронтальным перемещением зоны реакции имеет вид: а) k гет б) k гет k в) k гет k k г) kгет 44.Выражение скорости гетерогенного процесса во внешнедиффузионной области имеет вид: а) ; ) ; в) k г) KS 45.Выражение скорости гетерогенного процесса во внутридиффузионной области имеет вид: а) ; б) в) k г) KS 46.Выражение скорости гетерогенного процесса в кинетической области имеет вид: а) ; б) ; в) k; г) KS 47.В какой области протекает гетерогенный процесс в системе Г-Т, если температурный коэффициент скорости равен,:
7 а) внешнедиффузионной; б) внутридиффузионной; в) кинетической; г) диффузионной; д) переходной. 48.В какой области протекает гетерогенный процесс в системе Г-Т, если его скорость зависит от линейной скорости газового потока: а) внешнедиффузионной; б) внутридиффузионной; в) кинетической; г) переходной. 49.В какой области протекает гетерогенный процесс в системе Г-Т, если его скорость зависит от размера твердой частицы: а) внешнедиффузионной; б) внутридиффузионной; в) кинетической; г) переходной. 5.Условиями интенсификации процесса в системе Г-Т, лежащем во внешнедиффузионной области являются: а) увеличение скорости газового потока; б) увеличение дисперсности твердой фазы; в) увеличение температуры; 5.Условиями интенсификации процесса в системе Г-Т, лежащем во внутридиффузионной области являются: а) увеличение скорости газового потока; б) увеличение дисперсности твердой фазы; в) увеличение температуры. 5.Условием интенсификации процесса в системе Г-Т, лежащем в кинетической области является: а) увеличение скорости потока; б) увеличение Т; в) интенсивное перемешивание; 53.Применение катализатора не позволяет: а) увеличить скорость процесса; б) увеличить равновесный выход продукта; в) увеличить скорость одной из нескольких одновременно идущих реакций; г) уменьшить температуру проведения процесса; 54.Вычеркните несуществующий вид катализа: а) гомогенный; б) гетерогенный; в) ускоренный; г) ферментативный; д) автокатализ. 55.Что понимают под «температурой зажигания катализатора»: а) температура начала реакции с необходимой скоростью; б) минимальная температура возгорания катализатора; в) минимальная температура разрушения катализатора; г) предельная температура работы катализатора. 56.Что понимают под селективностью катализатора: а) увеличение скорости одной из нескольких одновременно идущих реакций; б) выбор одного из реагентов; в) увеличение равновесной степени превращения по одной из нескольких реакций; г) автоматический выбор условий проведения процесса. 57.Что понимают под отравляемостью катализатора? а) потерю активности под действием температуры; б) потерю активности под действием избыточного давления; в) потерю активности под действием химических веществ; г) изменение температуры зажигания катализатора.
8 4. Химические реакторы.по тепловому режиму реактора подразделяются на: а) политермические, адиабатические, изотермические. б) политермические, эндотермические, экзотермические. в) политермические, адиабатические, стационарные, изотермические. г) периодические, непрерывные, полупериодические..что понимают под изотермическим реактором? а) реактор, имеющий постоянную температуру реакционной смеси на входе, в объеме реактора и на выходе; б) реактор, работающий без теплообмена с окружающей средой; в) реактор, работающий без подвода или отвода тепла. 3.Изотермические реакторы: а) работают без изменения объема реакционной смеси, б) имеют постоянную температуру реакционной смеси во всем объеме реактора, в) работают без теплообмена с окружающей средой. г) работают при постоянном давлении. 4.Что характеризует адиабатический режим работы аппарата? а) реакция в реакторе идет с поглощением тепла, б) процесс в реакторе идет при постоянном давлении, в) отсутствует теплообмен с окружающей средой, г) объем реакционной смеси в реакторе в ходе процесса не меняется. 5.Что характеризует политермический режим работы аппарата? а) тепло реакции компенсируется теплообменом с окружающей средой, б) тепло реакции расходуется на теплообмен с окружающей средой и изменение температуры реакционной смеси, в) тепло реакции расходуется на изменение температуры реакционной массы, г) температура в реакторе поддерживается постоянной. 6.По способу организации процесса реакторы делятся на: а) стационарные, нестационарные, полустационарные, б) периодические, непрерывные, полупериодические, в) политермические, адиабатические, изотермические, автотермические, г) реактора для проведения гомогенных и гетерогенных процессов. 7.По способу организации процесса не различают реакторов: а) периодического действия; б) полунепрерывного действия; в) непрерывного действия; г) последовательного действия. 8.При стационарном режиме работы реактора: а) параметры процесса не меняются в зависимости от объема аппарата, б) параметры процесса изменяются в зависимости от объема аппарата, в) параметры процесса изменяются в зависимости от времени процесса, г) параметры процесса не изменяются в зависимости от времени процесса. 9.В зависимости от характера изменения параметров процесса во времени химические реакторы могут работать в режимах: а) нестационарном; б) неустойчивом; в) невыгодном; г) стабильном.
9 .Какой реактор работает в нестационарном режиме? а) РИС-Н, б) КРИС-Н, в) РИС-П, г) РИВ..Стационарный режим работы химических реакторов описывается уравнением: а) d d ; б) в) d dl СА fx,y,z) г) dt dv.по фазовому составу реакционной смеси реакторы классифицируются на: а) стационарные, нестационарные, б) периодические, непрерывные, полунепрерывные, в) политермические, адиабатические, изотермические, автотермические, г) реактора для проведения гомогенных и гетерогенных процессов. 3.РИС-Н является: а) емкостным аппаратом с перемешивающим устройством, б) реактором, работающим в нестационарных условиях, в) аппаратом, в котором реакционная смесь движется в режиме вытеснения, г) реактором для проведения гетерогенных процессов. 4.РИС-Н — это реактор в котором: а) СА = fx,y,z), = fτ); б) СА fx,y,z), fτ); в) СА fx,y,z), = fτ); г) СА = fx,y,z), fτ) 5.Уравнение материального баланса РИС-Н: а) Авх. Авых. Ах.р. = Анак б) Ах.р. = Анак в) Авх. Авых. Ах.р. = г) Авх. Авых. Ах.р. Адиф.= Анак 6.Уравнение материального баланса РИС-Н: а) САоо- СА-Vp = б) САi-о- САi о -Vpii = в) Vpd = d САVp) г) САо- СА + dса)-dvp = 7.Выберите характеристическое уравнение для РИС-Н: Х С а) τ = А d б) τ = С в) г) А d А 8.Выберите уравнение для расчета объема РИС-Н а) Vp = mvp б) Vp = υ τ в) Vp = П n год /ρ циклов г) Vp = υ
10 9.Какое уравнение описывает работу РИС-Н в политермических условиях? K F TT a) -H) = б) -H) = pt-t) в) -H)d = pdt K F TT г) -H) = pt-t) -.Какое уравнение описывает работу РИС-Н в изотермических условиях? K df TT K F TT a) -H)d = б) -H)d = dτ Vp в) -H) = K F TT г) -H) = pt-t).какое уравнение описывает работу РИС-Н в адиабатических условиях? а) -H) = pt-t) K df TT б) -H)d = в) -H)d = pdt K F TT г) -H) =.Каскад реакторов идеального смешения непрерывного действия применяют для: а) увеличения суммарного объема реактора, б) снижения движущей силы процесса, в) уменьшения выхода продукта, г) увеличения выхода продукта. 3. С какой целью используют каскады реакторов смешения? а) чтобы замедлить скорость экзотермических реакций; б) чтобы увеличить эффективность процесса проводимого в режиме смешения; в) чтобы уменьшить выход продукта; г) чтобы повысить начальную концентрацию реагента. 4. Использование каскада реакторов идеального смешения непрерывного действия не позволяет: а) увеличить степень превращения реагентов, б) увеличить движущую силу процесса, в) увеличить начальную концентрацию реагента, г) увеличить выход продукта. 5. Для КРИС-Н справедливо утверждение: а) для каждого реактора каскада сохраняются допущения об идеальности РИС-Н, б) VРИС-Н 11 — i а) б) i в) i d г) А d А 8. В аналитическом методе расчета объема каскада реакторов: а) задаются общей степенью превращения в каскаде реакторов как ХА =,3,6 ХА б) задаются степенью превращения в первом реакторе каскада как ХА =,3,6 ХА в) задаются концентрацией реагента в первом реакторе каскада как СА =,4,6 СА г) задаются произвольным значением степени превращения в первом реакторе каскада 9. Выберите уравнение для расчета объема КРИС-Н: а) Vp = mvp б) Vp = mvp в) Vp = П n год /ρ циклов г) Vp = υ + 3. Увеличения ХА при проведении обратимых и необратимых эндотермических реакций в адиабатическом РИС-Н стационарное состояние) можно добиться с: а) увеличением температуры реакционной смеси при входе в реактор, б) уменьшением начальной концентрации реагента при входе в реактор, в) увеличением объемного расхода реакционной смеси при входе в реактор, г) уменьшением температуры реакционной смеси при входе в реактор. 3. Увеличения ХА при проведении необратимых экзотермических реакций в адиабатическом РИС-Н стационарное состояние) можно добиться с: а) увеличением температуры реакционной смеси при входе в реактор, б) уменьшением температуры реакционной смеси при входе в реактор, в) увеличением концентрации реагента при входе в реактор, г) увеличением давления. 3. Что можно сделать для увеличения степени превращения реагента А при проведении простой обратимой экзотермической реакции в адиабатическом РИС-Н? а) увеличить САо; б) уменьшить САо; в) увеличить То 33. РИС-П является: а) реактором, работающим в стационарных условиях, б) аппаратом, в котором реакционная смесь движется в поршневом режиме, в) емкостным аппаратом с перемешивающим устройством, г) проточным химическим реактором. 34. РИС-П это реактор в котором: а) СА = fx,y,z), = fτ); б) СА fx,y,z), fτ); в) СА fx,y,z), = fτ); г) СА = fx,y,z), fτ) 35. Уравнение материального баланса РИС-П: а) Авх. Авых. Ах.р. = Анак б) Ах.р. = Анак в) Авх. Авых. Ах.р. = г) Авх. Авых. Ах.р. Адиф.= Анак
12 36. Уравнение материального баланса РИС-П: а) САоо- СА-Vp = б) САi-о- САi о -Vpii = в) Vpd = d САVp) г) САо- СА + dса)-dvp = 37. Выберите характеристическое уравнение для РИС-П: Х С а) τ = А d б) τ = С в) г) А d А 38. Какое уравнение характеризует работу РИС-П в политермических условиях? K df TT а) -H)d = б) -H)d = pdt K df TT K F TT в) -H)d = pdt г) -H)d = pdt dτ Vp 39. Какое уравнение характеризует работу РИС-П в изотермических условиях? K F TT K df TT а) -H)d = dτ б) -H)d = Vp в) -H)d = pdt г) -H) = pt-t) 4. Какое уравнение характеризует работу РИС-П в адиабатических условиях? а) -H) = pt-t) б) -H)d = pdt в) -H)d = K F TT Vp dτ г) pdt= K F TT Vp dτ 4. Выберите уравнение для расчета объема РИС-П: а) Vp = mvp б) Vp = υ τ в) Vp = П n год /ρ циклов г) Vp = υ 4. Для какого реактора и теплового режима его работы уравнение теплового баланса имеет вид H ) d dt? P а) РИС-П политермический), б) РИС-Н политермический), в) РИС-П адиабатический), г) РИС-Н изотермический). 43. Какой вид имеет общее уравнение теплового баланса непроточного химического реактора, работающего в политермическом режиме, для эндотермической реакции? а) Q вх. + Q х.р.= Q вых. + Qнак. б) -Q х.р + Q т.н = в) — Q х.р.+ Q т.н = Qнак. г) Q вх. — Q х.р. = Q вых.+ Qнак. 44. Какой вид имеет общее уравнение теплового баланса непроточного химического реактора, работающего в изотермическом режиме, для экзотермической реакции? а) Q вх. + Q х.р.= Q вых. + Qнак. б) Q х.р — Q т.н = в) Q х.р.- Q т.н = Qнак. г) Q вх. — Q х.р. = Q вых.+ Qнак. 45. Какой вид имеет общее уравнение теплового баланса непроточного химического реактора, работающего в адиабатическом режиме, для экзотермической реакции? а) Q вх. + Q х.р.= Q вых. + Qнак. б) Q х.р — Q т.н = в) Q х.р.- Q т.н = Qнак. г) Q вх. — Q х.р. = Q вых.+ Qнак.
13 46. РИВ является: а) емкостным аппаратом с перемешивающим устройством, б) реактором, работающим в нестационарных условиях, в) аппаратом, в котором реакционная смесь движется в режиме вытеснения, г) аппаратом периодического действия. 47. РИВ является: а) емкостным аппаратом с перемешивающим устройством, б) реактором, работающим в нестационарных условиях, в) аппаратом, в котором реакционная смесь движется в поршневом режиме, г) аппаратом периодического действия. 48. Уравнение материального баланса РИВ: а) Авх. Авых. Ах.р. = Анак б) Ах.р. = Анак в) Авх. Авых. Ах.р. = г) Авх. Авых. Ах.р. Адиф.= Анак 49. Уравнение материального баланса РИB: а) САоо- СА-Vp = б) САi-о- САi о -Vpii = в) Vpd = d САVp) г) САо- СА + dса)-dvp = 5. Выберите характеристическое уравнение для РИВ: Х а) τ = А Сd б) τ = С в) г) А d А 5. Выберите уравнение для расчета объема РИВ: а) Vp = mvp б) Vp = υ τ в) Vp = П n год /ρ циклов г) Vp = υ 5. Какое уравнение характеризует работу РИВ в политермических условиях? K F TT K F TT а) -H) = pt-t) в) -H)d = dτ Vp K df TT K df TT б) -H)d = pdt г) -H)d = 53.Какое уравнение характеризует работу РИВ в изотермических условиях? K df TT K F TT а) -H)d = б) -H)d = dτ Vp в) -H) = pt-t) г) -H)d = pdt 54.Какое уравнение характеризует работу РИВ в адиабатических условиях? а) -H)d = pdt б) -H) = pt-t) K df TT K df TT в) pdt = г) -H)d = 55. Для какого реактора и теплового режима его работы уравнение теплового баланса имеет вид H ) d dt? P а) РИС-П политермический); б) РИС-Н политермический); в) РИВ адиабатический); г) РИС-Н изотермический). 56. Выберите уравнение теплового баланса химического реактора стационарные условия) для политермического режима работы:

🔥 Видео
Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства ВеществаСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Видеоурок по химии "Типы химических реакций в органической химии"Скачать

25. Схема реакции и химическое уравнениеСкачать

Классификация химических реакций. Видеоурок 38. Химия 9 классСкачать

Ковалентная связь. 8 класс.Скачать
Классификация химических реакций | Химия 11 класс #14 | ИнфоурокСкачать

Химия 9 класс (Урок№9 - Темы «Классификация химических реакций» и «Электролитическая диссоциация».)Скачать

Классификация химических реакций. Вопрос №19 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

9 класс § 5 "Классификация химических реакций".Скачать

Химия 11 класс (Урок№5 - Классификация химических реакций.)Скачать

Физические и химические явления. 7 класс.Скачать

Химия 11 класс: Классификация химических реакцийСкачать