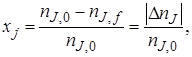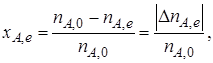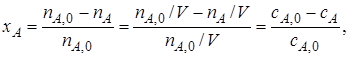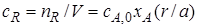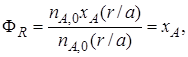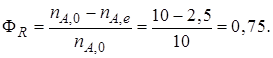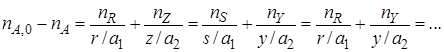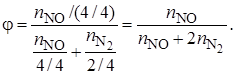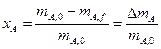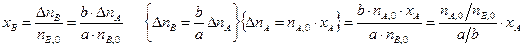Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т. д. Естественно, что окончательная оценка эффективности химико-технологического процесса выводится из этих критериев. Однако они характеризуют весь процесс в целом, его конечный результат, не входя в детальное рассмотрение внутренней сущности, особенностей процесса.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы.
В качестве таких показателей принято, прежде всего, использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции.
Степень превращения.Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Степень превращения – это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента J
где nJ, 0 – количество реагента J в исходной реакционной смеси;
пJ, f– количество реагента J в реакционной смеси, выходящей из аппарата или находящейся в реакторе; ∆nJ – изменение количества реагента J в ходе химической реакции.
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). Степень превращения может быть рассчитана по первому, второму или третьему реагенту, причем в общем случае не обязательно получаются равные результаты.
Если протекает реакция (I), то в соответствии с ее стехиометрическим уравнением изменения количеств ее участников ∆nJ связаны между собой следующими соотношениями:
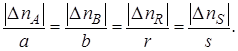
Степени превращения реагентов А и В, участвующих в реакции (I):
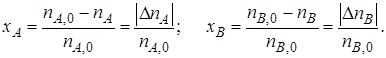
Из уравнений (1.3) и (1.4) следует
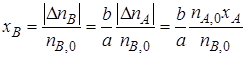
или 
Уравнение (1.5) устанавливает связь между степенями превращения реагентов А и В и позволяет рассчитать неизвестную степень превращения одного реагента, зная степень превращения другого.
Если 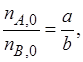
Если 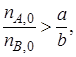
Необходимо помнить, что степень превращения – это доля первоначального количества реагента, т. е. пределы изменения х определяются соотношением
Следовательно, если один из реагентов (например, реагент В) взят в избытке, то с учетом выражений (1.5) и (1.6) всегда хВ
где nА,е – количество реагента А в условиях равновесия; | nА,е | – изменение количества реагента А к моменту наступления равновесия (максимально возможное при данных условиях осуществления химической реакции).
Используя степень превращения реагентов, можно определить количество продуктов R и S, образовавшихся в результате реакции (I), не осложненной наличием побочных взаимодействий. Изменение количества продукта реакции (I), например продукта R, в соответствии со стехиометрическими соотношениями (1.2) можно выразить через изменение количества реагента А или реагента В. Если первоначальное количество продукта R равно нулю (пR,0 = 0), то
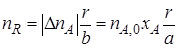
или 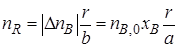
В качестве ключевого реагента, через степень превращения которого выражают количества продуктов, удобно брать реагент, взятый либо в недостатке, либо в стехиометрическом соотношении к другому реагенту. Например, если в качестве такого выбран реагент А, должно выполнятся условие
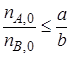
Максимально возможное количество продукта R, которое может быть получено при проведении обратимой реакции
аА+ bB 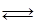
рассчитывают как равновесное количество этого продукта R, e:
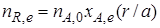
Если реакционный объем V – постоянная величина (V = const), то во всех приведенных выше соотношениях количества реагентов и продуктов могут быть заменены молярными концентрациями. Например,
Выход продукта.Степень превращения характеризует эффективность проведения процесса с точки зрения использования исходного сырья, но этой величины не всегда достаточно для характеристики процесса с точки зрения получения продукта реакции. Поэтому вводят еще один критерий эффективности – выход продукта.
Выход продукта – отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
Обозначим выход продукта R через ФR. Тогда
Величина nR,max в уравнении (1.10)зависит от типа осуществляемой химической реакции. Рассмотрим несколько различных реакций.
Необратимая химическая реакция (I). Максимально возможное количество продукта R в такой реакции будет получено, если весь реагент А (nА,0) вступит в реакцию [при этом в качестве реагента А должен быть выбран такой, который удовлетворяет условию (1.8)]
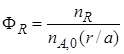
т. е. для простых необратимых реакций выход продукта и степень превращения реагента совпадают. Однако для других типов химических реакций эти два критерия эффективности различаются.
Обратимая химическая реакция (III). Для такой реакции максимально возможное количество продукта R определяется по уравнению (1.9) как равновесное количество продукта R при данных условиях осуществления реакции (температура, давление, соотношение начальных концентраций реагентов). Тогда с учетом уравнения (1.7)
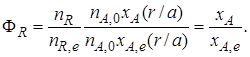
Таким образом, для обратимых реакций выход продукта равен доле, которую составляет реально достигнутая степень превращения от равновесной для данных условий проведения реакции.
Пример 1.1.Пусть протекает реакция
А + 2В 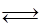
Начальное количество реагентов nА,0 = 10 кмоль; nB,0 = 25 кмоль. В реакционной смеси, выходящей из реактора, содержится 12 кмоль продукта R. Известно, что в равновесной смеси при данных условиях проведения реакции содержится 2,5 кмоль продукта А.
Определим выход продукта R (ФR). В соответствии с уравнением (1.12)
Определим степень превращения хА, используя уравнение (1.7):
Равновесная степень превращения
Параллельные и последовательные реакции. Рассмотрим две параллельно протекающие реакции, в которых наряду с целевым продуктом R получаются продукты побочной реакции:
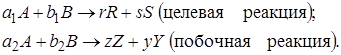
Максимально возможное количество продукта R будет получено в том случае, если весь исходный реагент А при соблюдении условия (1.8) будет реагировать только по целевой реакции. Тогда
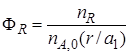
Следует помнить, что выразить nR через степень превращения и начальное количество А в случае сложной реакции нельзя, так как расходование вещества А происходит не только в целевом направлении, но и в побочном.
Так же будет выглядеть и выражение для выхода целевого продукта R для последовательных реакций, например реакций типа
aА 

При протекании обратимых параллельных и последовательных реакций максимально возможным количеством целевого продукта будет то количество R, которое было бы получено, если бы реагент А расходовался только на целевую реакцию и в момент равновесия продуктов побочных реакций не было бы.
Таким образом, для обратимых сложных реакций

Как и степень превращения, выход продукта для реакционных систем с постоянным объемом может быть определен как отношение концентраций. Следует также помнить, что выход, выражаемый как доля от некоторой предельно возможной величины, изменяется от 0 до 1.
Селективность.Выход продукта характеризует полученный результат, как долю от предельно возможного результата. Целесообразно оценить и реальную ситуацию, т. е. дать количественную оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием для такой оценки является селективность. Селективность, как и два предыдущих критерия эффективности, выражают в долях единицы или процентах.
Полная, или интегральная, селективность φ– это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные):
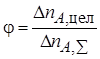
Мгновенной, или дифференциальной, селективностью φ / называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов:
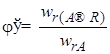
где 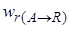
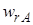
Использование дифференциальной селективности при анализе технологических процессов будет описано в гл. 3. Здесь рассмотрим только полную селективность.
Для реакций (III) полная селективность по целевому продукту R может быть выражена через количество полученного продукта R и количество реагента А, суммарно израсходованного на реакцию.
С учетом стехиометрических соотношений количество реагента А, вступившего в реакцию образования целевого продукта, равно (a/r) nR.
Тогда полная селективность
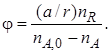
Знаменатель в уравнении (1.15) можно заменить через количество полученных продуктов целевой и побочной реакции с учетом стехиометрических соотношений:
Пример 1.2.Рассмотрим в качестве примера параллельные реакции
4NH3 + 5О2 
4NH3 + ЗО2 
Целевой является реакция получения оксида азота NO.
Селективность можно рассчитать по количеству полученных на выходе из реактора продуктов целевой реакции (оксида азота) и побочной реакции (азота):
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь. Рассмотрим ее сначала на примере необратимых параллельных реакций (IV).
В соответствии с уравнением (1.13) выход продукта R
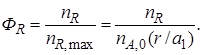
Реально полученное количество продукта R можно выразить через селективность, пользуясь уравнением (1.15)
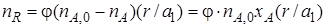
После подстановки уравнения (1.17) в уравнение (1.16) получим
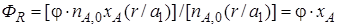
Если параллельные реакции обратимы, то максимально возможное количество продукта R, которое могло бы получиться при отсутствии побочной реакции, определяется условиями равновесия. Тогда для определения выхода продукта нужно применить уравнение (1.14). Подставляя в него значение количества реально полученного продукта R, выраженного с помощью уравнения (1.17), будем иметь более общее уравнение связи между выходом, селективностью и степенью превращения:
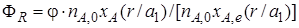

Из уравнений (1.18)и (1.19)следует, что при выборе условий проведения сложных химических реакций недостаточно обеспечить только высокое значение степени превращения реагентов или только высокую селективность; высокое значение выхода целевого продукта определяется некоторой совокупностью этих критериев эффективности.
Оптимальными значениями выхода, селективности и степени превращения будут, как правило, такие, достижение которых позволяет обеспечить максимальную экономическую эффективность процесса.
Производительность и интенсивность.Важным критерием эффективности работы отдельных аппаратов, цехов или заводов в целом является производительность.
Производительность – это количество продукта, полученное в единицу времени:
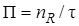
где П – производительность; nR – количество продукта; τ – время. Производительность измеряется в кг/ч, т/сут, т/год и т. д. Например, производительность современного агрегата синтеза аммиака составляет 1360 т аммиака в сутки; производительность агрегата по производству серной кислоты – 1 млн т серной кислоты в год и т. д. Иногда производительность оценивают по количеству переработанного сырья, например производительность печи обжига колчедана – 450 т колчедана в сутки. Если известны концентрация продукта в реакционной смеси, для определения производительности удобно воспользоваться следующей формулой:
где cR – концентрация продукта; v – объемный расход реакционной смеси.
Максимально возможная для данного агрегата, машины производительность (проектная) называется мощностью. Одним из основных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к снижению удельных капитальных затрат, повышению производительности труда.
Для сравнения работы аппаратов различного устройства и размеров, в которых протекают одни и те же процессы, используют понятие «интенсивность».
Интенсивностью называется производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, – его объему, площади поперечного сечения и т. д.
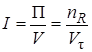
где V – объем аппарата. Интенсивность измеряется в кг/(ч · м 3 ), т/(сут · м 3 ) и т. д.
При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно при создании таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью.
При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора, или его напряженностью.
Вопросы и упражнения для повторения и самостоятельной работы
1. Из каких основных стадий состоит химико-технологический процесс? В каких стадиях химико-технологического процесса участвуют химические реакции?
2. Что такое химический процесс? Почему химический процесс как единичный процесс химической технологии сложнее по сравнению с тепловыми и массообменными процессами?
3. Объясните взаимное влияние химической реакции и явлений тепло- и массопереноса на примерах:
а) сгорание в потоке воздуха частицы колчедана;
б) разложение фторапатита Ca5F(PO4)3 серной кислотой;
в) получение аммиачной селитры при взаимодействии газообразного аммиака с раствором азотной кислоты.
4. Какие технологические критерии эффективности химико-технологического процесса вы знаете? Дайте их определения.
5. Каковы пределы изменения степени превращения, выхода продукта, селективности?
6. Что означает выражение «реагенты взяты в стехиометрическом соотношении»?
7. Выведите уравнение связи между степенями превращения двух реагентов, вступающих в реакцию
аА + bВ 
8. В химической реакции участвуют два реагента А и В, причем на каждый моль реагента А взято по 2 моль реагента В. В каком случае будет справедливо утверждение, что степень превращения хА реагента А больше степени превращения хВ реагента В?
9. В чем различия между действительной и равновесной степенями превращения реагента?
10. С какой целью при проведении химических процессов в промышленных условиях один из реагентов часто берут в избытке по отношению к стехиометрии реакции? Каковы пути использования реагента, взятого в избытке и не вступившего в реакцию?
11. Определите состав смеси (сА, сВ, cR, cS) и степень превращения jcb для реакции А + 2В 
сB,0 = 1,5 кмоль/м 3 .
12. Выведите уравнение связи между выходом продукта и степенью превращения одного из реагентов для обратимой химической реакции, не сопровождающейся побочными взаимодействиями.
13. Рассчитайте выход продукта Р, если известно, что при проведении последовательных реакций
А+ В 
Р + М 
получено 12 моль продукта Р, 4 моль продукта S, а для проведения реакций было взято по 20 моль реагентов А и В.
14. В чем различие между полной (интегральной) и мгновенной (дифференциальной) селективностями?
15. Выведите уравнение взаимосвязи между выходом целевого продукта R, степенью превращения реагента А и полной селективностью φ при проведении двух необратимых последовательных реакций
А 
R 
16. Выведите уравнение взаимосвязи между выходом целевого продукта, степенью превращения реагента и полной селективностью при проведении параллельных обратимых реакций
а1А + b1В 
a2А + b2B 
17. Рассчитайте полную селективность, если при проведении последовательных реакций
A 
R 
получено 6 моль продукта R и 2,5 моль продукта S.
18. Протекают последовательные реакции А 

19. Определите выход продукта R и степень превращения хА реагента А, если обратимая реакция А 
20. Протекают параллельные реакции
2А 
А 
Определите выход продукта R, степень превращения хА реагента А и полную селективность φ, если на выходе из реактора сА,f = 2 кмоль/м 3 , cR, f = 3 кмоль/м 3 , cS, f = 3,5 кмоль/м 3 .
21. Что называется производительностью, мощностью, интенсивностью?
22. Как связаны между собой:
а) производительность и степень превращения реагента;
б) производительность и выход целевого продукта?
23. Определите понятия «технологический режим», «технологическая схема процесса».
- Технологические критерии эффективности ХТП
- Химико-технологический процесс и его содержание (стр. 1 )
- Химико-технологический процесс и его содержание
- § 1. Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов
- § 2. Технологические критерии эффективности химико-технологического процесса
- Если протекает реакция
- Термодинамические расчеты химико-технологических процессов
- § 1 Равновесие химических реакций. Способы смещения равновесия
- § 2. Зависимость константы равновесия от температуры
- § 3. Термодинамический анализ
- Использование законов химической кинетики при выборе технологического режима
- § 1. Скорость гомогенных химических реакций
- 💡 Видео
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Технологические критерии эффективности ХТП
Работу химических производств в целом оценивают по экономическим показателям, таким как, прибыль, себестоимость продукции, капитальные затраты и т.д.
Экономические показатели процесса в значительной мере зависят от технологических: конверсия (степень превращения), селективность, выход продукта, расходные коэффициенты по сырью, вспомогательным материалам (растворители, катализаторы) и др. Эти показатели с разных сторон характеризуют глубину протекания химико-технологического процесса, его полноту и направленность в сторону образования целевого продукта.
1. Конверсия X (степень превращения) исходного реагента это доля исходного реагента, использованного на химическую реакцию – показывает, насколько полно в ХТП используется исходное сырье.
Для реакции аА + bВ ® rR + sS
степень превращения реагента А:
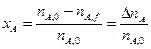
Или через концентрации
через массы
Зная конверсию одного из реагентов можно выразить конверсии других реагентов, участвующих в реакции.
Из конечного уравнения следуют частные случаи:
а) если 
б) если 
Пределы конверсии: 0
(индекс е от лат. equilibrium – «равновесие»).
Степень превращения ХА характеризует процесс не полностью: даже прореагировав целиком, реагент может послужить образованию не целевого, а побочного продукта.
2. Селективность (j — позволяет оценить эффективность целевой реакции по сравнению с побочными).
Полная, или интегральная селективность j – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству реагента, расходуемого на целевую и побочную реакции вместе:

Пределы селективности: 0
4. Расходные коэффициенты РК (Ктеор, Кпр.) по сырью количество сырья или энергии каждого вида, затрачиваемое на производство единицы массы или объема готовой продукции. РК по сырью выражаются в т/т, кг/кг, и т.д.; по энергии, соответственно, в кВт×ч/т.
Теоретические РК рассчитываются на основе стехиометрического уравнения целевой реакции, как отношение молярной массы реагента к молярной массе целевого продукта с учетом стехиометрических коэффициентов.
Практические РК рассчитывают из практических данных по материальным балансам производств.
РК показывает расход чистого реагента при полной конверсии без протекания побочных реакций и без учета потерь на получение единицы продукции.
5. Показателем, характеризующим эффективность работы машин, аппаратов, цехов и заводов в целом, служит производительность. Производительность – это количество выработанного продукта или переработанного сырья в единицу времени:
где П – производительность; m – количество продукта; τ – время.
Производительность измеряется в килограммах в час (кг/ч), тоннах в сутки (т/сут), или, кубических метрах в сутки (м 3 /сут) и т.д. Максимально возможная в данных условиях производства производительность называется мощностью.
Производительность может быть отнесена к отдельному аппарату, технологической линии, цеху, предприятию в целом.
6. Для сравнения работы аппаратов и установок различного устройства и размеров, в которых протекают одни и те же химические процессы, используется понятие интенсивность. Интенсивность I аппарата (машины, реактора) это его производительность, отнесенная к единице величины, характеризующей размеры рабочей части аппарата объема V или площади сечения S:
где V – объем аппарата (реактора).
Интенсивность может измеряться количеством продукта, получаемого в течение единицы времени с единицы объема аппарата. Например, (кг/ч×м 3 ), или с единицы сечения аппарата (т/сут×м 2 ) и т.д.
Интенсивность по катализатору
7. Качество продукции – совокупность технических, эксплуатационных, экономических и других свойств, обуславливающих ее пригодность для удовлетворения личных или производственных потребностей в соответствии с ее назначением. В большинстве случаев качество химических продуктов определяется их чистотой или содержанием в них основного вещества. Производство высокочистых или концентрированных продуктов важно не только с точки зрения качества конечного продукта, идущего на народное потребление, но и по многим другим причинам. Например, применение концентрированных продуктов повышает интенсивность процессов, в которых они используются в качестве сырья. Это приобретает особое значение для химической промышленности, продукция которой представляет собой главным образом сырье или средство производства, а не непосредственного потребления.
Особенно большие требования к чистоте химических продуктов предъявляются при производстве химических реактивов и особо чистых веществ, применяемых в некоторых технологических процессах. Так, например, содержание окислов азота и хлора в реактивной серной кислоте должно быть не более 10 -4 %, а содержание мышьяка – не более 3×10 -6 %.
Качество продукции измеряется системой показателей, охватывающих различные области использования продукции: надежности, долговечности. Эти показатели задаются государственными стандартами (ГОСТ) и техническими условиями (ТУ) на продукцию.
По мере совершенствования химико-технологических процессов, а также по требованию потребителей химических продуктов стандарты систематически пересматриваются. При этом проводится большая исследовательская работа по оценке возможностей промышленности, вырабатывающей тот или иной продукт, а также по установлению обоснованности выдвигаемых потребителями требований. В результате такой работы составляется новый стандарт, в котором предусматриваются более качественные показатели продукции (все или некоторые из них).
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химико-технологический процесс и его содержание (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |
Химико-технологический процесс и его содержание 1
1.Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов. 1
2.Технологические критерии эффективности химико-технологического
Термодинамические расчеты химико-технологических процессов 8
1.Равновесие химических реакций. Способы смещения равновесия. 9
2.Зависимость константы равновесия от температуры 10
3.Термодинамический анализ 11
Использование законов химической кинетики при выборе технологического
1.Скорость гомогенных химических реакций 11
2.Зависимость скорости химических реакций от концентрации реагентов;
кинетические уравнения 12
3.Способы изменения скорости простых и сложных реакций 17
Гетерогенно-каталитические процессы 20
1.Общие представления о катализе 21
2.Технологические характеристики твердых катализаторов 22
3.Основные стадии и кинетические особенности гетерогенно-каталитических
1.Постановка общей задачи разработки и создания химико-технологических
2.Использование методов и принципов системного исследования при разработке
3.Основные понятия и принципы системного подхода 34
4.Химическое предприятие как сложная система 35
5.Общая стратегия системного исследования. Основные этапы создания ХТС 36
6.Классификация моделей ХТС 39
7.Задачи анализа, синтеза и оптимизации ХТС 45
8.Типы технологических связей 48
9.Технологические принципы создания ХТС 53
10.Проблемы, возникающие при разработке и эксплуатации агрегатов
большой единичной мощности 54
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Химико-технологический процесс и его содержание
Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Некоторые из этих операций необходимы для подготовки исходных реагентов к проведению химической реакции, перевода их в наиболее реакционно-способное состояние. Например, известно, что скорость химических реакций сильно зависит от температуры, поэтому часто реагенты до проведения реакции нагревают. Чтобы устранить побочные явления и получить продукт высокого качества, исходное сырье подвергают очистке от посторонних примесей, пользуясь методами, основанными на различии физических свойств (растворимость в различных растворителях, плотность, температуры конденсации и кристаллизации и т. д.). При очистке сырья и реакционных смесей широко применяют явления тепло — и массообмена, гидромеханические процессы. Возможно также использование химических методов очистки, например химических реакций, в результате которых посторонние примеси превращаются в легко отделимые вещества.
Соответствущим образом подготовленные реагенты подвергают химическому взаимодействию, включающему часто несколько этапов. В промежутках между этими этапами иногда необходимо вновь использовать тепломассообменные и другие физические процессы. Например, при производстве серной кислоты диоксид серы частично окиcляют до триоксида, затем реакционную смесь охлаждают, извлекают из нее путем абсорбции триоксид серы и вновь направляют ее на окисление.
В результате химических реакций получают смесь продуктов (целевых, побочных) и не прореагировавших реагентов. Заключительные операции связаны с разделением этой смеси, для чего вновь применяют гидромеханические, тепло — и массообменные процессы, например, фильтрование, центрифугирование, ректификацию, абсорбцию, экстракцию и т. д. Продукты реакции направляют на склад готовой продукции или на дальнейшую переработку: не прореагировавшее сырье вновь используют в процессе, организуя его рецикл. На заключительных этапах проводят также рекуперацию энергии и очистку промышленных выбросов, чтобы извлечь из отходящих газов и сточных вод все ценные компоненты, а также ликвидировать опасность загрязнения окружающей среды.
Таким образом, химико-технологический процесс в целом — это сложная система, состоящая из единичных связанных между собой процессов (элементов) и взаимодействующая с окружающей средой.
Элементами химико-технологической системы являются перечисленные выше процессы тепло — и массообмена, гидромеханические, химические и т. д. Их рассматривают как единичные процессы химической технологии.
Важной подсистемой сложного химико-технологического процесса является химический процесс. Он представляет собой одну или несколько химических реакций, сопровождаемых тепло-и массообменными явлениями.
Анализ единичных процессов, их взаимного влияния позволяет разработать технологический режим.
Технологическим режимом называется совокупность параметров, определяющих условия работы аппарата или системы аппаратов.
Оптимальные условия ведения процесса — это сочетание основных параметров (температуры, давления, состава исходной реакционной смеси, катализатора и т. д.), позволяющее получить наибольший выход продукта с высокой скоростью или обеспечить наименьшую себестоимость.
Единичные процессы протекают в различных аппаратах — химических реакторах, абсорбционных и ректификационных колоннах, теплообменниках и т. д. Отдельные аппараты соединены в технологическую схему процесса. Разработка и построение рациональной технологической схемы — важная задача химической технологии.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

§ 1. Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов
В современной химии известно большое число различных химических реакций. Многие из них осуществляются в промышленных химических реакторах и, следовательно, становятся объектом изучения химической технологии.
Чтобы облегчить изучение близких по природе явлений, в науке принято их классифицировать по общим признакам. В зависимости от того, какие признаки взяты при этом за основу, существует несколько видов классификации химических реакций. Одни виды классификации применяют в основном в химии (неорганической, органической и т. д.), другие — в химической технологии, некоторые являются общими.
В химической технологии можно применять различные виды классификации химических реакций.
Для выбора конструкции химического реактора и способов управления проведением процесса существенное значение имеет фазовый состав реакционной системы. В зависимости от фазового состава реагентов и продуктов различают гомогенные и гетерогенные химические реакции.
В случае гомогенных реакций реагенты и продукты находятся в одной фазе (жидкой или газообразной). Например, окисление оксида азота кислородом воздуха в производстве азотной кислоты — газофазная реакция, а реакции этерификаиии (получение эфиров из органических кислот и спиртов) жидкофазные.
При протекании гетерогенных реакций по меньшей мере один из реагентов или продуктов находится в фазовом состоянии, отличающемся от фазового состояния остальных участников реакции. Различают двухфазные системы 0), происходит уменьшение энтальпии реакционной системы (
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

§ 2. Технологические критерии эффективности химико-технологического процесса
Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т. д. Естественно, что окончательная оценка эффективности химико-технологического процесса выводится из этих критериев. Однако они характеризуют весь процесс в целом, его конечный результат, не входя в детальное рассмотрение внутренней сущности, особенностей процесса.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах тенологической схемы.
В качестве таких показателей принято прежде всего использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции.
Степень превращения. Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Степень превращения — это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента xJ по уравнению
где nJ,0 — количество реагента J в исходной реакционной смеси; nJ — количество реагента J в реакционной смеси, выходящей из аппарата или находящейся в реакторе; 
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). Степень превращения может быть рассчитана как по первому, так и по второму или по третьему реагенту, причем в общем случае не обязательно получаются равные результаты.
Если протекает реакция
то в соответствии с ее стехиометрическим уравнением (I) изменения количеств ее участников 
Уравнение (1.4) устанавливает связь между степенями превращения реагентов А и В и позволяет рассчитать неизвестную степень превращения одного реагента, зная степень превращения другого. Если
т. е. реагенты А и В взяты для проведения реакции в стехиометрическом соотношении (количества реагентов А и В относятся между собой как соответствующие этим веществам стехиометрические коэффициенты в уравнении реакции), то степени превращения xA и xB равны между собой: хA = хB Необходимо помнить, что степень превращения — это доля первоначального количества реагента, т. е. пределы изменения х определяются соотношением
Обычно при выборе первоначального состава реакционной смеси берут в избытке более дешевый реагент (например, воздух, воду и т. д.) с целью повышения степени использования более ценного сырья.
Не всегда возможно достичь полного использования реагента (т. е. условия x = 1). Большинство химических реакций обратимы. Для обратимых реакций при заданных условиях их осуществления предельным состоянием является состояние химического равновесия. Этому состоянию соответствует и предельно достижимая при данных условиях равновесная степень превращения
где nA,e — количество реагента А в условиях равновесия; 
Используя степень превращения реагентов, можно определить количество продуктов R и S, образовавшихся в результате реакции (1), не осложненной наличием побочных взаимодействий. Изменение количества продукта реакции (I), например продукта R, в соответствии со стехиометрическими соотношениями (1.2) можно выразить через изменение количества реагента. А или реагента В. Если первоначальное количество продукта R равно нулю (nR,,0=0), то

В качестве ключевого реагента, через степень превращения которого выражают количества продуктов, удобно брать реагент, взятый либо в недостатке, либо в стехиометрическом соотношении к другому. Например, если в качестве такого выбран реагент А, то должно выполняться условие
Максимально возможное количество продукта R, которое может быть получено при проведении обратимой реакции

рассчитывают как равновесное количество этого продукта nR, е
Если реакционный объем V — постоянная величина (V = const), то во всех приведенных выше соотношениях количества реагентов и продуктов могут быть заменены молярными концентрациями. Например,

Выход 
Выход продукта — это отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
Обозначим выход продукта R через Фк. Тогда
Величина nR, max в уравнении (1.16) зависит от того, каков тип осуществляемой химической реакции. Рассмотрим несколько различных реакций.
а. Необратимая химическая реакция (1). Максимально возможное количество продукта R в такой реакции будет получено, если весь реагент А (п А,0) вступит в реакцию, при этом в качестве реагента А должен быть выбран такой, который удовлетворяет условию (1.12)]
б. Обратимая химическая реакция (II). Для такой реакции максимально возможное количество продукта R определяется по уравнению (1.13) как равновесное количество продукта R при данных условиях осуществления реакции (температура, давление, соотношение начальных концентраций реагентов).

Как и степень превращения, выход продукта для реакционных систем с постоянным объемом может быть определен как отношение концентраций. Следует также помнить, что выход, выражаемый как доля от некоторой предельно возможной величины, изменяется в пределах от 0 до 1.
Селективность. Выход продукта характеризует полученный результат, как долю от предельно возможного Целесообразно оценить и реальную ситуацию, т. е. дать количественную оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием для такой оценки является селективность Селективность, как и два предыдущих критерия эффективности, выражают в долях единицы или в процентах.
Полная, или интегральная, селективность j — это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшему на все реакции (и целевую, и побочные)
Мгновенной, или дифференциальной, селективностью j‘ называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов
где wr(A®R) — скорость расходования реагента А по целевой реакции; wrA – суммарная скорость расходования реагента А*
Использование дифференциальной селективности при анализе технологических процессов будет описано в п. 3 Здесь рассмотрим только полную селективность.
Для реакций (III) полная селективность по целевому продукту R может быть выражена через количество полученного продукта А и количество реагента А, суммарно израсходованного на реакцию.
С учетом стехиометрических соотношений количество реагента А, вступившего в реакцию образования целевого продукта, равно
Тогда полная селективность j будет равна

Целевой является реакция получения оксида азота NO
Селективность можно рассчитать по количеству полученных на выходе из реактора продуктов целевой реакции (оксида азота) и побочной реакции (азота).
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь. Рассмотрим ее сначала на примере необратимых параллельных реакций (III).
В соответствии с уравнением (1.21) выход продукта R
Реально полученное количество продукта R можно выразить через селективность, пользуясь уравнением (1.25):
Если параллельные реакции обратимы, то максимально возможное количество продукта R, которое могло бы получиться при отсутствии побочной реакции, определяется условиями равновесия. Тогда для определения выхода продукта нужно применить уравнение (1.22) Подставляя в него значение количества реально полученного продукта R, выраженного с помощью уравнения (1.28), будем иметь более общее уравнение связи между выходом, селективностью и степенью превращения:
Из уравнений (1.29) и (1.30) следует, что при выборе условий проведения сложных химических реакций недостаточно обеспечить только высокое значение степени превращения реагентов или только высокую селективность; высокое значение выхода целевого продукта определяется некоторой совокупностью этих критериев эффективности.
Оптимальными значениями выхода, селективности и степени превращения будут, как правило, такие, достижение которых позволяет обеспечить максимальную экономическую эффективность процесса.
Производительность и интенсивность. Важным критерием эффективности работы отдельных аппаратов, цехов или заводов в целом является производительность.
Производительность — это количество продукта, полученное в единицу времени:
где П — производительность; nR — количество продукта; t — время. Производительность измеряется в кг/ч, т/сут, т/год и т. д. Например, производительность современного агрегата синтеза аммиака составляет 1360 т аммиака в сутки; производительность агрегата по производству серной кислоты — 1 млн. т серной кислоты в год и т. д. Иногда производительность оценивают по количеству переработанного сырья, например производительность печи обжига колчедана 450 т в сутки. Если известны концентрация продукта в реакционной смеси на выходе из реактора и объемный расход реакционной смеси, то для определения производительности удобно воспользоваться следующей формулой:
где cR — концентрация продукта; u — объемный расход реакционной смеси.
Максимально возможная для данного агрегата, машины произво-дительность (проектная) называется мощностью. Одним из основных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к снижению удельных капитальных затрат, повышению производительности труда.
Для сравнения работы аппаратов различного устройства и размеров, в которых протекают одни и те же процессы, используют понятие интенсивность:
Интенсивностью называется производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, — его объему, площади поперечного сечения и т. д.

При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно за счет создания — таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью.
При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора или его напряженностью.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Термодинамические расчеты химико-технологических процессов
При проектировании технологических процессов очень важны термодинамические расчеты химических реакций. Они позволяют сделать заключение о принципиальной возможности данного химического превращения, предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитать теоретически достижимые степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплота реакции, теплота изменения агрегатного состояния и т. д.), что необходимо для составления энергетических балансов и определения энергетических затрат
В самом широком смысле термодинамика — это наука о преобразовании энергии. Понятие« энергия» неотъемлемо от движения материи. Движение связано с материей, являясь формой ее существования, а энергия есть мера движения материи. Факт взаимного превращения различных форм движения материи при сохранении количества этого движения является содержанием закона сохранения и превращения энергии, названного Ф. Энгельсом абсолютным законом природы.
Наиболее важные понятия термодинамики — «теплота процесса» и «работа». Преобразование теплоты в работу или работы в теплоту осуществляется обычно в термодинамическом процессе посредством рабочего тела. Термодинамическая система называется однородной, если во всех частях системы свойства одинаковы. Совокупность физических свойств рабочего тела (или термодинамической системы) в рассматриваемых условиях называется состоянием тела (или системы). Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. К ним относят температуру, давление, удельный объем, плотность, молярный объем, удельную внутреннюю энергию и др.
Термодинамические параметры делят на экстенсивные и интенсивные. Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются экстенсивными; это — объем, внутренняя энергия, энтальпия, энтропия и т. п. Экстенсивные параметры обладают свойством аддитивности.
Интенсивные величины не зависят от массы термодинамической системы, и только они служат термодинамическими параметрами состояния.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

§ 1 Равновесие химических реакций. Способы смещения равновесия
Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается). Влияние изменения внешних условий на положение равновесия — принцип смещения равновесия, называемый в литературе принципом Ле Шателье, можно сформулировать следующим образом:
если на систему, находящуюся в устойчивом равновесии, воздействовать извнe, изменяя какое-нибудь из условий, определяющих положение равиовесия то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
Так как равновесие характеризуется равенством скоростей прямой и обратной реакций, можно сказать, что смещение равновесия происходит в том случае, когда произведенное воздействие неодинаково влияет на скорости прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при котором скорости прямой и обратной реакций опять станут равными, но будут отличаться от первоначальных значений,
Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции или знаком изменения объема
Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей, повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.
Чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объема сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии. Количественная оценка влияния давления на состояние равновесия дается уравнением (2.12).
Влияние инертного газа. Введение инертного газа в систему при р const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей, разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых, стремятся к уменьшению накопления инертных газов в системе. Так, если в азотно-водородно-аммиачной смеси, взятой при р = 100 МПа, содержалось бы 10% инертного газа, то это равносильно снижению давления на 25 МПа. С целью поддержания высоких выходов аммиака в системе регулярно проводятся «продувка» и добавление свежего газа (см. гл. 14).
Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Так, избыток кислорода увеличивает равновесную степень превращения S02 в SO3.
Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта. Так, введение в систему водоотнимающих средств (например, H2SO4) позволяет сместить равновесие реакции этерификации вправо:
Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е. усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.
При изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры. Например, для рассмотренной выше реакции синтеза аммиака следовательно, повышение температуры усилит реакцию диссоциации аммиака, а понижение температуры будет способствовать протеканию реакции синтеза слева направо. Учет знака теплового эффекта реакции приводит к тому же выводу: повышение температуры смещает равновесие в сторону исходных реагентов (усиливает эндотермическое направление реакции), понижение температуры действует в противоположном направлении.
Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
Итак, применяя принцип Ле Шателье, можно, не производя термодинамических расчетов, предсказать направление химических реакций, т. е. качественно судить о состоянии их равновесия.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

§ 2. Зависимость константы равновесия от температуры
Функциональная зависимость константы равновесия от температуры при постоянном давлении передается уравнением изобары Вант-Гоффа
где DH° — изменение энтальпии при стандартном состоянии. ‘
Для процессов, протекающих при постоянном объеме, зависимость константы равновесия от температуры передается уравнением изохоры Вант-Гоффа:
где `DU° — изменение внутренней энергии в стандартном состоянии. Уравнения изобары и изохоры реакции определяют зависимость константы равновесия от температуры в дифференциальной форме. Для практических расчетов равновесия при различных температурах требуется провести интегрирование этих уравнений.
Видео:Химия 11 класс (Урок№5 - Классификация химических реакций.)Скачать

§ 3. Термодинамический анализ
Знание законов термодинамики необходимо инженеру не только для проведения термодинамических расчетов, позволяющих предсказать возможности данного превращения, определить диапазоны давлений и температур, в которых наиболее выгодно проводить процесс, рассчитать равновесный состав продуктов, но также и для оценки энергетической эффективности химико-технологических процессов. Термодинамический анализ основывается на рассмотрении сравнительно ограниченного числа характеристик, влияющих на энергетическую и экономическую эффективность отдельных циклов и в целом технологических схем. Ценность анализа энергетической и экономической эффективности заключается в том, что часто на самой ранней стадии исследования новых предложений удается предвидеть их экономическую целесообразность или, наоборот, полную бесперспективность. Термодинамический анализ, как правило, дает возможность установить это до составления технического проекта, требующего больших затрат труда и времени.
Видео:Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Использование законов химической кинетики при выборе технологического режима
Химическая термодинамика позволяет решить вопрос о направлении протекания химических реакций и оценить предельно достижимые (равновесные) состояния реакционной системы. Однако она не может ответить на вопросы, имеющие чрезвычайно важное практическое значение в химической технологии: как быстро произойдет химическое превращение, за какой промежуток времени будет получено то или иное количество продукта реакции.
Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических превращений, изучаемые химической кинетикой.
Для химической технологии важен конечный результат кинетических исследований — конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются первоосновой математической модели химического реактора. Без знания кинетических закономерностей невозможно правильно выбрать тип реактора и рассчитать его конструктивные размеры.
Вопросы изучения кинетики химических реакций, определения кинетических параметров подробно рассматриваются в руководствах по физической химии и химической кинетике. Здесь основное внимание будет обращено на практические приложения результатов кинетических исследований.
Видео:Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

§ 1. Скорость гомогенных химических реакций
Скорость химической реакции wrJ принято выражать количеством (моль) nJ одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени t в единице реакционного пространства.
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции; она всегда положительна, поэтому знак перед производной dnJ/dt должен определяться тем, является ли вещество J исходным реагентом (тогда dnJ/dt отрицательна) или продуктом (тогда dnJ/dt положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций
💡 Видео
Классификация химических реакций. Вопрос №19 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать

Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства ВеществаСкачать

Видеоурок по химии "Типы химических реакций в органической химии"Скачать

Как определить тип химической реакцииСкачать

Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

Классификация химических реакций по различным признакамСкачать

Классификация химических реакций | Химия 11 класс #14 | ИнфоурокСкачать