Процессы изменения состояния, в которых изменение параметров подчиняется уравнению pv n = const, называют политропными процессами. В данном уравнении п — показатель политропы.
Все рассмотренные выше процессы являются частными случаями политропного процесса. Показатель политропы может принимать значения от 0 до ±°°:
- — при п = ±оо процесс происходит при постоянном объеме, так как величина v ±co настолько велика (мала) по абсолютной величине, что значением величины давления можно пренебречь;
- — при п = 0 процесс происходит при постоянном давлении, т. е. изобарно, так как п° = 1;
- — при п = 1 процесс происходит при постоянной температуре, т. е. изотермно;
- — при п = к процесс происходит адиабатно.
Характеристикой политропного процесса является доля количества теплоты, расходуемой на изменение внутренней энергии ф, которая определяется по формуле
Показатель политропы может быть определен по формуле 
где с- — — теплоемкость политропного процесса.
Заменяя ф его значением из уравнения (3.47), получаем
Проведем исследование политропного процесса.
1. Условие протекания процесса:
2. Зависимости между параметрами в процессе:
3. Изображение процесса на диаграммах pv и TS (рис. 3.16)
Рис. 3.16. Изображение политропного процесса на диаграммах pv и 75
4. Первый закон термодинамики в общем виде математически выражается формулой (3.2). В зависимости от значения показателя политропы формула изменяется и принимает вид (3.20), (3.27), (3.35) или (3.44):
5. Количество теплоты, подведенное (отведенное) в процессе:
где с — постоянная теплоемкость, которую можно определить, пользуясь уравнением (3.51) и учтя, что ср — cv = R:
6. Изменение внутренней энергии в политропном процессе определяется по формулам
7. Работа, совершенная в процессе:
В политропном процессе может происходить как сжатие, так и расширение рабочего тела. Существуют следующие зависимости между значением показателя политропы, количеством теплоты и изменением внутренней энергии.
Видео:Информация в показателе РСО2 Торшин С.В.Скачать

Блог об энергетике
Видео:11 основных показателей в анализе крови, которые укажут на то, что вы нездоровыСкачать

энергетика простыми словами
Видео:Протромбиновое время. ПО. МНО. ПТИ. Протромбин по Квику.Скачать

Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Видео:#12.24КоАП РФ. Причинение вреда здоровью при нарушении #ПДД. (схемы защиты и получения компенсации)Скачать

Политропный процесс
Видео:Механизм действия и показания для назначения ингибиторов контрольных точек иммунного ответаСкачать

Политропный процесс
- Обычно фактический процесс работы теплового двигателя происходит при наличии теплообмена, р, в, Т изменений. То есть он не является теплоизолирующим, изобарическим, изобарическим или изотермическим. Для расчета такого процесса соотношение между давлением и объемом обычно выражается уравнениями вида ФВ plvlj p1v Конст. 5. 37. Процесс в соответствии с этим уравнением называется. Политолог. Показатель степени уравнения p НИИ называется политропным indicator. В некоторых процессах величина n постоянна, но в разных процессах политропный показатель может принимать любое число.
Для идеального газа по уравнению pv-rt можно найти уравнение политропного процесса, соединив параметры t, t и t, p. Для этого нужно заменить давление или объем в уравнении 5. 37 соответственно и выразить их с помощью уравнения Клапейрона. После преобразования получены следующие уравнения политропного процесса tv — — t — t2v — const 5. 38 5. 39 ТП т п t2p2. Уравнение 5. 37 5. 38 5. 39 поэтому связь между параметрами в начале и конце политропного процесса может быть легко получена. −1 5.
Поскольку уравнение (16-7) должно быть справедливо также и для воздуха, то одновременно с потоком частиц пара должен существовать и поток частиц воздуха, но в обратном направлении. Людмила Фирмаль
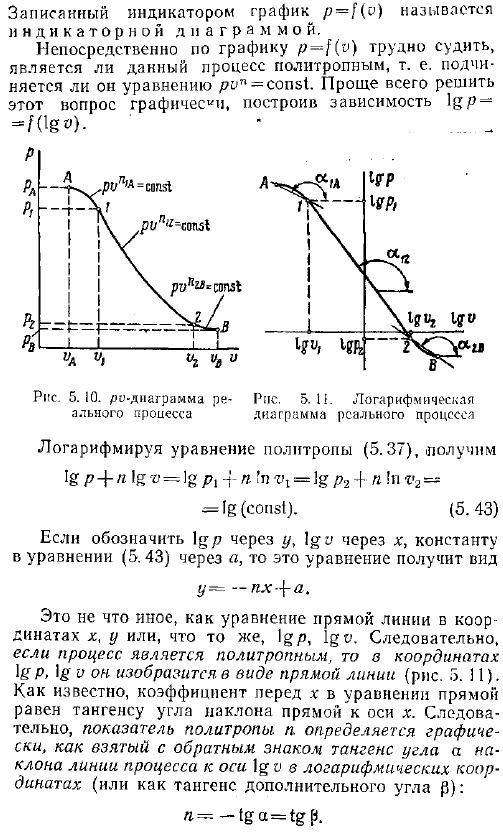
Сорок два. При изучении фактического процесса необходимо установить, является ли процесс политропой, и определить значение индекса политропы. Обычно при изучении работы тепловых машин двигателей, компрессоров и др. , давление и объем рабочей жидкости измеряются в процессе расширения и сжатия. По результатам таких измерений можно построить зависимость p f v рис. 5. 10.
При исследовании работы поршневой машины двигателя внутреннего сгорания, компрессора и др. , такой график рисуют приборы так называемые индикаторы, которые автоматически измеряют изменения давления и объема. Графика р о описывается индикатор называется индикаторной диаграммы. Из графика p-f v трудно непосредственно определить, является ли этот процесс политропой, то есть следует уравнению pon const. Проще всего решить эту проблему графически, построив зависимость lg fog —. — Логарифм уравнения политропа 5. 37, ig p 4-n log-o g pi-i- to r 1 ig p2 4-n in v2— ИГ константа. 5. 43 Если igp обозначается через y, а igo-через x, а константа уравнения 5.
Через a, то это уравнение принимает вид В j -зл-Н. Это то же самое, что и линейные уравнения координат x, y или igp, lgv. So, если процесс представляет собой политропу, то она рисуется в виде прямой линии, с координатами igp, ig рис. 5. 11. Как известно, коэффициент x в уравнении прямой линии равен касательной наклона линии к оси x-axis. As в результате политропный индекс n определяется как тангенс угла a от противоположного знака в логарифмических координатах и как наклон технологической линии к оси МПО или как тангенс дополнительного угла Как будет определено. Обратите внимание, что не все процессы являются политропами.
Например, вы можете видеть, что только процесс at 5. 11, раздел 1-2 процесса at2b, можно считать политропой с равными показателями. Л12 — tga12. Если в координатах лгп фактический процесс МПО не представлен прямой линией, то он разбивается на короткие отрезки, в которых линия практически заменяется прямой segment. In примерный рисунок, раздел 5. 11, al n 2b, также можно считать политропой с индексами n, равными n a — tg u1a и 2b — tg g2b. — Если известно, что процесс является политропным, то значение показателя n можно определить по формуле 2 из значения параметра газа в любой точке этого процесса 5. 43.
Выражает давление по объему из Формулы 3. 2, формулы 5. 37. Эта формула такая же по форме, как и соответствующая формула для процесса термоизоляции, отличающаяся только обозначением индекса теплопроводности. Volume. So, в результате интегрирования вы получите формулу, аналогичную форме 5. Сорок семь Из уравнения состояния pioi этих выражений можно заменить на rt. Выполнив такую замену в выражении 5.
- Мы получим другое выражение, для которого работает политропный процесс. 4 — Г2. 5. 48. Теплотворная способность политропного процесса определяется по следующей формуле 5. 49 Вот, Джей Кг-град — это теплоемкость газа в политропном процессе, то есть процессе, в котором n является постоянной величиной. Теплоемкость газа политропного процесса определяется по общей формуле 4. 3. Для этого необходимо подставить отношение изменения объема к изменению температуры в политропном процессе. Эта зависимость получается путем дифференцирования уравнения 5. 41 политропного процесса переменной Г, о. После логарифма формулы 5.
Отсюда л-т л-1. Подставляя это выражение в выражение 4. 3, вы получаете Если привести их к общему знаменателю с круглыми скобками, то получится формула для теплоемкости газа в политропном процессе. Из этой формулы видно, что было решено учитывать удельную теплоту независимо от температуры удельная теплота идеального газа в политропном процессе будет постоянной. В отличие от теплоемкости cp и c, теплоемкость газа в политропном процессе может быть отрицательной. Это тот случай, когда значение индекса политропа n больше 1 и меньше k, то есть k n.
Так как массосодержание водяного пара иц и воздуха составляют в сумме единицу, градиент массосодержания пара соответствует градиенту маососодержания воздуха. Людмила Фирмаль
Отрицательная теплоемкость означает, что, несмотря на подвод тепла к газу, температура снижается, а при отводе тепла, наоборот, он становится горячим. Это, казалось бы, аномальное поведение температуры объясняется тем, что политропный процесс 1 l, а следовательно, cn 0, получается сильным расширением с небольшим запасом heat. In кроме того, это ln qn, и изменение внутренней энергии отрицательно. Л Несмотря на то, что тепло подается 1 0, когда внутренняя энергия газа уменьшается, температура уменьшается.
В процессе сжатия, если из рабочего тела удаляется меньше тепла, чем выполняется работа, то есть и В случае n избыточная энергия — qn увеличивает внутреннюю энергию газа, и температура повышается. Тепло удаляется н 0. Подставляя давление, выраженное в объеме по уравнению 3. 14 5. 37, показано, что работа газа, имеющаяся в политропном процессе, в n раз больше работы расширения в этом процессе, как это было сделано в адиабатическом процессе 5. 51 Рассмотренные ранее процессы изометрический, изобарный, изотермический, адиабатический-это частный случай политропного процесса. Каждое уравнение может быть представлено в виде swarm const со своим значением индикатора.
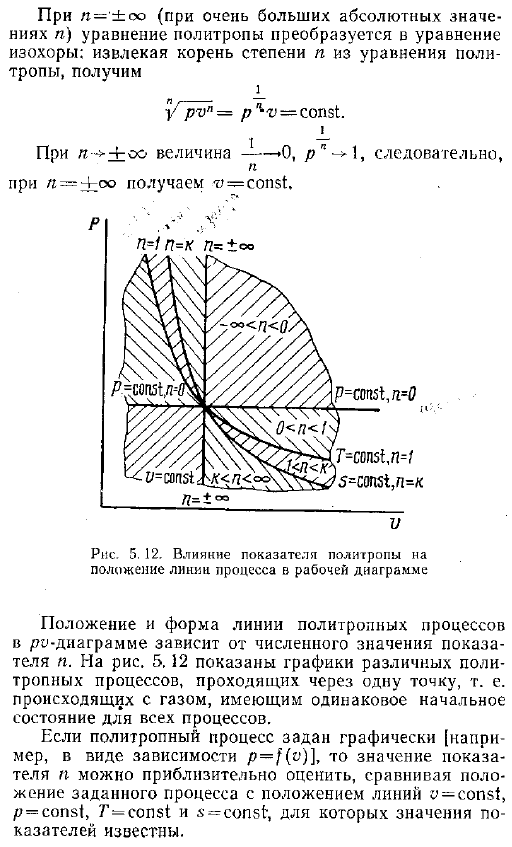
Фактически, в n-0 уравнение политропа принимает следующий вид pr 0 p-1 const или p const изобарный процесс. Если l 1, то политропное уравнение представляет собой изотермический процесс. Рv const и если l a, то политропы соответствуют адиабату. Роль const. В случае n- co где абсолютное значение n очень велико политропное уравнение преобразуется в однородное уравнение. Извлечение корней Порядка n из политропного уравнения дает ПВН Р v пост. Для n — oo значение равно −0 например — — — Лоо, вы получите.
Процесс работы диаграммы расположение и форма линии RO-диаграммы политропного процесса зависит от порядкового номера изделия .На рисунке 5 .12 показан график различных политропных процессов, проходящих через 1 точку .То есть все процессы протекают в одном и том же начальном состоянии газа .Если политропный процесс задан графически например, в виде зависимости p f o, то значение показателя N аппроксимируется путем сравнения положения данного процесса с положениями линий y const, p const, T const и s const .Значение индикатора известно .На рисунке 5 .12 показано ограничение на значение N в политропы между соответствующими линиями этих процессов .Чем выше абсолютное значение показателя, тем круче линия политропного процесса .Рис .
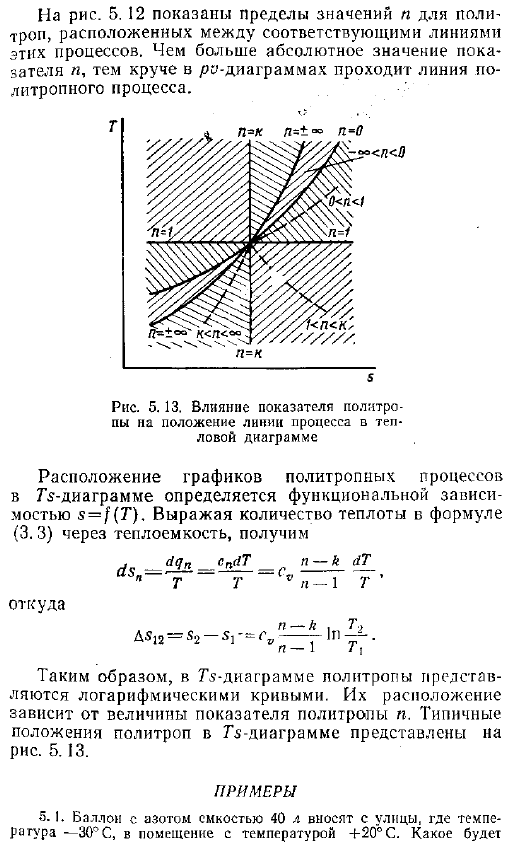
Влияние индекса политропа на расположение технологической линии на диаграмме горячей проволоки Положение графика политропного процесса на диаграмме G определяется зависимостью функции s T .Если величина теплоты уравнения 3 .3 выражается в терминах удельной теплоты, то она выглядит следующим образом Откуда AS12 С2-с — сі, — г п г — Таким образом, в схеме ТС, политроп представлены логарифмические кривые .Их расположение зависит от величины политропного показателя n .на рисунке показано типичное положение политроп на диаграмме G .5 .13 .Пример 5 .1 .Возьмите баллон с емкостью 40 литров азота с улицы, где температура составляет −3 C, в помещение с температурой 20 C .Давление в баке и температура азота равны давлению в баке 98 dir Тепло, и равное cv 742 Дж Кг-град .Решение .О нагревании шара .- Меняйся, Трейс .— 297 Дж кг град- 2 .7 найти 9810S-0 .04 М ря, 7а-Д 5 .45-742 .10-1 293-243 −202 кДж .




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
📺 Видео
Референсные значения анализов - что они значат? @DrOlenaBСкачать

Что такое процент вовлечения паренхимы в заключении КТ?Скачать

Когда назначают ПТИ, МНО, АЧТВ?Скачать

Практические аспекты Н=Н - Антон ЕреминСкачать

Авдеев С.Н.: пероральное или парентеральное введение антибиотиков: как принять решение?Скачать

Пути и способы введения лекарственных средствСкачать

4.4 Принципы регистрации γ-квантов при ОФЭКТ и ПЭТСкачать

Компенсаторно-приспособительные процессы - общие вопросыСкачать

Зачем назначают ПТИСкачать

Изменения в части хранения прекурсоров НС и ПВСкачать

Что такое ВВП по ППС?Скачать

Качественное определение ионов Н+ и ОН-. Определение рНСкачать

Отравление фосфорорганическими веществамиСкачать

Каким должно быть целевое значение МНОСкачать

#4 Распределение лекарственных веществ. Транспортные системы кровиСкачать