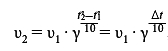Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
Решая которое, находим, что:
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Видео:Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
📸 Видео
Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Тепловой эффект реакции. Задание №28 | Химия ЕГЭ | УмскулСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия | Молекулярные и ионные уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакции ионного обмена. 9 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Решение задач по теме «Расчеты по термохимическим уравнениям». 9 и 11 класс.Скачать

Задачи: термохимические уравнения и расчеты по нимСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать