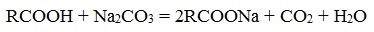С химической точки зрения мыла представляют собой соли высших жирных (C8–C18), нафтеновых или смоляных кислот.
В бытовом смысле — это технические продукты, обладающие моющим действием.
- Классификация мыла
- Химические способы получения мыла
- Промышленное получение мыла (варка мыла)
- Моющие свойства мыла
- Какие химические свойства характерны для мыла ответ подтвердите уравнениями химических реакций
- Что такое мыла и как их получают? Какова химическая формула мыла?
- Содержание:
- История открытия мыла
- Химическая формула мыла
- Особенные свойства мыла
- Классификация мыла
- Способы получения мыла
- Процесс изготовления мыла
- Как ПАВ влияют на природу
- 📹 Видео
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Классификация мыла
Существует несколько классификаций мыл.
По растворимости мыла делят на:
- Растворимые щелочные мыла — калиевые, натриевые, аммониевые соли жирных кислот. В зависимости от природы катиона мыла растворимость в воде увеличивается в ряду: Li + — Na + — K + — NH4 +
- нерастворимые металлические мыла — соли поливалентных металлов (Ca, Mg, Ni, Mn, Al, Co, Pb).
По консистенции:
- Жидкие мыла – соли калия, аммония
- Твердые мыла – соли натрия, лития, поливалентных металлов
По назначению:
По способу получения:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические способы получения мыла
Производство мыла (мыловарение) довольно длительный и сложный процесс, состоящий из нескольких стадий.
Если рассматривать только химические реакции, лежащие в основе получения мыла, то как уже было рассмотрено мыла можно получить при щелочном гидролизе жиров, при этом образуются глицерин и соли высших карбоновых кислот – мыла. Кроме этого мыла получаются при нейтрализации высших карбоновых кислот гидроксидом натрия или калия или углекислым натрием:
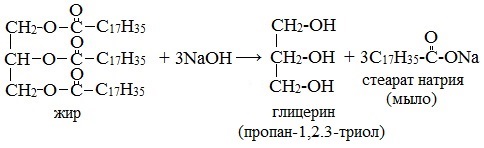
- Омыление триглицеридов гидроксидами натрия или калия
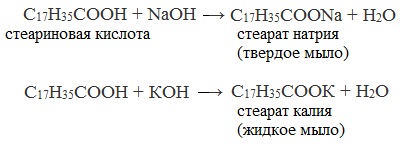
- Нейтрализация высших карбоновых кислот гидроксидом натрия (каустической содой) или гидроксидом калия
Твердые мыла получают при растворении высших карбоновых кислот в водном растворе гидроксида натрия, жидкие мыла — при растворении высших карбоновых кислот в водном растворе гидроксида калия.
- Нейтрализация высших карбоновых кислот углекислым натрием (кальцинированной содой):
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Промышленное получение мыла (варка мыла)
Для производства мыла в промышленности используют как синтетические жирные (высшие) кислоты, так и животные жиры, растительные масла, канифоль.
Для получения хозяйственных мыл применяют саломас с температурой плавления 46–60°С, для туалетного мыла — с температурой плавления 39–43°С.
Салома́с — это твёрдый жир, получаемый в промышленности путём гидрогенизации жидких жиров, в основном растительных масел.
Все жиры, используемые при варке мыла, не должны содержать воду и механические примеси.
Жидкие растительные масла применяют в мыловарении всех видов жидких хозяйственных и туалетных мыл. Наиболее ценным из является хлопковое масло, содержащее до 30 % насыщенных высших кислот, в основном пальмитиновой. Также используют и другие масла, такие как подсолнечное, соевое, кокосовое, пальмовое.
Введение небольших количеств жидких растительных масел в рецептуру хозяйственных мыл способствует снижению температуры их застывания.
Внесение 10–15 % канифоли увеличивает растворимость и пластичность мыла.
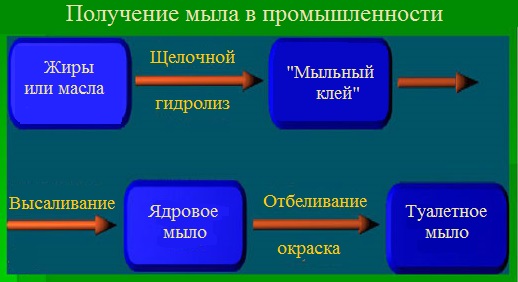
Основные стадии варки мыла
В промышленности мыла получают в две стадии – первая стадия химическая, вторая — механическая:
- Химическая стадия – варка мыла. Вначале проводят карбонатное омыление, при котором нейтрализуется около 70 % свободных жирных кислот. Затем проводят каустическое доомыление – нейтрализация оставшихся кислот гидроксидом натрия.
- Механическая стадия – охлаждение, сушка, шлифовка, отделка и упаковка готового продукта
Способы варки мыла
Варку мыла (химическая стадия) можно осуществить прямым и косвенным способом.
Для варки мыла прямым способом исходная жировая смесь должна быть хорошо очищена. Этим способом проводят нейтрализацию жировой смеси растворами содопродуктов и получают мыльный клей, содержащий 67–70 % жирных кислот. Далее его подвергают механической очистке — охлаждению, сушке, шлифовке, отделке. Прямой способ используется при варке хозяйственного мыла.
При варке мыла косвенным способом полученный прямым способом мыльный клей, подвергают дальнейшей обработке растворами электролитов, т.е. проводят высаливание. При этом происходит разделение мыльной массы на фазы: ядро и подмыльный щелок или ядро, подмыльный клей, подмыльный щелок. Полученное мыльное ядро в этом случае содержит 60–63 % жирных кислот. Далее полученное мыльное ядро обрабатывают подобно мылу, сваренному прямым способом. В качестве электролитов используют NaCl, NaOH. Косвенный способ применим для варки мыла из неочищенного жирового сырья. Варка мыла косвенным способом позволяет получить мыло высокой степени чистоты.
Жидкое мыло готовят из растительных масел, канифоли, таллового масли и др. прямым или косвенным способом. В качестве основания применяют соединения калия (KOH, K2CO3).
Если при варке мыла использовалось сырье из животных или растительных жиров, то после отделения ядра выделяют образующийся побочный продукт – глицерин. Глицерин широко применяют в различных отраслях производства.
Кратко схему производства мыла можно представить следующим образом:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Моющие свойства мыла
Итак, мыла – соли высших жирных кислот – состоят из аниона жирной кислоты и катиона металла (чаще всего натрия или калия).
В водных растворах щелочные мыла подвергаются гидролизу, т.к. образованы слабыми кислотами и сильными основаниями. Их растворы имеют щелочную реакцию (рН>7). В сильно разбавленных растворах мыла полностью диссоциируют на ионы:
Способность мыла пениться, отмывать загрязнения связана с образованием мицелл и высокой поверхностной активности. Водорастворимые щелочные мыла являются анионными поверхностно-активными веществами.
Углеводородный остаток жирной кислоты является гидрофобной частью мыла, кабоксильный ион – гидрофильной частью.
Этапы растворения грязи под действием мыла:
- При соприкосновении мыла с грязью, гидрофобная часть мыла окружает гидрофобное загрязняющее вещество и проникает внутрь, а поверхность загрязнения покрывается оболочкой гидрофильных групп.
- Гидрофильная часть мыла взаимодействуют с полярными молекулами воды.
- Ионы мыла «захватывают» загрязнение и отрываются от поверхности, переходя в воду.
- Плавающие частицы удерживаются в растворе до его смены.
В домашних условиях тоже можно приготовить мыло. Имея под рукой необходимые ингредиенты, самостоятельное производство мыла не составит большого труда.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Какие химические свойства характерны для мыла ответ подтвердите уравнениями химических реакций
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
- Омыление триглицеридов гидроксидом натрия
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Что такое мыла и как их получают? Какова химическая формула мыла?
Содержание:
Мыло – это вещество, которое используется в качестве косметического средства или средства бытовой химии. Это жидкий или твердый продукт, который содержит поверхностно-активные вещества (ПАВ). Эти вещества снижают поверхностное натяжение и увеличивают смачивающую способность воды.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

История открытия мыла
Впервые о мыле в Древнем Риме в 77 г. н.э. говорил Плиний Старший. В Русь из Византийской империи пришло не только православие, но и мыло. Особенно поддерживал мыловарение Петр I.
Формула мыла в химии была определена Мишелем Эжен Шеврёль в XIX веке. Ученый установил, что мыло — это смесь натриевых солей жирных кислот. В нашей столице первое производство мыла было открыто во второй половине XIX века. Мыло стоило одну копейку, поэтому его могли покупать даже бедные люди.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химическая формула мыла
Например, формула твердого мыла C17H35COONa, а жидкого – C17H35COOК. В состав мыла также входят красящие вещества и ароматизаторы.
Видео:8 класс Основания Химические свойстваСкачать

Особенные свойства мыла
Мыло формирует пену благодаря образованию мицелл и высокой поверхностной активности. Остаток кислоты – гидрофобная часть очищающего средства, карбоксильный ион – гидрофильная.
Грязь растворяется в несколько этапов:
- Гидрофобная часть мыла связывается с гидрофобной частью грязи, которая обволакивается слоем гидрофильных групп.
- Гидрофильная часть мыла реагирует с водой.
- Ионы мыла притягивают грязь, которая с потоком воды удаляется с поверхности.
Видео:Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать

Классификация мыла
I. По особенностям реагирования с водой:
- растворимые щелочные – калиевые, натриевые и аммониевые соли высших карбоновых кислот;
- нерастворимые металлические – соли других металлов.
II. По агрегатному состоянию:
- жидкие – соли калия, аммония;
- твердые – соли натрия, лития и других металлов.
III. По сферам применения:
- хозяйственные (применяются для стирки вещей);
- медицинские (содержат дезинфицирующие средства);
- туалетные (используются для мытья тела) и др.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Способы получения мыла
Видео:Характерные химические свойства | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Процесс изготовления мыла
Очищающее средство в промышленных условиях синтезируют в результате двух стадий.
- Химическая стадия. Она включает в себя карбонатное омыление, где нейтрализуется около 70 % кислот. Остальная часть кислот нейтрализуются гидроксидом натрия.
- Механическая стадия. Охлаждение, сушение, шлифование, отделка и упаковка готового материала.
Мыло можно сварить двумя способами.
- Прямой способ. В данном случае применяется только хорошо очищенная жировая смесь. В результате образуется мыльный клей, на 67-70% состоящий из жирных кислот. Прямой способ актуален в производстве хозяйственного мыла.
- Косвенный способ. Мыльный клей высаливают, т.е. обрабатывают электролитами. Мыльную массу затем разделяют на несколько фаз: ядро, подмыльный клей, подмыльный щелок. Мыльное ядро примерно на 65 % состоит из высших карбоновых кислот. Потом ядро обрабатывают как очищающее средство, полученное прямым способом. Косвенный способ актуален для изготовления декоративные мыла.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Как ПАВ влияют на природу
Водоемы могут самоочищаться, что достигается разбавлением, оседанием частичек на дно и созданием отложений, разложением органики до аммиака и солей аммония при помощи микробов. Устранить негативные последствия действия ПАВ сложно, ведь ПАВ в водоемах присутствуют в виде гомологов и изомеров. Если концентрация ПАВ в смеси близка к критической, то вредные свойства всех веществ в смеси суммируются.
ПАВ можно классифицировать на две группы:
- быстро разрушающиеся;
- практически неразрушающиеся и накапливающиеся в опасных концентрациях.
ПАВ опасны для природы, т. к. они понижают поверхностное натяжение. Если в водоемах поверхностное натяжение изменяется, то концентрация кислорода в воде снижается. Это приводит к развитию биомассы водных растений и гибели водных животных. Но ПАВ могут быть не только вредными, но и безопасными. Некоторые ПАВ распадаются на углеводы.
В организм человека или животного ПАВ попадают с пищей, водой и через кожу. ПАВ могут вызывать аллергию, которые иногда сопровождаются осложнениями.
📹 Видео
ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать

94. Что такое мылаСкачать

Химические свойства солей. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Сложные эфиры и мыла. 1 часть. 11 класс.Скачать

ЕГЭ по химии 2022 | Задание №6 | Химические свойства гидроксидов и солей в свете теорииСкачать

Сложные эфиры и мыла. 2 часть. 11 класс.Скачать