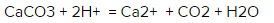Каким будет ионное уравнение реакции CaCO3 + 2HCl = CaCl2 + CO2 + H20?
Объясните как составить ионное уравнение этой реакции?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
Тип реакции: кислотно-основный.
В результате реакции карбонат кальция и 2 молекул хлорной кислоты, HCl нейтрализуется с образованием слабой неустойчивой кислоты H2CO3, которая не может оставаться в таком виде, потому распадается на углекислый газ CO2 и воду H2O.
Чтобы составить ионную реакцию, нужно сделать следующее:
- Проанализировать компоненты молекулярной реакции.
- Разложить на ионы газы, жидкости и растворы, а твердые вещества не трогать.
- Убрать с обоих сторон одинаковые ионы, записать конечный вид ионной реакции CaCO3 и 2HCl.
Итак, вот молекулярное уравнение:
Теперь нужно разобрать каждую составляющую этого уравнения, чтобы составить правильное ионное уравнение:
- CaCO3 не растворяется (ведь это обычный мел);
- HCl — кислота, растворяющаяся в воде;
- CaCl2 — хлорид кальция, растворяющийся в воде.
- H20 — это вода, в ионной реакции она не участвует;
- CO2 — газ, в данной ионной реакции он не участвует.
Теперь можно разложить составляющие на ионы (раскладывается только 2HCL и CaCl2):
CaCO3 (твердый элемент) + 2Cl- + 2H+ = Ca2+ + 2Cl- + CO2 + H2O
Что мы имеем? В обеих частях уравнения есть ионы хлора, потому их можно сократить. И вот что мы получаем в итоге:
Если вы любознательны и хотите знать больше, читайте также вопросы:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Тесты по общей и неорганической химии, тесты по аналитической химии
тест по теме
тесты по общей и неорганической химии, тесты по аналитической химии
Видео:Реакции ионного обмена. 9 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| Тесты по общей и неорганической химии | 172 КБ |
| Тесты по аналитической химии | 141.5 КБ |
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Предварительный просмотр:
Государственное бюджетное образовательное учреждение
среднего профессионального образования
«Армавирский медицинский колледж»
министерства здравоохранения Краснодарского края
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
Разработал преподаватель: Бирюкова Е.А.
Важным звеном учебно-воспитательного процесса является примерная оценка знаний, умений и навыков студентов. Необходимость контроля в системе обучения объясняется, прежде всего, общественной потребностью в получении информации об эффективности функционирования всей системы учебных заведений.
Контроль является неотъемлемым элементом учебного процесса, благодаря которому реализуется обратная связь в обучении, позволяющая оперативно реализовать его ход.
В последнее время в практику преподавателей входит тестирование как особая форма организации контроля знаний, умений и навыков каждого студента, позволяющая своевременно выявлять проблемы в знаниях и организовывать корректировочное индивидуальное обучение.
Известно, что тесты в обучении – это специальные задания, по результатам выполнения которых, можно судить об уровне знаний и умений испытуемого. Во многих тестах требуется определить из данного перечня общие или специфические свойства веществ, указать возможность протекания химических реакций.
В данной разработке приведены разнообразные тестовые задания, которые можно использовать как при изучении отдельных тем, так и для организации самостоятельной работы студентов.
Тестирование является средством углубления, систематизации, обобщения и закрепления знаний, умений и навыков студентов.
Полнота и всесторонность тестовых заданий обеспечивается включением в содержание его основных элементов учебного материала курса химии, а также и других дисциплин, проверку не только предметных (специальных) знаний, но и усвоение интегрированных знаний, мировоззренческих идей, а также специальных, общеучебных и интеллектуальных умений и навыков.
1. Чему равно массовое число атома?
а) числу протонов в атоме б) числу нейтронов в атоме
в) числу нуклонов в атоме г) числу электронов в атоме
2. Чему равно число нейтронов в атоме 31 15 Р?
3. Какое квантовое число характеризует направление электронного облака в пространстве?
4. Какие значения принимает магнитное квантовое число для орбиталей d-подуровня?
а) 0, 1, 2 б) 2, 1,0, +1, +2
в) 1, 0, +1 г) 1, 2, 3
5. Чему равно число орбиталей на ƒ-подуровне?
6. Атомы, какого элемента имеют электронную конфигурацию внешнего слоя: 4s 2 4p 5 ?
7. Чем отличаются атомы изотопов одного элемента?
а) числом протонов б) числом нейтронов
в) числом электронов г) зарядом ядра
8. Чему равно массовое число азота 7 N, который содержит 8 нейтронов?
9. Какие значения принимает орбитальное квантовое число для второго энергетического уровня?
а) 0, 1, 2 б) 2, 1, 0, +1,+2
10. Как обозначается подуровень, для которого n = 4 и l = 0?
11. Атомы, какого элемента имеют электронную конфигурацию внешнего слоя:…3s 2 3р 4 ?
12. Какую общую формулу имеет основание?
а) Ме(ОН) у б) Н 2 (Ас)
в) Эm Оn г) Ме х (Ас) у
13. Какой из оксидов является амфотерным?
14. Какое из оснований является двухкислотным?
в) NН 4 ОН г) Sn (ОН) 2
15. Какая из кислот является двухосновной?
в) Н 2 СО 3 г) Н 3 ВО 3
16. Какая из солей является кислой солью?
а) [Fe(ОН) 2 ] 2 СО 3 б) Fe (НСО 3 ) 3
в) Fe ОН СО 3 г) Fe 2 (CО 3 ) 3
17. Какова валентность кислотообразующего элемента в молекуле хлорной кислоты НСI О 4 ?
18. Какой из кислот соответствует название «сернистая кислота»?
а) Н 2 S б) Н 2 S 2 О 3
в) Н 2 SО 3 г) Н 2 SО 4
19. Какой соли соответствует название «карбонат висмута III»?
а) ВiОНСО 3 б) Вi 2 (CО 3 ) 3
в) Вi (НСО 3 ) 3 г) [Вi (ОН 2 )] CО 3
20. Какой соли соответствует название гидросульфат висмута III»
а) Вi (НSО 4 ) 3 б) Вi(НSО 3 ) 3
в) Вi (ОН) SО 4 г) [Bi (ОН 2 )] 2 SO 4
21. Какой соли соответствует название «дигидроксосульфит алюминия»?
а) [AL(ОН) 2 ] 2 SО 4 б) ALОНSО 3
в) [AL(ОН) 2 SO 3 г) ALОНSО 4
22. Какие из следующих веществ являются кристаллогидратами?
23. Какие из следующих веществ растворяются в воде?
24. Какие из следующих веществ растворяются в воде?
а) AgBr б) Cu(OH) 2
в) Zn(NO 3 ) 2 г) HgS
25. По какой формуле можно рассчитать массовую долю растворенного вещества?
26. Сколько граммов растворенного вещества содержится в 50г раствора с массовой долей (в ва) = 10%?
27. Сколько молей растворенного вещества содержится в 1л децимолярного раствора?
а) 0,2моль б) 1моль
в) 0,1моль г) 0,01моль
28. По какой формуле можно рассчитать молекулярную концентрацию раствора?
29. Сколько граммов растворенного вещества содержится в 150 г раствора с массовой долей (в ва) = 5%?
30. Какие из следующих электролитов при диссоциации образующих ионы Н + и ОН одновременно?
в) H 3 PO 4 г) AI(OH) 3
31. Какие частицы являются анионами?
32. Какие электролиты являются сильными?
в) H 2 S г) H 3 PO 4
33. Каким из следующих элементов могут соответствовать ионы с зарядом 2?
34. Сколько ионов образуется при диссоциации молекулы (NH 4 ) 2 SO 4 ?
35. Какая из следующих реакций выражается сокращенным ионным уравнением H + + OH = H 2 O?
а) CuOHCI+H 2 O б) HBr+KOH+KBr+H 2 O
36. Какие электролиты в ионном уравнении следующей реакции записываются в виде ионов:
37. Какие вещества образуют при диссоциации ионы Mn 2+ ?
а) KMnO 4 б) MnCI 2
в) Na 2 MnO 4 г) MnO 2
38. Какие электролиты образуют при диссоциации хлорид-ионы CI — ?
в) Ca(CIO) 2 г) НCIO
39. Каким из следующих элементов могут соответствовать ионы с зарядом +1?
40. Какие частицы являются катионами?
41. Какие из следующих электролитов являются слабыми?
а) H 2 SO 4 б) NaCI
в) AI(NO 3 ) 3 г) H 3 PO 4
42. Сколько ионов образуется при диссоциации двух молекул FeCI 3 ?
43. Какая из следующих реакций относится к реакциям ионного обмена?
а) б) СaО + H 2 O = Ca(OH) 2
44. Какие вещества в ионном уравнении следующей реакции записываются в виде молекул:
а) H 2 S б) Pb(NO 3 ) 2
45. Какие из следующих электролитов при диссоциации образуют гидроксидные ионы?
а) H 2 SO 4 б) AI(OH) 2 CI
в) Ca(HCO 3 ) 2 г) Sn(OH) 2
46. Какова среда раствора, если [ОН ] = 10 -11 моль/л?
а) кислая б) щелочная
47. Чему равно ионное произведение воды (t = 25 0 С)?
а) 10 -12 б) 10 -10
48. Какова среда раствора, если рН
а) нейтральная б) кислая
49. Чему равен рН раствора, если [Н + ]=10 -5 моль/л?
50. Какие из следующих солей не подвергаются гидролизу?
а) PbNO 3 б) KNO 3
в) AI 2 (SO 4 ) 3 г) Pb 2 CO 3
51. Растворы, каких электролитов характеризуются значениями рН > 7?
а) Na 2 CO 3 б) CaS
в) AI(NO 3 ) 3 г) BaCI 2
52. В растворах, каких солей метилоранж имеет желтый цвет?
а) Na 2 S б) LiCI
в) HCI г) H 3 PO 4
53. При каких значениях рН фенолфталеин окрашивается в малиновый цвет?
54. Какую окраску приобретает лакмус в нейтральной среде?
а) малиновую б) синюю
в) красную г) фиолетовую
55. Растворы, каких солей характеризуются значениями рН > 7?
а) NaBr б) AgNO 3
в) FeCI 3 г) CuSO 4
56. С какими из следующих веществ может реагировать оксид серы (VI)?
а) NaCI б) Na 2 O
57. С какими из следующих веществ может взаимодействовать оксид цинка?
в) H 2 SO 4 г) AI 2 (SO 4 ) 3
58. При взаимодействии, каких двух веществ, происходит реакция нейтрализации?
а) NaCI+AgNO 3 б) BaCI 2 +H 2 O
в) NaOH+HNO 3 г) BaCI 2 +H 2 SO 4
59. С какими металлами может взаимодействовать раствор хлорида меди (II)?
60. Какая кислота образуется при взаимодействии оксида фосфора (III) с водой?
а) H 3 PO 4 б) H 2 SO 4
в) HPO 3 г) H 3 PO 3
61. Изотопы химического элемента отличаются друг от друга:
а) по числу нейтронов б) по числу электронов
в) по числу протонов г) по положению в периодической системе
62. Какой газ выделяется при взаимодействии разбавленной серной кислоты с железом?
63. С какими из следующих веществ может реагировать оксид азота (V)?
а) CaCI 2 б) H 2 O
в) H 2 SO 4 г) HCI
64. С какими из следующих веществ может взаимодействовать оксид натрия?
в) NaOH г) BaSO 4
65. С какими металлами может взаимодействовать раствор нитрата свинца (II)?
66. Отстаивание применяют при разделении смеси, если компоненты обладают:
а) различной плотностью б) различной растворимостью
в) различной окраской г) различным агрегатным состоянием
67. Дистилляция – метод разделения смесей, в основе которых лежит:
а) различная температура кипения компонентов
б) различная плотность компонентов
в) различная растворимость веществ
г) различное агрегатное состояние веществ
68. Выпаривание применяют для выделения веществ и смесей, если компоненты обладают:
а) различной плотностью б) различным агрегатным состоянием
в) различной растворимостью г) различной температурой кипения
69. Химическое понятие «моль» показывает:
а) число атомов вещества б) число молекул вещества
в) количество вещества г) молекулярную массу вещества
70. Многие химические элементы образуют несколько простых веществ, обладающих различными свойствами. Это явление называют:
а) полиморфизмом б) гомологией
в) многомерностью г) аллотропией
71. Закон постоянства состава открыл ученый:
а) Дж. Пристли б) Ж.Л. Пруст
в) К. Шееле г) Дж. Дальтон
72. Химические соединения переменного состава называют:
а) сложными веществами б) дальтонидами
в) комплексными веществами г) бертоллидами
73. Химические соединения постоянного состава называют:
а) бертоллидами б) веществами
в) дальтонидами г) корпускулидами
74. В основе современной квалификации химических элементов лежит:
а) валентность б) строение атома
в) атомная масса г) число протонов в ядре атома
75. Ковалентная связь осуществляется за счет:
а) электронных облаков
б) валентных электронов
в) двух общих электронов, или электронной пары
г) электростатических сил притяжения
76. Химические соединения с ионной связью называют ионными или:
а) ковалентными б) электролитами
в) электростатическими г) гетерополярными
77. Кристаллические вещества, содержащие молекулы воды, называют:
а) кристаллогидратами б) гидратами
в) гидрированными г) сольватами
78. Суспензия представляет собой:
а) смесь твердого и жидкого веществ
б) раствор твердого вещества в жидком растворителе
в) лекарственное средство
г) коллоидный раствор
79. Эмульсия представляет собой:
а) жидкий раствор
б) смесь нерастворимых друг в друге жидких веществ
в) раствор яичного белка
г) средство для стирки
80. Коллоидный раствор отличается от истинного раствора:
в) размерами частиц растворенного вещества
г) способами приготовления
81. Ареометр – это прибор, с помощью которого:
а) определяют состав воздуха
б) устанавливают направление ветра
в) контролируют содержание вредных веществ в растворах
г) измеряют плотность жидкостей
82. В лаборатории растворитель может быть отделен от растворенного вещества:
а) электролизом б) декантацией
в) фильтрованием г) перегонкой
83. Какова среда водного раствора хлорида натрия?
а) нейтральная б) соленая
в) кислая г) щелочная
84. Какова среда водного раствора силиката натрия?
а) кислая б) соленая
в) нейтральная г) щелочная
85. Какой цвет приобретает лакмус в водной среде карбоната калия?
а) красный б) зеленый
в) синий г) бесцветный
86. Примером окислительно-восстановительной реакции является:
а) разложение известняка
б) разложение азотной кислоты
в) нейтрализация азотной кислоты
г) взаимодействие известняка с азотной кислотой
87. Раствор нитрата калия в воде, в присутствии фенолфталеина присутствует:
а) синим б) малиновым
в) бесцветным г) розовым
88. Раствор сульфата аммония в воде, окрасится лакмусом в:
а) синий цвет б) красный цвет
в) фиолетовый цвет г) останется бесцветным
89. Фтор – это самый:
а) активный неметалл б) прочный элемент
в) сильный окислитель г) электроотрицательный элемент
90. Число изотопов водорода известных науке равно:
91. Мельчащей химически неделимой частицей вещества является:
а) молекула б) ион
в) атом г) химический элемент
92. Количество вещества – это:
а) порция вещества, измеренная в молях
б) число структурных частиц, равное 6 10 23
в) масса вещества
г) навеска вещества
93. Физический смысл порядкового номера химического элемента в том, что он определяет:
а) положение элемента в периодической системе
б) число протонов в ядре атома
в) число энергетических уровней
г) число нейтронов в атоме
94. Физический смысл номера периода в периодической системе состоит в том, что:
а) он определяет сходные физико-химические свойства элементов данного периода
б) металлические свойства слева направо ослабевают
в) число электронных уровней в атомах равно номеру периода
г) свойства элементов периодически повторяются
95. Металлические свойства химических элементов с точки зрения химии обусловлены:
а) способностью атома отдавать электроны
б) способностью реагировать с неметаллами
в) величиной электроотрицательности
г) строением кристаллической решетки
96. Амфотерными свойствами не обладает:
в) Al 2 O 3 г) Cu 2 O
97. У химических элементов главных подгрупп с увеличением атомного номера усиливаются:
а) металлические свойства б) неметаллические свойства
в) химическая активность г) растворимость в воде
98. У химических элементов в пределах периода слева направо усиливаются:
а) металлический блеск б) электропроводность
в) окислительные свойства г) относительная плотность
99. У химических элементов главных подгрупп одинаковы:
а) строение внешнего энергетического уровня
в) химические свойства
г) степень окисления в оксидах
100. Химическую связь между ионами называют:
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Контрольная работа по химии за раздел «Неорганическая химия»
Контрольная работа по химии за раздел «Неорганическая химия»
1. Чему равно массовое число атома?
а) числу протонов в атоме б) числу нейтронов в атоме
в) числу нуклонов в атоме г) числу электронов в атоме
2. Чему равно число нейтронов в атоме 31 15 Р?
3. Какое квантовое число характеризует направление электронного облака в пространстве?
4. Какие значения принимает магнитное квантовое число для орбиталей d-подуровня?
а) 0, 1, 2 б) — 2, — 1,0, +1, +2
в) — 1, 0, +1 г) 1, 2, 3
5. Чему равно число орбиталей на ѓ-подуровне?
6. Атомы, какого элемента имеют электронную конфигурацию внешнего слоя: 4s24p5?
7. Чем отличаются атомы изотопов одного элемента?
а) числом протонов б) числом нейтронов
в) числом электронов г) зарядом ядра
8. Чему равно массовое число азота 7N, который содержит 8 нейтронов?
9. Какие значения принимает орбитальное квантовое число для второго энергетического уровня?
а) 0, 1, 2 б) — 2, — 1, 0, +1,+2
10. Как обозначается подуровень, для которого n = 4 и l = 0?
11. Атомы, какого элемента имеют электронную конфигурацию внешнего слоя:…3s23р4?
12. Какую общую формулу имеет основание?
в) Эm Оn г) Мех (Ас)у
13. Какой из оксидов является амфотерным?
14. Какое из оснований является двухкислотным?
в) NН4ОН г) Sn (ОН)2
15. Какая из кислот является двухосновной?
в) Н2СО3 г) Н3ВО3
16. Какая из солей является кислой солью?
а) [Fe(ОН)2]2СО3 б) Fe (НСО3)3
в) Fe ОН СО3 г) Fe2 (CО3)3
17. Какова валентность кислотообразующего элемента в молекуле хлорной кислоты НСI О4?
18. Какой из кислот соответствует название «сернистая кислота»?
в) Н2SО3 г) Н2SО4
19. Какой соли соответствует название «карбонат висмута III»?
а) ВiОНСО3 б) Вi2 (CО3)3
в) Вi (НСО3)3 г) [Вi (ОН2)] CО3
20. Какой соли соответствует название гидросульфат висмута III»
а) Вi (НSО4)3 б) Вi(НSО3)3
в) Вi (ОН) SО4 г) [Bi (ОН2)]2 SO4
21. Какой соли соответствует название «дигидроксосульфит алюминия»?
а) [AL(ОН)2]2 SО4 б) ALОНSО3
в) [AL(ОН)2SO3 г) ALОНSО4
22. Какие из следующих веществ являются кристаллогидратами?
а) К2SO3 б)
в) RbOH г)
23. Какие из следующих веществ растворяются в воде?
а) AIPO4 б)
24. Какие из следующих веществ растворяются в воде?
25. По какой формуле можно рассчитать массовую долю растворенного вещества?
а) 
в) 
26. Сколько граммов растворенного вещества содержится в 50г раствора с массовой долей 
27. Сколько молей растворенного вещества содержится в 1л децимолярного раствора?
а) 0,2моль б) 1моль
в) 0,1моль г) 0,01моль
28. По какой формуле можно рассчитать молекулярную концентрацию раствора?
а) 
в) 
29. Сколько граммов растворенного вещества содержится в 150 г раствора с массовой долей 
30. Какие из следующих электролитов при диссоциации образующих ионы Н+ и ОН — одновременно?
в) H3PO4 г) AI(OH)3
31. Какие частицы являются анионами?
а) Fe3+ б)
в) 
32. Какие электролиты являются сильными?
33. Каким из следующих элементов могут соответствовать ионы с зарядом — 2?
34. Сколько ионов образуется при диссоциации молекулы (NH4)2SO4?
35. Какая из следующих реакций выражается сокращенным ионным уравнением H+ + OH- = H2O?
а)
в) 
36. Какие электролиты в ионном уравнении следующей реакции записываются в виде ионов:
37. Какие вещества образуют при диссоциации ионы Mn2+?
а) KMnO4 б) MnCI2
в) Na2MnO4 г) MnO2
38. Какие электролиты образуют при диссоциации хлорид-ионы CI-?
в) Ca(CIO)2 г) НCIO
39. Каким из следующих элементов могут соответствовать ионы с зарядом +1?
40. Какие частицы являются катионами?
а) 
в) 
41. Какие из следующих электролитов являются слабыми?
в) AI(NO3)3 г) H3PO4
42. Сколько ионов образуется при диссоциации двух молекул FeCI3?
43. Какая из следующих реакций относится к реакциям ионного обмена?
а) 
в) 
44. Какие вещества в ионном уравнении следующей реакции записываются в виде молекул:
45. Какие из следующих электролитов при диссоциации образуют гидроксидные ионы?
а)H2SO4 б) AI(OH)2CI
в) Ca(HCO3)2 г) Sn(OH)2
46. Какова среда раствора, если [ОН-] = 10-11 моль/л?
а) кислая б) щелочная
47. Чему равно ионное произведение воды (t = 250С)?
48. Какова среда раствора, если рН 7?
в) AI(NO3)3 г) BaCI2
52. В растворах, каких солей метилоранж имеет желтый цвет?
53. При каких значениях рН фенолфталеин окрашивается в малиновый цвет?
54. Какую окраску приобретает лакмус в нейтральной среде?
а) малиновую б) синюю
в) красную г) фиолетовую
55. Растворы, каких солей характеризуются значениями рН > 7?
в) FeCI3 г) CuSO4
56. С какими из следующих веществ может реагировать оксид серы (VI)?
57. С какими из следующих веществ может взаимодействовать оксид цинка?
в) H2SO4 г) AI2(SO4)3
58. При взаимодействии, каких двух веществ, происходит реакция нейтрализации?
а) NaCI+AgNO3 б) BaCI2+H2O
в) NaOH+HNO3 г) BaCI2+H2SO4
59. С какими металлами может взаимодействовать раствор хлорида меди (II)?
60. Какая кислота образуется при взаимодействии оксида фосфора (III) с водой?
а) H3PO4 б) H2SO4
61. Изотопы химического элемента отличаются друг от друга:
а) по числу нейтронов б) по числу электронов
в) по числу протонов г) по положению в периодической системе
62. Какой газ выделяется при взаимодействии разбавленной серной кислоты с железом?
63. С какими из следующих веществ может реагировать оксид азота (V)?
64. С какими из следующих веществ может взаимодействовать оксид натрия?
65. С какими металлами может взаимодействовать раствор нитрата свинца (II)?
66. Отстаивание применяют при разделении смеси, если компоненты обладают:
а) различной плотностью б) различной растворимостью
в) различной окраской г) различным агрегатным состоянием
67. Дистилляция – метод разделения смесей, в основе которых лежит:
а) различная температура кипения компонентов
б) различная плотность компонентов
в) различная растворимость веществ
г) различное агрегатное состояние веществ
68. Выпаривание применяют для выделения веществ и смесей, если компоненты обладают:
а) различной плотностью б) различным агрегатным состоянием
в) различной растворимостью г) различной температурой кипения
69. Химическое понятие «моль» показывает:
а) число атомов вещества б) число молекул вещества
в) количество вещества г) молекулярную массу вещества
70. Многие химические элементы образуют несколько простых веществ, обладающих различными свойствами. Это явление называют:
а) полиморфизмом б) гомологией
в) многомерностью г) аллотропией
71. Закон постоянства состава открыл ученый:
в) К. Шееле г) Дж. Дальтон
72. Химические соединения переменного состава называют:
а) сложными веществами б) дальтонидами
в) комплексными веществами г) бертоллидами
73. Химические соединения постоянного состава называют:
а) бертоллидами б) веществами
в) дальтонидами г) корпускулидами
74. В основе современной квалификации химических элементов лежит:
а) валентность б) строение атома
в) атомная масса г) число протонов в ядре атома
75. Ковалентная связь осуществляется за счет:
а) электронных облаков
б) валентных электронов
в) двух общих электронов, или электронной пары
г) электростатических сил притяжения
76. Химические соединения с ионной связью называют ионными или:
а) ковалентными б) электролитами
в) электростатическими г) гетерополярными
77. Кристаллические вещества, содержащие молекулы воды, называют:
а) кристаллогидратами б) гидратами
в) гидрированными г) сольватами
78. Суспензия представляет собой:
а) смесь твердого и жидкого веществ
б) раствор твердого вещества в жидком растворителе
в) лекарственное средство
г) коллоидный раствор
79. Эмульсия представляет собой:
а) жидкий раствор
б) смесь нерастворимых друг в друге жидких веществ
в) раствор яичного белка
г) средство для стирки
80. Коллоидный раствор отличается от истинного раствора:
в) размерами частиц растворенного вещества
г) способами приготовления
81. Ареометр – это прибор, с помощью которого:
а) определяют состав воздуха
б) устанавливают направление ветра
в) контролируют содержание вредных веществ в растворах
г) измеряют плотность жидкостей
82. В лаборатории растворитель может быть отделен от растворенного вещества:
а) электролизом б) декантацией
в) фильтрованием г) перегонкой
83. Какова среда водного раствора хлорида натрия?
а) нейтральная б) соленая
в) кислая г) щелочная
84. Какова среда водного раствора силиката натрия?
а) кислая б) соленая
в) нейтральная г) щелочная
85. Какой цвет приобретает лакмус в водной среде карбоната калия?
а) красный б) зеленый
в) синий г) бесцветный
86. Примером окислительно-восстановительной реакции является:
а) разложение известняка
б) разложение азотной кислоты
в) нейтрализация азотной кислоты
г) взаимодействие известняка с азотной кислотой
87. Раствор нитрата калия в воде, в присутствии фенолфталеина присутствует:
а) синим б) малиновым
в) бесцветным г) розовым
88. Раствор сульфата аммония в воде, окрасится лакмусом в:
а) синий цвет б) красный цвет
в) фиолетовый цвет г) останется бесцветным
89. Фтор – это самый:
а) активный неметалл б) прочный элемент
в) сильный окислитель г) электроотрицательный элемент
90. Число изотопов водорода известных науке равно:
91. Мельчащей химически неделимой частицей вещества является:
а) молекула б) ион
в) атом г) химический элемент
92. Количество вещества – это:
а) порция вещества, измеренная в молях
б) число структурных частиц, равное 6 ⋅ 1023
в) масса вещества
г) навеска вещества
93. Физический смысл порядкового номера химического элемента в том, что он определяет:
а) положение элемента в периодической системе
б) число протонов в ядре атома
в) число энергетических уровней
г) число нейтронов в атоме
94. Физический смысл номера периода в периодической системе состоит в том, что:
а) он определяет сходные физико-химические свойства элементов данного периода
б) металлические свойства слева направо ослабевают
в) число электронных уровней в атомах равно номеру периода
г) свойства элементов периодически повторяются
95. Металлические свойства химических элементов с точки зрения химии обусловлены:
а) способностью атома отдавать электроны
б) способностью реагировать с неметаллами
в) величиной электроотрицательности
г) строением кристаллической решетки
96. Амфотерными свойствами не обладает:
97. У химических элементов главных подгрупп с увеличением атомного номера усиливаются:
а) металлические свойства б) неметаллические свойства
в) химическая активность г) растворимость в воде
98. У химических элементов в пределах периода слева направо усиливаются:
в) окислительные свойства г) относительная плотность
99. У химических элементов главных подгрупп одинаковы:
а) строение внешнего энергетического уровня
б) валентность в) химические свойства г) степень окисления в оксидах
100. Химическую связь между ионами называют:
💥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

75. Ионные реакции в растворах электролитовСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Реакции ионного обменаСкачать

Классификация реакций: ионные и радикальные реакцииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

2.15. Причина реакций ионного обмена | Неорганика к ЕГЭ | Георгий МишуровскийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Химия 8 класс: Реакции обмена в водных растворахСкачать

Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать

Химия 9 класс (Урок№6 - Реакции ионного обмена и условия их протекания.)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Электролитическая диссоциация. Тема 6. Электролиты и неэлектролиты.Скачать