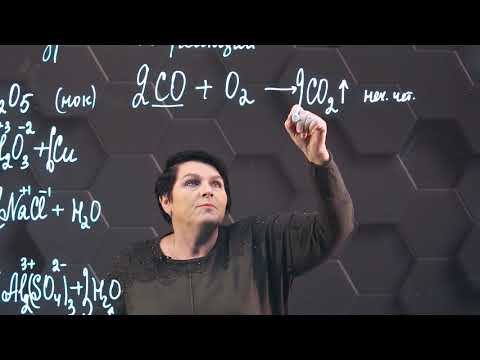- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ А) K Б) Zn В) Cl2 Г) N2 1) Fe, NaI, KOH 2) KOH, MgCl2, HF 3) C6H6, LiOH, CO2 4) O2, H2, Li 5) O2, S, HBr
- Химические свойства неметаллов
- Химические свойства галогенов
- Химические свойства кислорода
- Химические свойства серы
- Химические свойства азота
- Химические свойства фосфора
- Химические свойства углерода
- Химические свойства кремния
- 🎬 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:#2.Правило определения взаимодействия веществ друг с другом.Правило Бертолле. Реакции ионного обменаСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702fdfc67c090b3f • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ А) K Б) Zn В) Cl2 Г) N2 1) Fe, NaI, KOH 2) KOH, MgCl2, HF 3) C6H6, LiOH, CO2 4) O2, H2, Li 5) O2, S, HBr
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) K Б) Zn В) $Cl_2$ Г) $N_2$ | 1) Fe, NaI, KOH 2) KOH, $MgCl_2$, HF 3) $C_6H_6$, LiOH, $CO_2$ 4) $O_2$, $H_2$, Li 5) $O_2$, S, HBr |
Запишите выбранные цифры под соответствующими буквами.
А) K — калий — металл. Образует оксид в реакции с кислородом, соли в реакциях с неметаллами, вытесняет водород в кислотах.
Кислород, неметалл (сера) и кислота (HBr) расположены в строке под номером 5.
Б) Zn — цинк — металл. Образует оксид в реакции с кислородом, соли в реакциях с неметаллами, вытесняет водород в кислотах.
Кислород, неметалл (сера) и кислота (HBr) расположены в строке под номером 5.
В) $Cl_2$ — хлор — неметалл. Реагирует с щелочами, образуя соли соляной и хлорноватистой кислоты, реагирует с металлами, вытесняет бром и йод из соединений с водородом и металлами.
Щелочь (KOH), металл (Fe) и йодид (NaI) расположены в строке под номером 1.
Г) $N_2$ — азот — неметалл. Образует оксид в реакции с кислородом, аммиак в реакции с водородом, способен реагировать с литием при обычных условиях.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические свойства неметаллов
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом.
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например , водород взаимодействует с оксидом кремния:
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлорную кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами .
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например , железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например , азотная кислота окисляет серу до серной кислоты:
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
Соединения хлора, например , бертолетова соль , также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например , сера реагирует с гидроксидом натрия:
При взаимодействии с перегретым паром сера диспропорционирует:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами .
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000 о С или действие электрического разряда) азот реагирует с серой , фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например , литий реагирует с азотом с образованием нитрида лития:
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например , азот окисляет гидрид лития:
Видео:Составление уравнений химических реакций. 2 часть. 8 класс.Скачать

Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами .
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например , кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например , азотная кислота окисляет фосфор до фосфорной кислоты:
Серная кислота также окисляет фосфор:
Соединения хлора, например , бертолетова соль , также окисляют фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например , оксид серебра (I) :
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например , фосфор реагирует с гидроксидом калия:
Или с гидроксидом кальция:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами , и с неметаллами .
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором .
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов . При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например , углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например , углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями , в которых содержатся неметаллы с высокой степенью окисления.
Например , углерод восстанавливает сульфат натрия до сульфида натрия:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
🎬 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

8 класс. Химия. Уравнение химической реакции. Закон сохранения массы веществСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

ОВР часть 2Скачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать