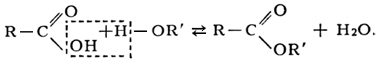- Этерификация
- ЭТЕРИФИКАЦИЯ: ЧТО ЭТО ТАКОЕ И РЕАКЦИИ — ХИМИЯ — 2022
- Реакции этерификации
- Приложения
- Ароматизаторы в пищевой промышленности
- Биодизель
- Сложные эфиры: способы получения и свойства
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
- Acetyl
- 📸 Видео
Этерификация
Этерифик а ция (от греч. aither— эфир и . фикация), получение эфиров сложных взаимодействием спиртов с кислотами. Например, в случае карбоновых кислот уравнение этерификации имеет следующий вид:
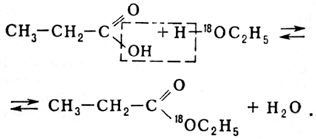
Этерификация — обратимая реакция: вода разлагает сложные эфиры с образованием исходных веществ (см. Гидролиз). Положение равновесия существенным образом зависит от природы и количества кислоты и спирта. Так, для этилового спирта и уксусной кислоты, если они взяты в эквимолекулярных количествах, равновесие устанавливается, когда две трети спирта и кислоты превращаются в эфир (этилацетат). На скорость достижения предела этерификации большое влияние оказывает температура. Так, в указанном примере при комнатной температуре через 368 сут образуется всего 55% эфира, при 100°С через 32 ч — 55,7%, а при 150°С через 24 ч образуется 66% эфира. Реакция ускоряется при добавлении сильных кислот, т. к. при этом увеличивается концентрация ионов водорода, являющихся катализаторами этерификации. По закону действия масс для повышения выхода сложного эфира необходимо увеличивать концентрацию одного из исходных веществ или удалять из сферы реакции образующийся эфир или воду. В последнем случае в реакционную смесь иногда добавляют вещества, образующие с водой азеотропные смеси, что облегчает ее отгонку. Н. А. Меншуткиным было установлено (1877—79), что легче всего этерифицируются первичные спирты, а наиболее трудно — третичные. В 1938 американские химики Д. Роберте и Г. Юри, используя метод меченых атомов, показали, что гидроксильная группа отщепляется от молекулы кислоты:
Среди разнообразных методов получения сложных эфиров этерификация является самым простым и удобным способом, имеющим наибольшее практическое значение. Этерификация — одна из хорошо исследованных и широко применяемых органических реакций; ее изучение впервые было предпринято в 1862—63 П. Бертло. Реакции этерификации широко распространены в живых клетках. Важное значение имеет этерификация для образования сложноэфирной связи между отдельными молекулами нуклеотидов в нуклеиновых кислотах. Эта связь соединяет остаток фосфорной кислоты у 5-го углеродного атома углевода пентозы одного мононуклеотида со спиртовой группой у 3-го углеродного атома пентозы другого мононуклеотида. Ее образование катализируют специфические ферменты класса лигаз — аминоацил-РНК-синтетазы. Реакция циклизации с отщеплением пирофосфата при образовании циклических нуклеотидов из соответствующих нуклеозидтрифосфатов по существу представляет собой также этерификацию, происходящую между кислотной и спиртовой группой внутри одной молекулы. Она осуществляется специфическими ферментами — аденилатциклазой и гуанилатциклазой.
Видео:91. Что такое реакция этерификацииСкачать

ЭТЕРИФИКАЦИЯ: ЧТО ЭТО ТАКОЕ И РЕАКЦИИ — ХИМИЯ — 2022
Этерификация — это обратимая химическая реакция между карбоновой кислотой и спиртом с образованием сложного эфира и воды.
Реакцию можно описать следующим образом:
КАРБОНАТНАЯ КИСЛОТА + СПИРТ → ЭФИР + ВОДА
Реакция этерификации протекает медленно, требует повышения температуры и присутствия катализатора для увеличения ее скорости. Этот процесс называется этерификацией Фишера .
Реакция, обратная этерификации, называется гидролизом сложного эфира . В этом случае карбоновая кислота и спирт производятся из сложного эфира и воды.
Видео:РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Реакции этерификации
Общее уравнение реакции этерификации выглядит следующим образом:
Обратите внимание, что вода образуется в результате объединения гидроксильной группы (ОН) карбоновой кислоты с водородом (Н) спирта.
Остальная часть углеродной цепи карбоновой кислоты и спирта объединяется с образованием сложного эфира.
Этерификация также может происходить между неорганической кислотой или вторичным или третичным спиртом.
В этом случае образование воды будет происходить иначе: гидроксильная группа будет происходить из спирта, а водород из кислоты.
Примером является реакция между неорганической кислотой и образованием неорганического сложного эфира. Три молекулы органической кислоты (азотной кислоты) реагируют с глицерином и образуют тринитроглицерин (сложный эфир нитрата), взрывчатое вещество.
Видео:Реакция этерификации. Химический опытСкачать

Приложения
Получение сложных эфиров важно для производства нескольких видов продукции. Вот некоторые примеры:
Видео:Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать

Ароматизаторы в пищевой промышленности
Этерификация Фишера является основным средством получения сложных эфиров на промышленных предприятиях, особенно в пищевых продуктах.
Ароматизаторы — это сложные эфиры, которые придают аромат и вкус промышленным продуктам, таким как конфеты, сладости, безалкогольные напитки и соки.
Примеры эфиров, используемых в качестве ароматизаторов:
- Этилэтан : аромат яблока
- Октилэтаноат : апельсиновый вкус
- Этилбутаноат : аромат ананаса
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Биодизель
Биодизель получают в результате реакции переэтерификации.
Процесс состоит из смешивания растительного масла или животного жира (триглицеридов) с метанолом или этанолом в присутствии катализатора.
Одним из продуктов реакции является глицерин, который можно использовать для производства косметики, продуктов питания и лекарств.
Видео:Реакция этерификации ФишераСкачать
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Классификация сложных эфиров
Видео:Реакция этерификацииСкачать

По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Видео:ВСЕ случаи, когда реакции идут ПРОТИВ правила Марковникова | Химия ЕГЭ 2023 | УмскулСкачать

Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Видео:ПОЛНЫЙ разбор ВАРИАНТА №4 из сборника Добротина! | Химия ЕГЭ УМСКУЛСкачать

Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
Видео:25. Схема реакции и химическое уравнениеСкачать

3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Получение сложных эфиров
Видео:РАЗБОР 5 ВАРИАНТА из сборника Добротина 2024 | Химия ЕГЭ УМСКУЛСкачать

1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Видео:Сложные эфиры и мыла. 1 часть. 11 класс.Скачать

2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📸 ВидеоВсе качественные реакции органических соединений за 45 минут | Химия 10 класс | УмскулСкачать  Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать  Все о реакциях присоединения в органике. Правило Марковникова | Химия ЕГЭ для 10 класса | УмскулСкачать  78. Что такое реакции полимеризацииСкачать  |