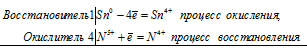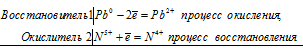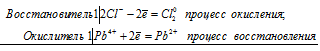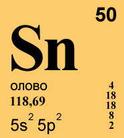Видео:Реакции металлов с азотной кислотой. Химический опытСкачать

We are checking your browser. gomolog.ru
Видео:Олово с конц азотной кислотойСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70354ddc9967008f • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются — оловянная кислота H2SnO3 и оксид азота (IV) NO2:
Sn 0 + 4N 5+ = Sn 4+ + 4N4 +
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
Pb 0 + 2N 5+ = Pb 2+ + 2N 4+
Задание 366
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2
Sn 2+ + 2Hg 2+ = Sn 4+ + 2Hg +
б) Реакция РЬО2 с НСl (конц.).
Pb 4+ + 2Cl — = Pb 2+ + Cl2 0
Задание 367
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а) Sn +2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH – + 4H2O = [Sn(OH)6] 2- + 2H2↑ (ионно-молекулярная форма)
б) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH — = [Pb(OH)4] 2- (ионно-молекулярная форма).
Видео:Реакция олова с концентрированной азотной кислотойСкачать

Sn Олово
ОЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710. О происхождении слов «stannum» и «олово» существуют различные догадки. Латинское «stannum», которое иногда производят от саксонского «ста» прочный, твердый, первоначально означало сплав серебра и свинца. «Оловом» в ряде славянских языков называли свинец. Возможно, русское название связано со словами «ол», «оловина» пиво, брага, мед: сосуды из олова использовались для их хранения. В англоязычной литературе для названия олова используется слово tin. Химический символ олова Sn читается «станнум».
Природное олово состоит из девяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%). 124 Sn b -излучатель, его период полураспада очень велик и составляет T1/2 = 10 16 10 17 лет. Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s 2 5p 2 . В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV).
Металлический радиус нейтрального атома олова 0,158 нм, радиусы иона Sn 2+ 0,118 нм и иона Sn 4+ 0,069 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома олова равны 7,344 эВ, 14,632, 30,502, 40,73 и 721,3 эВ. По шкале Полинга электроотрицательность олова 1,96, то есть олово находится на условной границе между металлами и неметаллами.
Физические и химические свойства: простое вещество олово полиморфно. В обычных условиях оно существует в виде b -модификации (белое олово), устойчивой выше 13,2°C. Белое олово это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a = 0.5831, c = 0.3181 нм. Координационное окружение каждого атома олова в нем октаэдр. Плотность b -Sn 7,228 г/см 3 . Температура плавления 231,9°C, температура кипения 2270°C.
При охлаждении, например, при морозе на улице, белое олово переходит в a -модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм). В сером олове координационный полиэдр каждого атома тетраэдр, координационное число 4. Фазовый переход b -Sn a -Sn сопровождается увеличением удельного объема на 25,6% (плотность a -Sn составляет 5,75 г/см 3 ), что приводит к рассыпанию олова в порошок. В старые времена наблюдавшееся во время сильных холодов рассыпание оловянных изделий называли «оловянной чумой». В результате этой «чумы» пуговицы на обмундировании солдат, их пряжки, кружки, ложки рассыпались, и армия могла потерять боеспособность. (Подробнее об «оловянной чуме» см. интересные факты об олове, ссылка внизу этой страницы).
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, b -Sn металл, а a -Sn относится к числу полупроводников. Ниже 3,72 К a -Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E °Sn 2+ /Sn равен 0.136 В, а E пары °Sn 4+ /Sn 2+ 0.151 В.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
С концентрированной соляной кислотой олово медленно реагирует:
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно.
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b -SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова (II):
При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn (II), например:
Гидрид олова станнан SnH4 можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C.
Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:
При сильном нагреве оксид олова (II) диспропорционирует:
При хранении на воздухе монооксид SnO постепенно окисляется:
При гидролизе растворов солей олова (IV) образуется белый осадок так называемая a -оловянная кислота:
Свежеполученная a -оловянная кислота растворяется в кислотах и щелочах:
При хранении a -оловянная кислота стареет, теряет воду и переходит в b -оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HOSn группировок при стоянии и замене их на более инертные мостиковые SnOSn связи.
При действии на раствор соли Sn (II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
История открытия: когда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы, по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры.
Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Нахождение в природе: олово редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10 4 до 8·10 3 % по массе. Основной минерал олова касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) Cu2FeSnS4 (27,5 % Sn).
Получение: для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Применение: важное применение олова лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. Олово способно прокатываться в тонкую фольгу станиоль, такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»).
Искусственный радионуклид олова 119 Sn источник v -излучения в мессбауэровской спектроскопии.
Физиологическое действие: о роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1-2)·10 4 % олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м 3 , ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках 100 мг/кг. Токсическая доза олова для человека 2 г.
📸 Видео
Взаимодействие меди с концентрированной азотной кислотой - 9 - 11 классСкачать

Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Получение концентрированной азотной кислотыСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Взаимодействие олова с разбавленными кислотами. Опыт 1Скачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Опыты по химии. Соляная кислота и металлыСкачать

Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Реакция алюминия с концентрированной азотной кислотой при нагреванииСкачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать