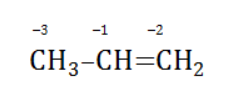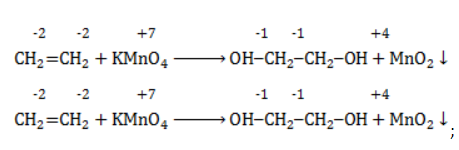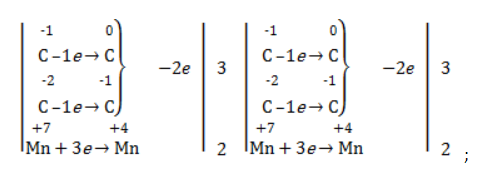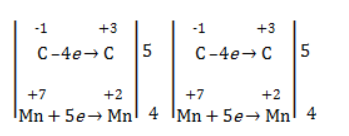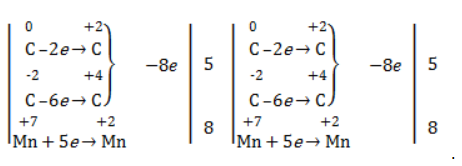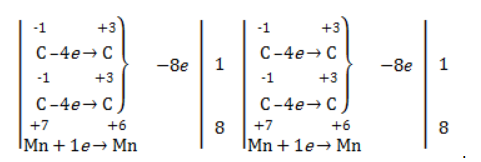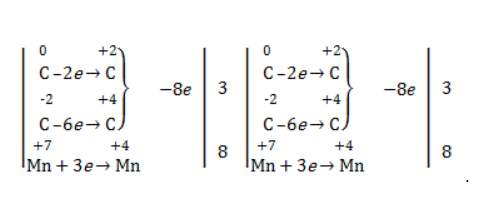Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Окислительно-восстановительные реакции в органической химии
- Определение степени окисления атомов в органических веществах
- Окисление и восстановление органических веществ
- Составление окислительно – восстановительных уравнений
- 📸 Видео
Видео:ОВР с перманганатом калия.Скачать
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
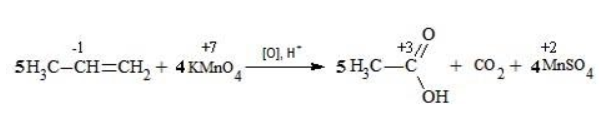
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

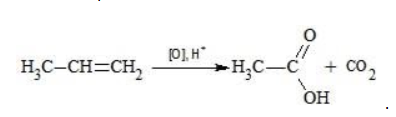
Окисление алкенов перманганатом калия
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 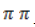
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
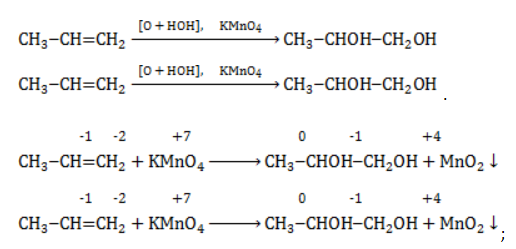
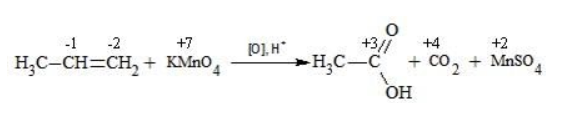
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Окисление органических соединений перманганатом калияСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 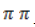
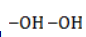
- кислород из перманганат-иона;
- вода.
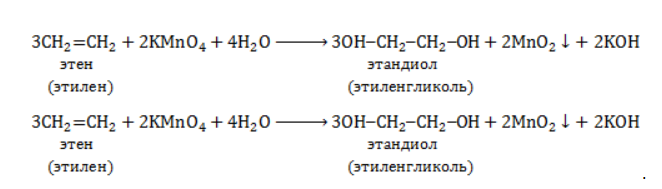
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
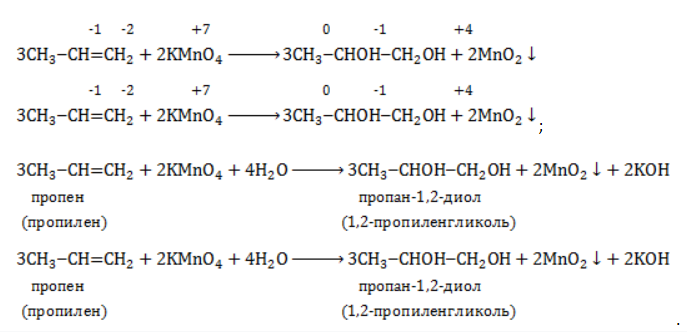
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 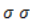
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
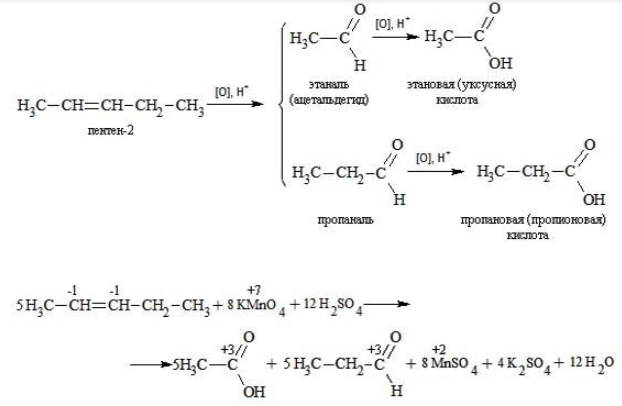
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
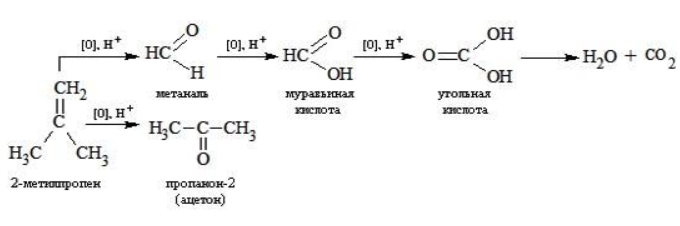
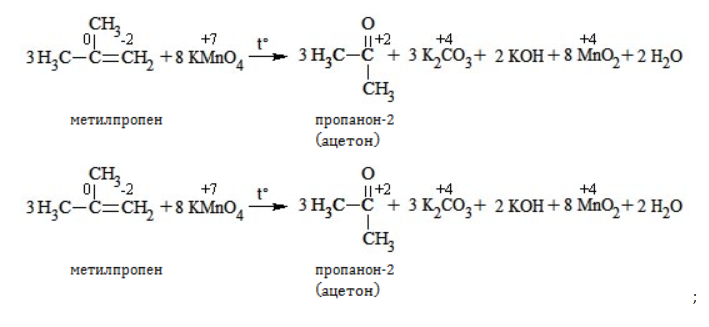
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
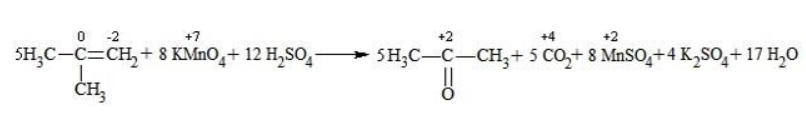
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Самый легкий способ уравнять ОВР в органике!Скачать

Окислительно-восстановительные реакции в органической химии
Разделы: Химия
Окислительно-восстановительные процессы издавна интересовали химиков и даже алхимиков. Среди химических реакций, происходящих в природе, быту и технике, огромное множество составляют окислительно-восстановительные: сгорание топлива, окисление питательных веществ, тканевое дыхание, фотосинтез, порча пищевых продуктов и т.д. В таких реакциях могут участвовать как неорганические вещества, так и органические. Однако если в школьном курсе неорганической химии разделы, посвященные окислительно-восстановительным реакциям, занимают значительное место, то в курсе органической химии на этот вопрос обращено недостаточно внимания.
Что же представляют собой восстановительно-окислительные процессы?
Все химические реакции можно разделить на два типа. К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
С современной точки зрения изменение степени окисления связано с оттягиванием или перемещением электронов. Поэтому наряду с приведенным можно дать и такое определение восстановительно-окислительных реакций: это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом, молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
4. Окисление всегда сопровождается восстановлением; восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединения электронов.
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
Нам представляется важным указывать значение СО атома углерода при изучении всей совокупности свойств органических соединений. Систематизация сведений об окислителях, установление связи между строением органических веществ и их СО помогут научить учащихся [1, 2]:
— Выбирать лабораторные и промышленные окислители;
Находить зависимость окислительно-восстановительной способности органического вещества от его строения;
— Устанавливать связь между классом органических веществ и окислителем нужной силы, агрегатного состояния и механизма действия;
— Предсказывать условия проведения реакции и ожидаемые продукты окисления.
Определение степени окисления атомов в органических веществах
Степень окисления любого атома углерода в органическом веществе равна алгебраической сумме всех его связей с более электроотрицательных элементов (Cl, O, S,N, и др.), учитываемых со знаком «+», и связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с соседними атомами углерода не учитываются [1].
Определим степени окисления атомов углерода в молекулах предельного углеводорода пропана и спирта этанола:
Последовательное окисление органических веществ можно представить в виде следующей цепочки превращений:
Насыщенный углеводород 






Генетическая связь между классами органических соединений представляется здесь как ряд окислительно–восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей классов органических соединений.
Изменение СО у атомов углерода в молекуле углерода в молекулах органических соединений приведены в таблице. Из данных таблицы видно, что при переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется. Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы. Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя, подобно тому, как это присуще неорганическим веществам.
Окисление и восстановление органических веществ
Повышенная склонность органических соединений к окислению обусловлена наличием в молекуле веществ [1, 2]:
- кратных связей (именно поэтому так легко окисляются алкены, алканы, алкадиены);
- определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и спиртовой), аминной — NH
;
- активированных алкильных групп, расположенных по соседству с кратными связям, например пропен может быть окислен до непредельного альдегида акролеина (кислородом воздуха в присутствии водяных паров на висмут- молибденовых катализаторах):
- атомов водорода при атоме углерода, содержащем функциональную группу.
Сравним первичные, вторичные и третичные спирты по реакционной способности к окислению:
Первичные и вторичные спирты, имеющие атомы водорода при атоме углерода, несущем функциональную группу; окисляются легко: первые – до альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.
Существуют два подхода к определению степеней окисления элементов в органических веществах.
1. Вычисляют среднюю степень окисления атома углерода в молекуле органического соединения, например пропана.
Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
Отметим, что формально дробные степени окисления, вычисленные таким образом, могут быть и в случае неорганических веществ. Например, в соединении КО
2. Определяют степень окисления каждого атома углерода, например в бутане.
В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+», и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления углерода в молекуле метанола.
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком « — »), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем:
Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Рассмотрим цепочку превращений веществ:
При каталитическом дегидрировании этана получается этилен; продукт гидратации этилена – этанол; его окисление приведет к этаналю, а затем – к уксусной кислоте; при ее сгорании образуется углекислый газ и вода.
Определим степени окисления каждого атома углерода в молекулах перечисленных веществ.
Можно заметить, что в ходе каждого из этих превращений постоянно меняется степень окисления одного из атомов углерода. В направлении от этана к оксиду углерода (IV) происходит увеличение степени окисления атома углерода.
Несмотря на то, что в ходе любых окислительно-восстановительных реакций происходит как окисление, так и восстановление, их классифицируют в зависимости оттого, что происходит непосредственно с органическим соединением (если оно окисляется, говорят о процессе окисления, если восстанавливается – о процессе восстановления).
Так, в реакции этанола с перманганатом калия этанол будет окисляться, а перманганат калия – восстанавливается. Реакцию называют окислением этанола.
Составление окислительно – восстановительных уравнений
Для составления уравнений окислительно- восстановительных реакций используют как метод электронного баланса, так и метод полуреакций (электронно — ионный метод). Рассмотрим несколько примеров окислительно- восстановительных реакций с участием органических веществ 3.
1. Горение н-бутана.
Схема реакции имеет вид:
Составим полное уравнение химической реакции методом баланса.
Среднее значение степени окисления углерода в н-бутане:
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:
C учетом найденных коэффициентов уравнение химической реакции горения н-бутана будет выглядеть следующим образом:
Коэффициенты для этого уравнения можно найти и другим методом, о котором уже упоминалось. Рассчитав степени окисления каждого из атомов углерода, видим, что они различаются:
В этом случае схема электронного баланса будет выглядеть так:
Так как в ходе горения н-бутана в его молекулах разрушаются все химические связи, то в данном случае первый подход вполне оправдан, тем более что схема электронного баланса, составленная вторым способом, несколько сложнее.
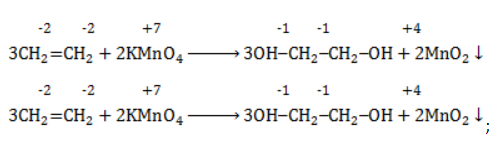
2. Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду (реакция Вагнера).
Расставим коэффициенты в уравнении реакции методом электронного баланса.
Полное уравнение химической реакции будет выглядеть так:
Для определения коэффициентов можно воспользоваться и методом полуреакций. Этилен окисляется в этой реакции до этиленгликоля, а перманганат – ионы восстанавливаются с образованием диоксида марганца.
Схемы соответствующих полуреакций:
Суммарное электронно-ионное уравнение:
3. Реакции окисления глюкозы перманганата калия в кислой среде.
А. Метод электронного баланса.
Рассчитаем степени окисления каждого из атомов углерода в молекуле глюкозы:
Схема электронного баланса усложняется по сравнению с предыдущими примерами:
Б. Метод полуреакций в данном случае выглядит следующим образом:
Суммарное ионное уравнение:
Молекулярное уравнение реакции глюкозы перманганататом калия:
В органической химии целесообразно использовать определение окисления как увеличение содержания кислорода или уменьшение содержания водорода [4]. Восстановление в таком случае определяется как уменьшение содержания кислорода или увеличение содержания водорода. При таком определении последовательное окисление органических веществ можно представить следующей схемой:
Практика показывает, что подбор коэффициентов в реакциях окисления органических веществ вызывает определенные затруднения, так как приходится иметь дело с весьма непривычными степенями окисления.[4]. Некоторые учащиеся из-за отсутствия опыта продолжают отождествлять степень окисления с валентностью и, вследствие этого, неправильно определяют степень окисления углерода в органических соединениях. Валентность углерода в этих соединениях всегда равна четырем, а степень окисления может принимать различные значения (от -3 до +4, в том числе дробные значения). Непривычным моментом при окислении органических веществ является нулевая степень окисления атома углерода в некоторых сложных соединениях. Если преодолеть психологический барьер, составление таких уравнений не представляет сложности, например:
Степень окисления атома углерода в сахарозе равна нулю. Переписываем схему реакции с указанием степеней окисления атомов, которые их меняют:
Составляем электронные уравнения и находим коэффициенты при окислителе и восстановителе и продуктах их окисления и восстановления:
Подставим полученные коэффициенты в схему реакции:
Оставшиеся коэффициенты подбираем в такой последовательности: K




Многие вузы включают в билеты для вступительных экзаменов задания по подбору коэффициентов в уравнениях ОВР электронным методом(методом полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то, в основном при окислении неорганических веществ. Попробуем применить метод полуреакций для выше приведенного примера окисления сахарозы перманганатом калия в кислой среде.
Первое преимущество этого метода заключается в том, что нет необходимости сразу угадывать и записывать продукты реакции. Они достаточно легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно проявляет свои окислительные свойства, например, анион MnO


Запишем в молекулярном виде превращения сахарозы:
В левой части не хватает 13 атомов кислорода, чтобы устранить это противоречие, прибавим 13 молекул H
Левая часть теперь содержит 48 атомов водорода, они выделяются в виде катионов Н
Теперь уравняем суммарные заряды справа и слева:
Схема полуреакций готова. Составление схемы второй полуреакции обычно не вызывает затруднений:
Объединим обе схемы:
Сократив обе части уравнения на 65 H

Упражнения. Расставьте коэффициенты методом электронного баланса в уравнениях реакций:
б) С




в) СН






г) С











д) СН





Упражнения. Расставьте коэффициенты методом электронного баланса:
а) С













12MnO












5С













в) C














г) CH











д) СН






1. Матч Дж. Органическая химия. Реакции, механизмы и структура: В 4т./ Пер. с англ.- М.: Мир, 1987-1988.
2. Карцова А.А, Левкин А. Н. Окислительно-восстановительные реакции в органической химии // Химия в школе. — 2004. — №2. – С.55-61.
3. Хомченко Г.П., Савостьянова К.И. Окислительно-восстановительные реакции: Пособие для учащихся . М.- : Просвещение , 1980.
4. Шарафутдинов В. Окислительно-восстановительные реакции в органической химии // Башкортостан уkытыусыhы. — 2002. — №5. – С.79 -81.
📸 Видео
Химия 9 класс — Как определять Степень Окисления?Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Суть всех ОВР за 10 минут! | Химия ЕГЭ 2024 | УМСКУЛСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей