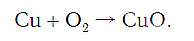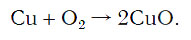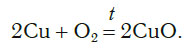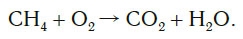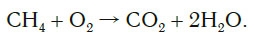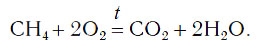- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Как составить уравнение химической реакции: последовательность действий
- Составление формул по валентности
- Что такое уравнение
- Алгоритм действий
- Важные аспекты
- Окислительно-восстановительные взаимодействия
- Ионные уравнения
- Заключение
- Урок 12. Составление уравнений химических реакций
- 🌟 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:8 класс. Составление уравнений химических реакций.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e21fb652f2841ee • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как составить уравнение химической реакции: последовательность действий
Поговорим о том, как составить уравнение химической реакции. Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Составление формул по валентности
Для того чтобы правильно записывать процессы, происходящие между различными веществами, нужно научиться записывать формулы. Бинарные соединения составляют с учетом валентностей каждого элемента. Например, у металлов главных подгрупп она соответствует номеру группы. При составлении конечной формулы между этими показателями определяется наименьшее кратное, затем расставляются индексы.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Что такое уравнение
Под ним понимают символьную запись, которая отображает взаимодействующие химические элементы, их количественные соотношения, а также те вещества, которые получаются в результате процесса. Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Алгоритм действий
Например, нужно написать процесс горения кальция, пользуясь символами, коэффициентами, индексами. Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через «+» записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
За знаком равенства формируем состав продукта реакции, используя правила расстановки валентности:
Продолжая разговор о том, как составить уравнение химической реакции, отметим необходимость использования закона постоянства состава, а также сохранения состава веществ. Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Важные аспекты
Для того чтобы понять, как составить уравнение химической реакции, отметим некоторые теоретические вопросы, касающиеся этой темы. Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
При уравнивании левой и правой частей уравнения используют наименьшее общее кратное, аналогично тому, как составляется формула соединения с учетом валентностей каждого элемента.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Окислительно-восстановительные взаимодействия
После того как у школьников будет отработан алгоритм действий, они смогут составить уравнение реакций, характеризующих химические свойства простых веществ. Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Fe + CuSO4 = FeSO4 + Cu.
Существуют определенные правила, согласно которым расставляют степени окисления в простых и сложных веществах. Например, у двухатомных молекул этот показатель равен нулю, в сложных соединениях сумма всех степеней окисления также должна быть равна нулю. При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
Между этими показателями определяется наименьшее кратное, а также коэффициенты. Завершающим этапом разбора окислительно-восстановительного взаимодействия является расстановка коэффициентов в схеме.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Ионные уравнения
Одним из важных вопросов, который рассматривается в курсе школьной химии, является взаимодействие между растворами. Например, дано задание следующего содержания: «Составьте уравнение химической реакции ионного обмена между хлоридом бария и сульфатом натрия». Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Вещества, которые не растворяются на ионы, записывают в молекулярном виде. Реакция обмена ионами протекает полностью в трех случаях:
- образование осадка;
- выделение газа;
- получение малодиссоциируемого вещества, например воды.
При наличии у вещества стереохимического коэффициента он учитывается при написании полного ионного уравнения. После того как будет написано полное ионное уравнение, проводят сокращение тех ионов, которые не были связаны в растворе. Конечным итогом любого задания, предполагающего рассмотрение процесса, протекающего между растворами сложных веществ, будет запись сокращенной ионной реакции.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Заключение
Химические уравнения позволяют объяснять с помощью символов, индексов, коэффициентов те процессы, которые наблюдаются между веществами. В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
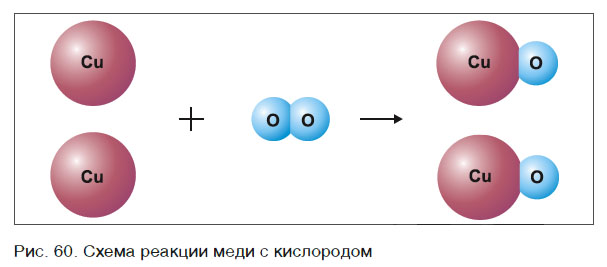
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
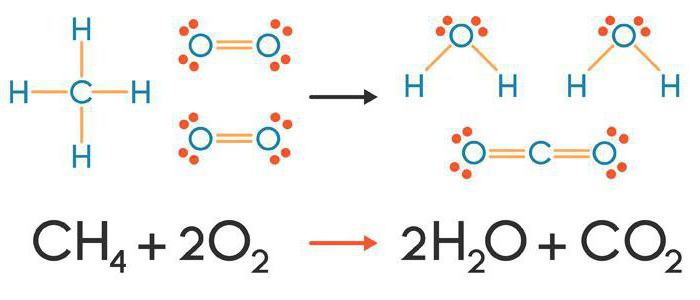
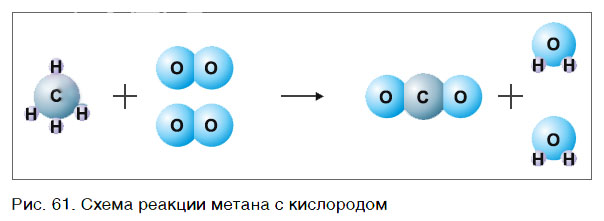
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
🌟 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химия | Молекулярные и ионные уравненияСкачать

Уравнивание реакций горения углеводородовСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать