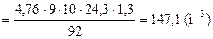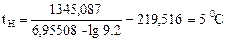Горением называется сложный физико-химический процесс, представляющий собой окислительно-восстановительную реакцию между горючим веществом и окислителем, сопровождающийся выделением тепла и излучением света. Для горения необходимо наличие трёх составляющих: горючего вещества; окислителя (кислород воздуха, озон, перекись водорода, галогены, перманганат калия, хромовый ангидрид и т. д.) и благоприятствующего фактора (источник зажигания; физико-химический или биологический процесс, протекающий с выделением тепла, нагретая поверхность).
С точки зрения электронной теории, горение – это перераспределение валентных электронов между горючим веществом и окислителем.
Горючим веществом называется вещество, атомы (молекулы) которого способны отдавать в процессе реакции свои валентные электроны. Горючее вещество в процессе реакции окисляется, образуя продукты окисления.
Окислителем называется вещество, атомы (молекулы) которого способны присоединять валентные электроны в процессе реакции. Окислитель в ходе реакции восстанавливается.
Процесс горения как одна из форм химического взаимодействия атомов и молекул может по-настоящему понятен только на основе изучения молекулярно-кинетической теории строения материи. Необходимо представлять, что в химических процессах, прежде чем образуются новые молекулы, разрушаются старые. Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации. Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10 о С приводит к увеличению её скорости в 2–4 раза (правило Вант-Гоффа). Кроме того, скорость реакции согласно закону действующих масс увеличивается с возрастанием концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси – когда отношение реагентов соответствует коэффициентам в уравнении реакции.
В условиях пожара горение чаще всего протекает в среде воздуха. При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Воздух состоит из азота, кислорода, водорода, углекислого и инертных газов. При ведении теоретических расчётов водород, углекислый газ и инертные газы (их вместе взятых в воздухе около 1 %) причисляют к азоту, которого в воздухе 78 %. Поэтому можно принять, что воздух состоит из 21 % кислорода и 79 % азота. Не трудно установить, что на 1 объём кислорода в воздухе приходится 3,76 объёма азота (79 : 21 = 3,76) или на 1 моль кислорода приходится 3,76 моля азота и, таким образом, состав воздуха в уравнениях реакций горения – (О2 + 3,76 N2).
В реакции горения принимает участие только кислород. Азот в реакцию не вступает и выделяется из зоны горения вместе с продуктами горения. В левой части уравнения реакции горения записывают горючее вещество и воздух, в правой части – продукты горения. При уравнивании левой и правой частей уравнения реакции горения коэффициент перед горючим веществом для упрощения расчётов параметров процесса горения, как правило, не ставят, т.е. принимают равным единице, в связи с чем коэффициент перед воздухом может получаться дробным.
Для решения задач по определению основных параметров, характеризующих процесс горения, необходимо уметь составлять уравнения реакций горения горючих веществ в воздухе.
Обобщённая запись брутто-уравнения материального баланса реакции горения имеет вид:
где nг.в, nо, nпгi – стехиометрические коэффициенты при соответствующих веществах: [г.в.] – горючее вещество, [о] – окислитель, [пг] – продукты горения.
Данное уравнение является обобщённым выражением материального баланса любой химической реакции окисления. Оно не несёт информации о промежуточных стадиях процесса, которых может быть великое множество, а выражает только начальное и конечное состояние системы. Поэтому его называют также суммарным или брутто-уравнением реакции горения. Для решения многих инженерно-технических задач этого уравнения бывает достаточно.
Рассмотрим примеры составления уравнений реакций горения горючих веществ в воздухе.
ПРИМЕР: Составить уравнение реакции горения пропана (С3Н8) в воздухе.
При горении углеводородов в воздухе продуктами горения будут углекислый газ (СО2), пары воды (Н2О) и азот (N2) из воздуха:
Уравняем эту реакцию, в результате чего число атомов каждого элемента в правой части уравнения будет равно числу атомов этих элементов в левой части.
Углерода в молекуле пропана 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле пропана 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н2О два атома водорода (8: 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 5 (10 : 2 = 5), т. к. в молекуле кислорода 2 атома. Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3,76.
Окончательная запись уравнения реакции горения пропана в воздухе имеет вид:
Коэффициент, стоящий перед скобкой воздуха, называется стехиометрическим коэффициентом реакции горения и обозначается β. В нашем случае β = 8.
При горении кислородосодержащих соединений в воздухе уравнивание реакции происходит аналогично. Однако при уравнивании атомов кислорода нужно учесть количество атомов кислорода, содержащихся в горючем веществе, которые тоже участвуют в реакции.
Для этого из количества атомов кислорода в правой части уравнения реакции нужно вычесть количество атомов кислорода, содержащихся в горючем веществе, а потом уже делить на 2.
ПРИМЕР: Составить уравнение реакции горения пропилового спирта в воздухе.
Углерода в молекуле пропилового спирта 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н2О два атома водорода (8 : 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 4,5 (10 — 1 = 9; 9: 2 = 4, 5). Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3, 76.
Окончательная запись уравнения реакции горения пропилового спирта в воздухе имеет вид:
Если в состав горючего вещества входит галоген и горючее вещество не содержит водород, то в продуктах горения он будет выделяться в свободном виде (Cl2, Br2 и т. д.). Если же горючее вещество содержит водород, то в продуктах горения он будет выделяться в соединении с водородом, например хлороводород (НCl).
Если в состав горючего вещества входят сера, алюминий, кремний и др., то в продуктах горения будут выделяться оксиды этих элементов (SO2, Al2O3, SiO2). При горении веществ, содержащих азот, он выделяется в виде чистого газа азота (N2) и записывается отдельно от азота, содержащегося в воздухе.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Написать структурные формулы,составить уравнения реакций горения горючих веществ в воздухе и рассчитать стехиометрические коэффициенты.
1.1.амилбензол, абиетиновая кислота, аллиламин;
1.2.амилдифенил, адипиновая кислота, аллилизотиоцианат;
1.3.амилен, акриловая кислота, альнафт;
1.4.амилнафталин, аллилацетат, альтакс;
1.5.амилтолуол,аллилидендиацетат,амиламин;
1.6.антрацен, аллилкапроат, амилнитрат;
1.7.аценафтен, аллиловьiй спирт, амилнитрит;
1.8.ацетилен, амилацетат, амилсульфид;
1.9.бензол,амилбутират,амилтрихлорсилан;
1.10.бутилбензол, амилксилиловый эфир, амилхлорнафталин;
1.11.бутилциклогексан, амиллаурат, аминалон;
1.12.бутилциклопетан, амилметилкетон, аминоазокраситель;
1.13.гексадекан, амилолеат, аминокапроновая кислота;
1.14.гексан, амилсалицилат, аминопеларгоновая кислота;
1.15.гексилциклопентан, амилстеарат, аминоциклогексан;
1.16.гептадекан, амилфенилметиловый эфир, ампициллин;
1.17.гептан, амнлфениловый эфир, ангинин;
1.18.декан, амилформиат, анилин;
1.19.диамилбензол, анизол, антримид;
1.20.диамилнафталин, ацеталь, атофан;
1.21.дивинилацетилен, ацетальдегид, ацеклидин;
1.22.дигидроциклопентадиен, ацетилацетон, ацетанилид;
1.23.диизобутилен, ацетисалициловая кислота, ацетилхлорид;
1.24.диизопропилбензол, ацетилтрибутилцитрат, ацетоацетанилид;
1.25.диметиленциклобутан, ацетометоксан, ацетонитрил;
1.26.дитолилметан, ацетон, ацетоксим;
1.27.дифенил, ацетонилацетон, ацетоэтиламид;
1.28.дифенилметан, ацетопропиловый спирт, бензамид;
1.29.диэтилциклогексан, ацетоуксусный эфир, бензилдиэтиламин;
1.30.додекан, ацетофенон, бензилтиол;
1.31.изобутилбензол, бензальдегид, бензилхлорид;
1.32.изобутилциклогексан, бензантрон, бензилцианид;
1.33.изооктан, бензгидрол, бензимидазол;
1.34.изопентан, бензилацетат, бензоат натрия;
1.35.изопрен, бензилбензоат, бензоилхлорид;
1.36.изопропенилбензол, бензилсалицилат, бензоксазолон;
1.37.изопропилацетилен, бензилцеллозольв, бензолсульфазид;
1.38.метилциклогексан, бензилэтиловый эфир, бензолсульфамид;
1.39.метилциклопентан, бензилянтарная кислота, бензолсульфокислота;
1.40.октилтолуол, метоксибутилацетат, бензонитрил.
2.Написать структурные формулы и определить при сгорании какого горючего вещества выделится большее число молей продуктов горения?
2.1.бензофенон и бензофенонтетракарбоновая кислота;
2.2.борнеол и бутаналь;
2.3.бутановая кислота и бутилацетат;
2.4.бутилацетилрицинолеат и бутилацетоацетат
2.5.бутилбензилсебацинат и бутилбензоат;
2.6.бутилбутират и бутилвиниловый эфир;
2.7.бутилгликоль и бутилгликольацетат;
2.8.бутилглицидный эфир и бутилдиэтиладипинат;
2.9.бутилизовалериат и бутилкапронат;
2.10.бутилкарбитол и бутиллактат;
2.11.бутиллаурат и бутилметакрилат;
2.12.бутилметилкетон и бутилолеат;
2.13.бутилпропионат и бутилрициноолеат;
2.14.бутилстеарат и бутилфениловый эфир;
2.15.бутилформиат и бутилэтилацетальдегид;
2.16.бутилэтилкетон и бутилэтиловый эфир;
2.17.валериановая кислота и валериановый альдегид;
2.18.ванилин и ветиверилацетат;
2.19.ветиверовый спирт и ветинилацетат;
2.20.ветинон и винилаллиловый эфир;
2.21.винилацетат и винилбутират;
2.22.винилизобутиловый эфир и винилизооктиловый эфир;
2.23.винилизопропиловый эфир и винилкротонат;
2.24.винилметилкетон и винилоксиэтилметакрилат;
2.25.винилоктадециловый эфир и винилпропионат;
2.26.винилтриметилнониловый эфир и винилэтиловый эфир;
2.27.винилэтиловый эфир и винная кислота;
2.28.витамин А (ацетат) и витамин С;
2.29.галловая кислота и гексаналь;
2.30.гексановая кислота и гексилацетат;
2.31.гексилбутират и гексилдиэтилгексагидрофталат;
2.32.гексилметакрилат и гексилметилкетон;
2.33.гексиловый спирт и гексилпропионат;
2.34.гексилформиат и гексилцеллозольв;
2.35.гелиотропин и гептадециловый спирт;
2.36.гептаналь и гептилацетат;
2.37.гептилбутират и гептилдифенилкетон;
2.38.гептилизобутилкетон и гептилметилкетон;
2.39.гептиловый спирт и гептилпропионат;
2.40.гептилформиат и гидрохинон.
Видео:Уравнивание реакций горения углеводородовСкачать

Правила составления уравнения реакции горения
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ИВАНОВСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ МИНИСТЕРСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ»
Кафедра химии, теории горения и взрыва
Т.А Мочалова, Д.В. Батов, А.В. Петров
Теория горения и взрыва
Задания и методические указания по выполнению
Расчетно-графической работы
Иваново
Мочалова Т.А, Батов Д.В., Петров А.В. Теория горения и взрыва. Задания и методические рекомендации по выполнению расчетно-графической работы. Учебное пособие. Иваново: ООНИ ИвИ ГПС МЧС России, 2012.- 38 с.
Учебное пособие предназначено для обучающихся по специальности 280705 Пожарная безопасность и направлению подготовки 280700 Техносферная безопасность. Учебное пособие охватывает основные темы дисциплины «Теория горения и взрыва» и рассчитано на более глубокое ее усвоение. Пособие содержит варианты контрольных заданий и методические рекомендации по выполнению расчетно-графической работы по дисциплине «Теория горения и взрыва».
Печатается по решению Редакционно-издательского совета института
Рассмотрено и рекомендовано к публикации кафедрой химии, теории горения и взрыва, протокол № 7 от 22 декабря 2011 года.
Ведущий научный сотрудник ФГБУН
Институт химии растворов им. Г.А.Крестова РАН
доктор химических наук П.Р.Смирнов
кафедры физики и теплотехники
Ивановского института ГПС МЧС России
кандидат химических наук О.Е.Сторонкина
© Ивановский институт ГПС МЧС России, 2012
| Стр. |
| Список используемых сокращений |
| ВВЕДЕНИЕ |
| Общие указания по выполнению расчетно-графической работы |
| Правила составления уравнения реакции горения |
| Пример решения задач |
| Задачи для самостоятельного решения |
| Список рекомендуемой литературы |
| Приложения |
Список используемых сокращений
КПР – концентрационные пределы распространения пламени
НКПР – нижний концентрационный предел распространения пламени
ВКПР — верхний концентрационный предел распространения пламени
ТПР – температурные пределы распространения пламени
ПГ – продукты горения
ГВ – горючее вещество
Введение
В результате изучения дисциплины «Теория горения и взрыва» у обучающихся формируется теоретический фундамент для глубокого осмысления всей системы показателей пожарной опасности веществ и материалов как совокупности предельных условий и параметров возникновения и прекращения горения.
Овладение методами расчета показателей пожарной опасности веществ необходимо, прежде всего, для будущей практической деятельности: для решения вопросов обеспечения безопасности технологических процессов, зданий и сооружений, а также обеспечения пожарной безопасности людей во время пожаров.
Использование знаний о механизмах протекания горения дает возможность управлять горением на пожаре, организовывать профилактические меры против возникновения самовоспламенения, самовозгорания, воспламенения, меры по снижению интенсивности горения на пожаре, его локализации и тушению.
1. Общие указания по выполнению расчетно-графической работы
В соответствие с учебным планом обучающиеся по дисциплине «Теория горения и взрыва» обязаны выполнить расчетно-графическую работу. Расчетно-графическая работа выполняется по индивидуальному заданию.
Вариант задания выбирается по двум последним цифрам номера зачётной книжки (Приложение 1).
При необходимости преподаватель имеет право изменить вариант расчетно-графической работы обучающегося.
Расчетно-графические работы могут быть оформлены как в ученических тетрадях в объеме не более 18 листов рукописного текста, так и на листах формата А-4, в объеме не более 15 листов, компьютерным набором, ориентация книжная.
При выполнении расчетно-графической работы в ученической тетради с полями, содержащей не менее 18 листов, на титульном листе тетради должны быть указаны звание, фамилия, имя, отчество, номер зачётной книжки и номер учебной группы обучающегося. Работа выполняется аккуратно, разборчивым почерком через строчку, графики вычерчиваются при помощи линейки и карандаша. В задании должны быть представлены номер и полный текст задачи.
При выполнении расчетно-графической работы на компьютере необходимо учитывать следующие требования:
— ориентация страниц – книжная;
— на титульном листе указывается министерство, название кафедры, фамилия, инициалы обучающегося, номер учебной группы, номер варианта, должность, фамилия, инициалы преподавателя (приложение 3);
— поля: верхнее – 1 см, левое – 2 см, нижнее – 1 см, правое – 1 см;
— интервал между строками- одинарный;
— красная строка 1,5 см от левой границы текста;
— нумерация по центру листа внизу;
— шрифт Times New Roman, размер шрифта 14;
— работа скрепляется в папку-скоросшиватель.
Задание должно быть оформлено в соответствии со следующей схемой: формулировка задачи, дано, найти, решение, ответ.
При решении задач даются ссылки на использованные справочные данные и соответствующий литературный источник. Литература, используемая в процессе выполнения задания, приводится в конце работы. Список литературы составляется с учетом правил оформления библиографии (Приложение 1).
Выполненная и правильно оформленная расчетно-графическая работа сдается преподавателю. Работа, выполненная не по своему варианту, к зачету не принимается. Такая работа должна быть выполнена повторно.
Правила составления уравнения реакции горения
При решении практически всех задач по дисциплине «Теория горения и взрыва» необходимо составить уравнение реакции горения. Поэтому очень важно научиться делать это правильно. Изучите изложенные ниже правила составления уравнений реакции горения, разберите примеры.
Правило № 1. В левой части уравнения записываем горючее вещество и окислитель [воздух в виде(O2 + 3,76N2)].
Правило № 2.В правой части уравнения записываем продукты реакции горения, учитывая, что:
углерод (С), содержащийся в горючем веществе, превращается в CO2,
сера (S), содержащаяся в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем веществе, превращается в P2O5,
водород (Н), содержащийся в горючем веществе, превращается в H2O,
хлор (Cl), содержащийся в горючем веществе, превращается в HCl,
фтор (F), содержащийся в горючем веществе, превращается в HF,
бром (Br), содержащийся в горючем веществе, превращается в HBr,
йод (I), содержащийся в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем веществе, входит в состав образующихся оксидов (CO2, SO2, H2O) как и кислород воздуха.
азот (N), при температуре горения ниже 2000 о С не вступает в реакцию. Поскольку, в условиях реального пожара температура не превышает значения 1500 – 1600 о С, то принимают, что азот выделяется в свободном виде (N2). Следовательно, 3,76 молей N2 из воздуха переходят в неизменном виде в продукты горения.
Если горючее вещество содержит другие элементы, то они переходят в высшие оксиды.
Правило № 3. Атомы кислорода, входящие в состав молекул горючего вещества (например, C2H6OS — 2-тиолэтанол), участвуют в реакции горения в качестве окислителя, как кислород воздуха.
Правило № 4.Расставляем коэффициенты в схеме реакции горения для того, чтобы в исходных веществах (левая часть уравнения) и получившихся из них продуктах реакции (правая часть уравнения) содержалось одинаковое количество атомов данного вида. При подсчете количества атомов данного вида стехиометрические коэффициенты и индексы, указывающие количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей последовательности действий.
Перед формулой горючего вещества всегда ставится коэффициент 1, так как все расчеты ведут на 1 моль горючего вещества.
Перед формулой углекислого газа ставится коэффициент равный количеству атомов углерода в молекуле горючего вещества.
Уравниваем число атомов элементов, входящих в состав молекул горючего вещества, за исключением Н, О и N.
Уравниваем число атомов водорода, учитывая их содержание в молекулах галогеноуглеводородов и воды.
Уравниваем число атомов кислорода, рассчитав их количество в правой части уравнения и учитывая атомы кислорода, содержащиеся в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой кислорода, переносим в правую часть уравнения и ставим перед 3,76N2. Уравниваем число атомов азота, содержащиеся в молекуле горючего вещества.
Рассмотрим несколько примеров составления реакций горения веществ в воздухе, в которых использованы описанные выше правила.
Пример 1. Составить уравнение реакции горения С6Н4N2О4 в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, азот выделился в свободном виде — N2. Азот, содержащийся в воздухе, также не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав молекулы горючего вещества, за исключением Н и О. В данном случае уравниваем число атомов азота. В состав горючего вещества входят два атома азота. В составе выделившейся молекулы азота тоже два атома, поэтому перед молекулой азота в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. В состав молекулы воды входит только два атома. Следовательно, перед формулой воды ставим коэффициент 2:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 4 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (14 – 4 = 10). Затем делим полученное число на 2 (количество атомов водорода в Н2О) (10/2 = 5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Чтобы убедиться в правильности составленного уравнения реакции горения, рассчитаем количество атомов одних и тех же элементов в его правой и левой частях:
С – слева 6, справа 6 ∙ 1 = 6;
Н – слева 4, справа 2 ∙ 2 = 4;
N – слева: в горючем веществе 2, в воздухе 5∙ 3,76 = 18,8, итого 20,8;
справа 2 + 5∙ 3,76 = 20,8;
О — слева: в горючем веществе 4, в воздухе 5 ∙ 2 = 10, итого 14;
справа: в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 = 2, итого 14.
Вывод: уравнение реакции горения составлено верно.
Пример 2. Составить уравнение реакции горения п-дихлорбензола (С4Н4Сl2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, хлор превратился в хлороводород. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 4, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О, N. В данном случае уравниваем число атомов хлора. В состав горючего вещества входят два атома хлора. В составе выделившейся молекулы хлороводорода один атом Cl, поэтому перед молекулой хлороводорода в продуктах реакции ставим коэффициент 2:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. Из них два атома водорода уже вошли в состав двух молекул хлороводорода. Оставшиеся два атома водорода перейдут в состав молекулы Н2О. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе четырех молекул углекислого газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода. Следовательно, делим количество атомов кислорода в правой части уравнения на 2 (9 /2 = 4,5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 4,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 3. Составить уравнение реакции горения ацетилена (С2Н2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 2, равный количеству атомов углерода в молекуле ацетилена:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае таких элементов нет.
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества — два атома водорода. В состав молекулы воды входит также два атома водорода. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе двух молекул углекислого газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода, следовательно, делим количество атомов кислорода в правой части уравнения на 2 (5/2 = 2,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 2,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 4. Составить уравнение реакции горения C6Н8SО3 в воздухе.
1.В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, сера образовала оксид SO2. Азот воздуха не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае уравниваем число атомов серы. В состав молекулы горючего вещества входит один атом серы. В составе выделившейся молекулы SO2 тоже один атом, поэтому перед молекулой SO2 в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества восемь атомов водорода, а в состав молекулы воды входит только два атома. Следовательно, перед молекулой воды ставим коэффициент 4:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 = 4;
в составе одной молекулы оксида серы: 1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 3 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (18 – 3 = 15). Делим полученное число на 2 (15 /2 = 7,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 7,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Многообразие реакций горения не исчерпывается рассмотренными в данном разделе примерами. Однако, используя описанные правила, можно самостоятельно составить реакцию горения многих других горючих веществ. Написание уравнений реакций горения является важной составной частью при решении многих задач в курсе «Теория горения и взрыва».
Пример решения задач
Задача. Используя данные таблицы, определить показатели пожарной опасности толуола: группу горючести, температуру вспышки; концентрационные пределы распространения пламени (в % и г/м 3 ) при t = 25, 45 и 65 o C, построить график зависимости КПР от температуры; температурные пределы распространения пламени, низшую теплоту сгорания по следствию из закона Гесса; максимальное давление взрыва, тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании. Рассчитать объем воздуха, объем и процентный состав компонентов продуктов горения.
| Начальное давление, Па | Начальная температура, 0 С | Температура взрыва, 0 С. | Масса вещества, кг | Коэффициент избытка воздуха |
| 101 300 | 1,3 |
1. Составляем уравнение реакции горения толуола в воздухе (см. правила составления уравнения реакции горения) и определяем стехиометрический коэффициент β (коэффициент перед кислородом):
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
3. Рассчитываем молярную массу толуола.
М (C7H8) = 12 × 7 + 1 × 8 = 92 (кг/кмоль)
4. Рассчитываем объём воздуха, необходимого для полного сгорания заданной массы толуола.

5. Определяем избыточное количество вещества кислорода и азота.




6. Рассчитываем общее количество вещества продуктов горения.
ånпг = 
ånпг = 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 (кмоль)
7. Определяем общий объём образующихся продуктов горения.

8. Определяем мольный процентный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100%, а количество вещества конкретного продукта реакции за 
Для СО2 получаем следующую пропорцию.
ånпг = 57,74 кмоль – 100%


отсюда
Аналогично находим процентное содержание оставшихся продуктов горения:
При расчете процентного содержания азота суммируем его количество перешедшее в продукты горения в результате реакции и из избытка воздуха.
9. Определяем группу горючести толуола. Для этого рассчитываем его коэффициент горючести по формуле:
где: nC, nS, nH, nN, nO, nCl, nF, nBr— соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К £ 0 – вещество негорючее, 0 2 – вещество является горючим.
Записываем количество атомов составляющих толуол (С7Н8): nC= 7; nH= 8;
Рассчитываем коэффициент горючести:
Вывод: К > 2, следовательно, толуол – горючее вещество.
10. Определяем температуру вспышки. Для этого по справочнику [4] находим температуру кипения толуола:
Определяем температуру вспышки по формуле Элея:

Справочное значение 7 0 С [4].
11. Рассчитываем нижний и верхний концентрационный пределы распространения пламени толуола при стандартных условиях по формуле:


b — число молекул кислорода, необходимое для полного окисления молекулы горючего;
a и b — константы определяемые по табл. 2 приложения 2.
Концентрационные пределы распространения пламени при заданных условиях рассчитываются по формулам:




1550 К и 1110 К — температура горения соответственно на нижнем и верхнем концентрационных пределах распространения пламени.
Рассчитываем КПР при температуре 298 К.
Для расчета 
Для расчета 
Рассчитываем КПР при температуре Т = 273,15 + 45 = 318,15 К.
Рассчитываем КПР при температуре Т = 273,15 + 65 = 338,15 К.
Строим графики зависимостей КПР от температуры.
Из графика делаем вывод, что с увеличением температуры НКПР толуола незначительно уменьшается, ВКПР – сильно возрастает. Изменение ВКПР приблизительно в 10 раз превышает изменение НКПР. Таким образом, с ростом температуры область воспламенения паров толуола расширяется.
12. Рассчитываем концентрационные пределы распространения пламени толуола в граммах на кубометр (j / н или j / в):

Vt – объем занимаемый 1 кмоль газа при заданной температуре и давлении, м 3 /кмоль;
М – молярная масса, кг/кмоль.
Определяем мольный объем паров толуола при заданных температурах:
При Т = 298.15 К
При Т = 318.15 К
При Т = 338.15 К
Рассчитываем КПР паров толуола при заданных температурах:
При Т = 298.15 К 

При Т = 318.15 К 

При Т = 338.15 К 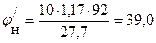

13. Определяем температурные пределы распространения пламени по уравнению Антуана:

tН(В) – нижний (верхний) температурные пределы распространения пламени;

А, В, С – константы, определяемые по таблице 10 Приложения 2.
Определяем давление насыщенного пара на нижнем и верхнем температурных пределах распространения пламени по формуле:
Из табл. 10 приложения 2 находим значения констант А, В и С для толуола:
А = 6,95508, В = 1345,087, С = 219,516
Подставляем значения в уравнение Антуана и определяем температурные пределы распространения пламени:
Справочные значения tн = 6 о С, tв = 37 о С [4].
14. Рассчитываем низшую теплоту сгорания толуола, используя следствие из закона Гесса.
Qн = [S(ni× 

Здесь ni×и 

По уравнению реакции находим, что при сгорании 1 моль толуола выделяется 7 моль углекислого газа и 4 моль воды:


Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения, учитывая при этом, что теплоты образования простых веществ (О2, N2) равны нулю.
Df 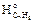
Df 
Df 
Следует иметь в виду, что существует две шкалы тепловых эффектов. В термодинамической шкале экзотермическому процессу соответствует знак минус, эндотермическому – знак плюс. В термохимической шкале знаки изменяются на противоположные. В справочной литературе используется в основном термодинамическая шкала. Однако для расчетов в курсе «Теории горения и взрыва» применяют термохимическую шкалу. Поэтому значения стандартных энтальпий образования веществ нужно подставлять в уравнение с обратным знаком.
Qн = 
15. Рассчитываем максимальное давление взрыва паров толуола при заданных условиях по формуле:
Рн – давление паровоздушной смеси до взрыва, Па;
ТВЗР – температура взрыва, К;
Тн — температура паровоздушной смеси до взрыва, К;
Snпг — число моль продуктов горения, моль;
Sncм — число моль исходной газовоздушной смеси, моль.
По уравнению реакции горения определяем число моль газов в горючей смеси до взрыва и число моль продуктов горения.
Sncм = 
ånп.г= 
Переводим начальную температуру и температуру взрыва из шкалы Цельсия в шкалу Кельвина:
Тн = 273 + 23 = 296 К
ТВЗР = 273 + 2678 = 2951 К
Рассчитываем давление взрыва паров толуола при заданных условиях.
16. Рассчитываем тротиловый эквивалент возможного аварийного взрыва паров толуола при взрыве в технологическом оборудовании по формуле:
QН — низшая теплота сгорания взрывчатого вещества, Дж/кг;
mВВ – масса горючего вещества в смеси, кг;
4520×10 3 – низшая теплота сгорания тринитротолуола (ТНТ, тротил), Дж/кг.
Согласно расчету, проведенному в п.14, низшая теплота сгорания толуола равна Qн = 3773,21 кДж/моль. Переводим ее в кДж/кг, разделив на молярную массу (92∙10 -3 кг/моль):
Рассчитываем тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании:

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

8.1. Реакции горения
Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества. Общее уравнение реакции горения любого углеводорода
Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Тепловой эффект (теплотой сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (около 2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
где r1, r2, …, rn — объемные (молярные, массовые) доли компонентов, входящих в смесь;
Q1, Q2, …, Qn — теплота сгорания компонентов
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
где H2, CO, CH4 и т. д. — содержание отдельных составляющих в газовом топливе, об. %.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м3;
k —константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
где К0 — предэкспоненциальный множитель, принимаемый для биометрических гомогенных смесей, ≈1,0;
Е — энергия активации, кДж/кмоль;
R— универсальная газовая постоянная, Дж/(кг•К);
Т — абсолютная температура, К (°С);
е — основание натуральных логарифмов.
Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры: например, повышение температуры с 500 до 1000 К влечет повышение скорости реакции горения в 2•104÷5•108 раз (в зависимости от энергии активации).
На скорость реакций горения влияет их цепной характер. Первоначально генерируемый реакцией атомы и радикалы вступают в соединения с исходными веществами и между собой, образуя конечные продукты и новые частицы, повторяющие ту же цепь реакций. Нарастающее генерирование таких частиц приводит к «разгону» химических реакций — фактически взрыву всей смеси.
Высокотемпературное горение углеводородов имеет весьма сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. В качестве примера приводятся реакции горения простейшего углеводорода — метана:
📹 Видео
Составление уравнений реакций горения. 11 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Горение. 7 класс.Скачать

Реакции горенияСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Реакция горения гептана. Как уравнять?Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

8 класс. Составление уравнений химических реакций.Скачать

Как уравнивать коэффициенты (химия)Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать