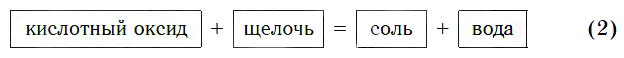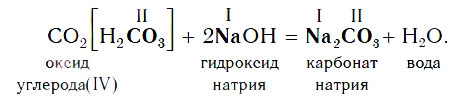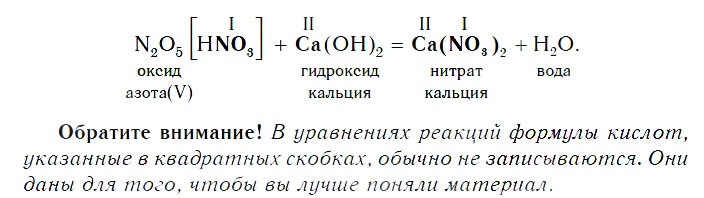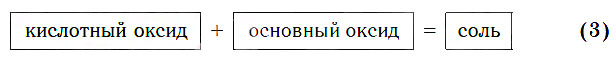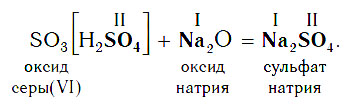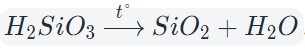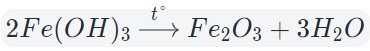методическая разработка по химии (8 класс) на тему
Этот алгоритм поможет легко и просто составить уравнения.
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Урок 32. Химические свойства оксидов
- 1. Химические свойства кислотных оксидов
- 2. Химические свойства основных оксидов
- Оксиды
- Определение оксидов
- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- Химические свойства основных оксидов
- 1. Взаимодействие с водой
- 2. Взаимодействие с кислотными оксидами и кислотами
- 3. Взаимодействие с амфотерными оксидами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 2. Взаимодействие с основными оксидами и щелочами
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- Химические свойства амфотерных оксидов
- 1. Взаимодействие с водой
- 2. Взаимодействие с кислотными оксидами и кислотой
- 3. Взаимодействие с основными оксидами
- 4. Взаимодействие со щелочами
- Получение оксидов
- 1. Окисление металлов
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- 📺 Видео
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Скачать:
| Вложение | Размер |
|---|---|
| kak_sostavit_reakcii_s_oksidami.doc | 157 КБ |
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Предварительный просмотр:
Как составить реакции с оксидами
Реакция 1. Основный оксид + кислотный оксид → соль
Тип реакции – реакция соединения .
Чтобы составить уравнение этой реакции, надо проделать следующие действия:
- Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
- Определить по формуле кислотного оксида химическую формулу соответствующей ему кислоты, формулу кислотного остатка и его валентность.
- Определить по формуле основного оксида валентность металла.
- Составить по валентностям формулу соли.
- Записать уравнение реакции и подобрать в нем коэффициенты.
Пример: Написать уравнение реакции: MgO + N 2 О 5 → .
Действуем по плану:
- Складываем (в уме или на черновике) формулы кислотного оксида и воды:
- Определяем формулу кислотного остатка NO 3 , валентность I (равна количеству Н в кислоте).
- По формуле MgO легко находится валентность магния – II.
- Составляем формулу соли: Mg(NO 3 ) 2
- Записываем, уравнение реакции и подбираем в нем коэффициенты:
MgO + N 2 O 5 → Mg(NО 3 ) 2
Реакция 2. основный оксид + кислота → соль + вода
Тип реакции — реакция обмена .
Составить уравнение этой реакции проще, чем уравнение реакции 1, потому что формула кислоты нам уже известна; зная ее, просто получить и формулу кислотного остатка, и его валентность.
Дальше поступаем так же, как и в предыдущем примере. При составлении уравнения реакции не забудем, что выделяется вода!
Пример: Составьте уравнение реакции между оксидом алюминия и хлороводородной кислотой.
- Вспомним формулу хлороводородной кислоты — НСl, её остаток Сl (хлорид) имеет валентность I.
- По периодической системе Д.И. Менделеева установим, что валентность алюминия III и формула его оксида Аl 2 Оз.
- Составим формулу продукта реакции — соли (хлорида алюминия): АlСlз.
- Запишем уравнение реакции и подберем в нем коэффициенты:
Аl 2 Оз + 6HCl → АlСlз + 3H 2 O
Реакция 3. Кислотный оксид + основание → соль + вода
Тип реакции — реакция обмена .
Для составления уравнения такой реакции следует выполнить действия:
- По формуле кислотного оксида определить формулу его кислоты, формулу кислотного остатка и его валентность (точно так же, как и при составлении реакции 1).
- По формуле гидроксида найти валентность металла: это просто, ведь она равна числу гидроксогрупп (ОН). Если формула гидроксида неизвестна, ее придется составить, используя таблицу растворимости.
- Дальше поступаем, как и в предыдущих примерах: надо составить формулу соли, записать уравнение реакции (не забыть про воду!) и подобрать коэффициенты.
Пример: Составьте уравнение реакции, происходящей при пропускании углекислого газа через известковую воду.
- Вспомним, что углекислый газ — это оксид углерода (IV) СО 2 , а известковой водой называется водный раствор гидроксида кальция Са(ОН) 2 .
- Определим, что оксиду углерода (IV) соответствует угольная кислота Н 2 СО з ; ее кислотный остаток СОз (карбонат) имеет валентность II.
- Не представляет труда вывести формулу продукта реакции — карбоната кальция СаСОз.
- Осталось составить уравнение реакции: СаО + СО 2 → СаСОз.
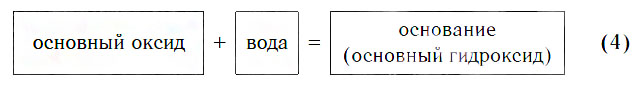
Реакция 4. Основный оксид + вода → основание
Тип реакции — реакция соединения .
Определить идёт ли реакция?
Реакция осуществима, если оксид металла образован элементами из IA и II A групп.
Составить уравнение этой реакции не составит труда, если вы умеете составлять формулы оснований и оксидов.
Пример: Написать уравнение реакции: Н 2 O + Na 2 O → .
Н 2 O + Na 2 O → 2NaOH
Реакция 5. Кислотный оксид + вода → кислота
Тип реакции — реакция соединения .
Определить идёт ли реакция?
Реагируют все оксиды, кроме оксида кремния SiO 2 .
Составление уравнения этой реакции: п о формуле кислотного оксида определить формулу его кислоты, точно так же, как и при составлении реакции 1).
Пример: Написать уравнение реакции: Н 2 O + N 2 О 5 → .
Видео:Как составлять фрмулы оксидовСкачать

По теме: методические разработки, презентации и конспекты
Как выполнить задание вида «составить уравнения возможных реакций» (на примере темы «Свойства оксидов», 8 класс)
Предлагаемая презентация с анимационными эффектами и подсказками может помочь восьмикласснику научиться выполнять задания данного вида при изучении темы «Свойства оксидов». Предназначена для.
Как выполнить задание вида «Составить уравнения возможных реакций (на примере темы «Химические свойства оснований»)
Предлагаемая презентация с помощью анимационных эффектров и «подсказок» поможет восьмиклассникам закрепить умение выполнять задания данного вида при изучении темы «Химические свойства оснований». През.
Тема урока: «Классификация химических реакций. Реакции, идущие без изменения и с изменением состава вещества» в 11 классе.
Цели:Образовательная: продолжить формирование у учащихся понятия о классификации химических реакций в органической и неорганической химии.Развивающая: развитие аналитического и синтетического мышления.
Технологическая карта урока по химии « Типы химических реакций по числу и составу исходных и полученных веществ.»
Технологическая карта урока по химии « Типы химических реакций по числу и составу исходных и полученных веществ.».
Классификация химических реакций (по числу и составу исходных и полученных веществ) (урок изучения и первичного закрепления новых знаний и умений)
Создание условий для репродуктивного усвоения материала, умения сравнивать и анализировать.Организовать деятельность учащихся по изучению классификации химических реакций по количеству исх.
Определение состава смеси, в которой одно из исходных веществ, вступает в реакцию с соответствующим реагентом.
Алгоритм решения задач для обучающихся.
Урок «Классификация химических реакций по числу и составу исходных и полученных веществ»
План урока «Классификация химических реакций» содержит цели и задачи изучаемого материала. Описаны основные этапы и методы учебного процесса.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Урок 32. Химические свойства оксидов
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

2. Химические свойства основных оксидов
а) Взаимодействие с водой
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Оксиды
О чем эта статья:
Видео:Составление формулы оксидов. ПримерСкачать

Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Виды оксидов
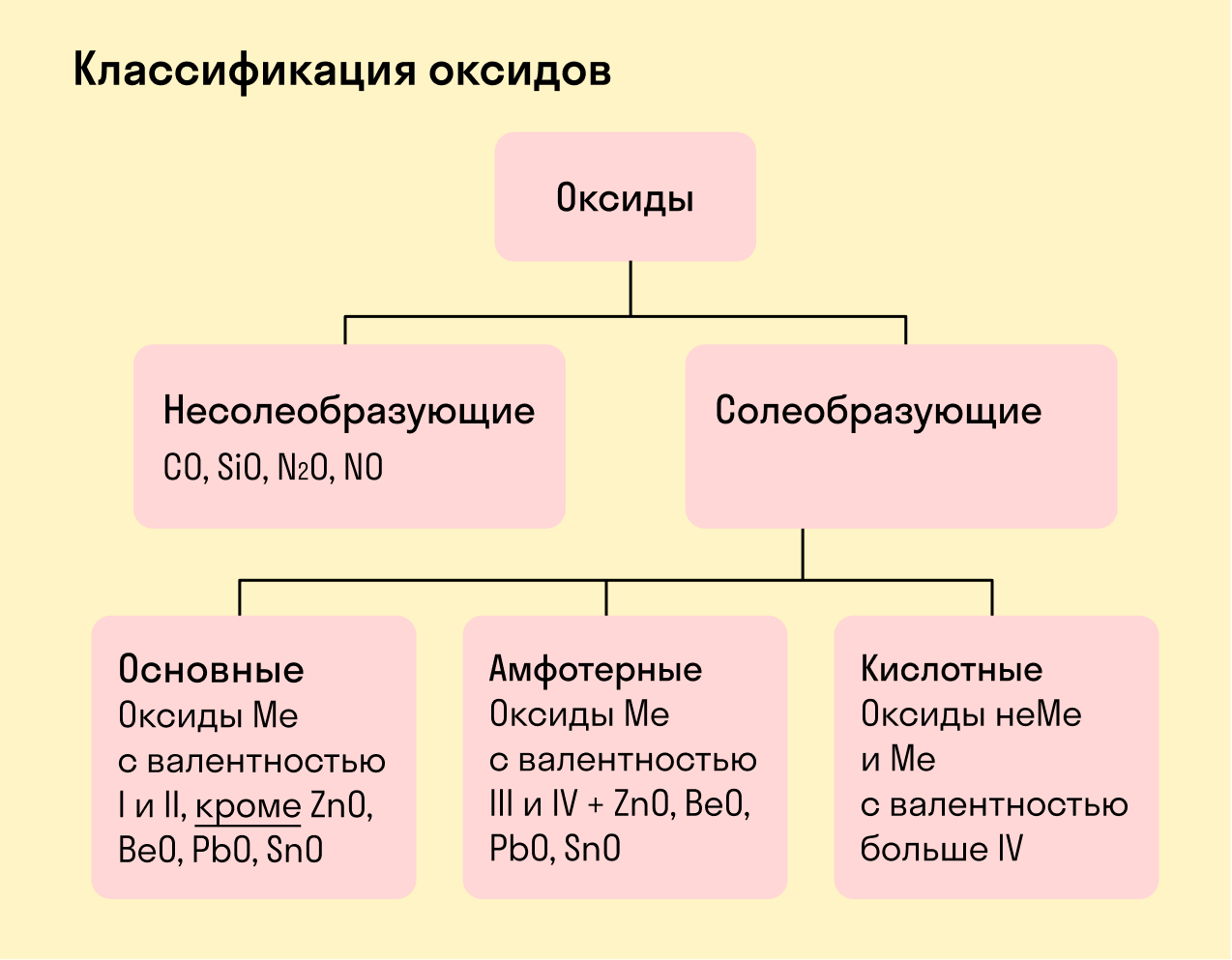
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Номенклатура оксидов
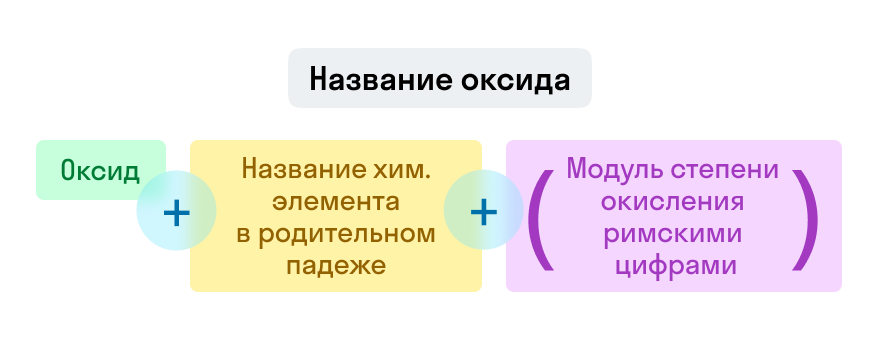
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
📺 Видео
Химия 8 класс (Урок№16 - Свойства, получение, применение оксидов.)Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать