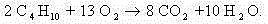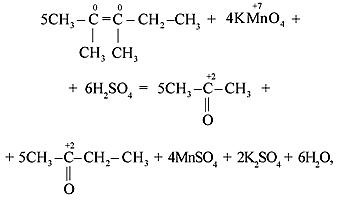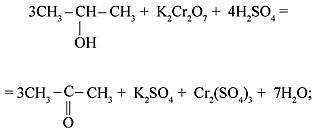Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
2) определение с.о. каждого атома углерода:
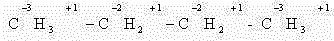
В качестве простейшего примера определим степень окисления углерода в молекуле метанола.
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком « – »), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем: -3 + 1 = -2.Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Уточняем, в каких случаях лучше использовать тот или иной способ.
Процессы окисления, горения, галогенирования, нитрования, дегидрирования, разложения относятся к окислительно-восстановительным процессам. При переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется.
Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы.
Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя, подобно тому, как это присуще неорганическим веществам.
При написании уравнений реакций горения и разложения органических веществ лучше использовать среднее значение с.о. углерода.
Например:
Составим полное уравнение химической реакции методом баланса. Среднее значение степени окисления углерода в н-бутане:
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:
Обратите внимание на первую половину электронного баланса: у атома углерода в дробном значении с.о. знаменатель равен 4, поэтому расчет передачи электронов ведем по этому коэффициенту.
Т.е. переход от -2,5 до +4 соответствует переходу 2,5 + 4 = 6,5 единиц. Т.к. участвует 4 атома углерода, то 6,5 · 4 = 26 электронов будет отдано суммарно атомами углерода бутана.
C учетом найденных коэффициентов уравнение химической реакции горения н-бутана будет выглядеть следующим образом:
Можно воспользоваться методом определения суммарного заряда атомов углерода в молекуле:
(4C)-10 …… → (1C)+4 , учитывая, что количество атомов до знака = и после должно быть одинаково, уравниваем (4C)-10 …… →[(1C)+4] · 4
Следовательно, переход от -10 до +16 связан с потерей 26 электронов. В остальных случаях определяем значения с.о. каждого атома углерода в соединении,обращая при этом внимание на последовательность замещения атомов водорода у первичных, вторичных, третичных атомов углерода:
Вначале протекает процесс замещения у третичных, затем – у вторичных, и, в последнюю очередь – у первичных атомов углерода.
Алкены
Процессы окисления зависят от строения алкена и среды протекания реакции.
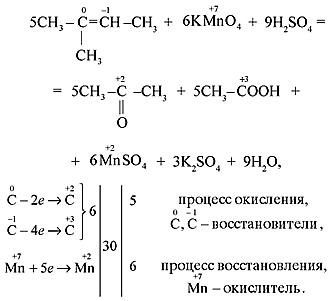
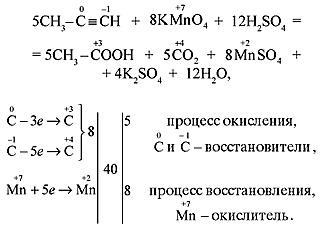
1.При окислении алкенов концентрированным раствором перманганата калия KMnO4 в кислой среде (жесткое окисление) происходит разрыв σ- и π-связей с образованием карбоновых кислот, кетонов и оксида углерода(IV). Эта реакция используется для определения положения двойной связи.
а) Если двойная связь находится на конце молекулы (например, у бутена-1), то одним из продуктов окисления является муравьиная кислота, легко окисляющаяся до углекислого газа и воды:
б) Если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле 2-метилбутена-2), то при его окислении происходит образование кетона, т. к. превращение такого атома в атом карбоксильной группы невозможно без разрыва C–C-связи, относительно устойчивой в этих условиях:
в) Если молекула алкена симметрична и двойная связь содержится в середине молекулы, то при окислении образуется только одна кислота:
Особенностью окисления алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, является образование двух кетонов:
2.В нейтральной или слабощелочной средах окисление сопровождается образованием диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь:
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены (реакция Вагнера).
3. Окисление алкенов в присутствии солей палладия (Вакер-процесс) приводит к образованию альдегидов и кетонов:
2CH2=CH2 + O2 PdCl2/H2O → 2 CH3-CO-H
Гомологи окисляются по менее гидрированному атому углерода:
СH3-CH2-CH=CH2 + 1/2O2 PdCl2/H2O → CH3- CH2-CO-CH3
Алкины
Окисление ацетилена и его гомологов протекает в зависимости от того, в какой среде протекает процесс.
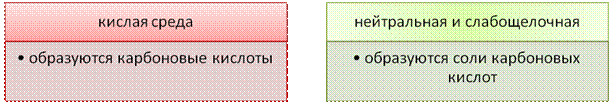
а) В кислой среде процесс окисления сопровождается образованием карбоновых кислот: 
В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот:
Для ацетилена:
1) В кислой среде:
H-C≡C-H KMnO4, H2SO4→ HOOC-COOH (щавелевая кислота)
2) В нейтральной или щелочной среде:
3CH≡CH +8KMnO4 H2O→ 3KOOC-COOK оксалат калия +8MnO2↓+ 2KOH+ 2H2O Арены (бензол и его гомологи)
При окисления аренов в кислой среде следует ожидать образования кислот, а в щелочной – солей.
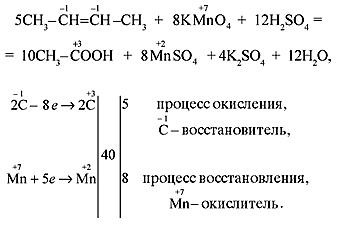
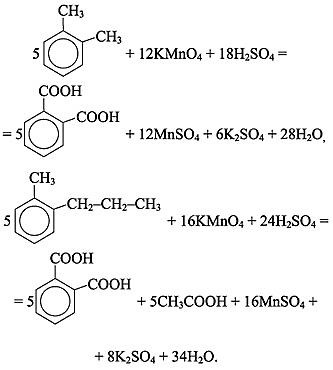
Гомологи бензола с одной боковой цепью (независимо от ее длины) окисляются сильным окислителем до бензойной кислоты по α -углеродному атому. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
а.5C6H5–CH3 + 6KMnO4 + 9H2SO4 = 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O, 5C6H5–б.C2H5 + 12KMnO4 + 18H2SO4 = 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O, в.C6H5–CH3 + 2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O.
Подчеркиваем, что если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
1) В кислой среде:
С6H5-CH2-R KMnO4, H2SO4→ С6H5-COOH бензойная кислота+ CO2↑
2) В нейтральной или щелочной среде:
С6H5-CH2-R KMnO4, H2O/(OH)→ С6H5-COOK + CO2↑
3) Окисление гомологов бензола перманганатом калия или бихроматом калия при нагревании:
С6H5-CH2-R KMnO4, H2SO4, t˚C→ С6H5-COOHбензойная кислота+ R-COOH
4) Окисление кумола кислородом в присутствии катализатора (кумольный способ получения фенола):
C6H5CH(CH3)2 (O2, H2SO)→ C6H5-OH фенол + CH3-CO-CH3 ацетон
5C6H5CH(CH3)2 + 18KMnO4 + 27H2SO4 → 5C6H5COOH + 42H2O + 18MnSO4 + 10CO2 + K2SO4
C6H5CH(CH3)2 + 6H2O – 18ē → C6H5COOH + 2CO2 + 18H+ | x 5
MnO4- + 8H+ + 5ē → Mn+2 + 4H2O | x 18
Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв π -связи ,образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
Окисление же сильным окислителем – перманганатом калия в кислой среде – приводит к полному разрыву двойной связи и образованию углекислого газа и бензойной кислоты, раствор при этом обесцвечивается.
C6H5−CH═CH2 + 2 KMnO4 + 3 H2SO4 → C6H5−COOH + CO2 ↑ + K2SO4 + 2 MnSO4 +4 H2O
Спирты
Следует помнить, что:
1) первичные спирты окисляются до альдегидов:
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O;
2) вторичные спирты окисляются до кетонов:
3) для третичных спиртов реакция окисления не характерна.
Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.
- Обобщенные уравнения реакций горения органических веществ
- Выберите документ из архива для просмотра:
- Дистанционное обучение как современный формат преподавания
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Окислительно-восстановительные реакции в органической химии
- Определение степени окисления атомов в органических веществах
- Окисление и восстановление органических веществ
- Составление окислительно – восстановительных уравнений
- 📽️ Видео
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Обобщенные уравнения реакций горения органических веществ
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Выберите документ из архива для просмотра:
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 939 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 23 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Реакции горенияСкачать

Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 589 820 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 24.09.2020
- 279
- 5
- 24.09.2020
- 135
- 8
- 24.09.2020
- 133
- 3
- 24.09.2020
- 121
- 3
- 24.09.2020
- 85
- 0
- 24.09.2020
- 342
- 7
- 24.09.2020
- 346
- 10
- 23.09.2020
- 109
- 4
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 24.09.2020 317
- RAR 66.2 кбайт
- 48 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Коровицкий Сергей Александрович. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 10 месяцев
- Подписчики: 7
- Всего просмотров: 5742
- Всего материалов: 14
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Уравнивание реакций горения углеводородовСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
В Швеции запретят использовать мобильные телефоны на уроках
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Студенты российских вузов смогут получить 1 млн рублей на создание стартапов
Время чтения: 3 минуты
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Только 23 февраля!
Получите новую
специальность
по низкой цене
Цена от 1220 740 руб. Промокод на скидку Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Окислительно-восстановительные реакции в органической химии
Разделы: Химия
Окислительно-восстановительные процессы издавна интересовали химиков и даже алхимиков. Среди химических реакций, происходящих в природе, быту и технике, огромное множество составляют окислительно-восстановительные: сгорание топлива, окисление питательных веществ, тканевое дыхание, фотосинтез, порча пищевых продуктов и т.д. В таких реакциях могут участвовать как неорганические вещества, так и органические. Однако если в школьном курсе неорганической химии разделы, посвященные окислительно-восстановительным реакциям, занимают значительное место, то в курсе органической химии на этот вопрос обращено недостаточно внимания.
Что же представляют собой восстановительно-окислительные процессы?
Все химические реакции можно разделить на два типа. К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
С современной точки зрения изменение степени окисления связано с оттягиванием или перемещением электронов. Поэтому наряду с приведенным можно дать и такое определение восстановительно-окислительных реакций: это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом, молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
4. Окисление всегда сопровождается восстановлением; восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединения электронов.
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
Нам представляется важным указывать значение СО атома углерода при изучении всей совокупности свойств органических соединений. Систематизация сведений об окислителях, установление связи между строением органических веществ и их СО помогут научить учащихся [1, 2]:
— Выбирать лабораторные и промышленные окислители;
Находить зависимость окислительно-восстановительной способности органического вещества от его строения;
— Устанавливать связь между классом органических веществ и окислителем нужной силы, агрегатного состояния и механизма действия;
— Предсказывать условия проведения реакции и ожидаемые продукты окисления.
Определение степени окисления атомов в органических веществах
Степень окисления любого атома углерода в органическом веществе равна алгебраической сумме всех его связей с более электроотрицательных элементов (Cl, O, S,N, и др.), учитываемых со знаком «+», и связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с соседними атомами углерода не учитываются [1].
Определим степени окисления атомов углерода в молекулах предельного углеводорода пропана и спирта этанола:
Последовательное окисление органических веществ можно представить в виде следующей цепочки превращений:
Насыщенный углеводород 






Генетическая связь между классами органических соединений представляется здесь как ряд окислительно–восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей классов органических соединений.
Изменение СО у атомов углерода в молекуле углерода в молекулах органических соединений приведены в таблице. Из данных таблицы видно, что при переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется. Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы. Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя, подобно тому, как это присуще неорганическим веществам.
Окисление и восстановление органических веществ
Повышенная склонность органических соединений к окислению обусловлена наличием в молекуле веществ [1, 2]:
- кратных связей (именно поэтому так легко окисляются алкены, алканы, алкадиены);
- определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и спиртовой), аминной — NH
;
- активированных алкильных групп, расположенных по соседству с кратными связям, например пропен может быть окислен до непредельного альдегида акролеина (кислородом воздуха в присутствии водяных паров на висмут- молибденовых катализаторах):
- атомов водорода при атоме углерода, содержащем функциональную группу.
Сравним первичные, вторичные и третичные спирты по реакционной способности к окислению:
Первичные и вторичные спирты, имеющие атомы водорода при атоме углерода, несущем функциональную группу; окисляются легко: первые – до альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.
Существуют два подхода к определению степеней окисления элементов в органических веществах.
1. Вычисляют среднюю степень окисления атома углерода в молекуле органического соединения, например пропана.
Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
Отметим, что формально дробные степени окисления, вычисленные таким образом, могут быть и в случае неорганических веществ. Например, в соединении КО
2. Определяют степень окисления каждого атома углерода, например в бутане.
В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+», и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления углерода в молекуле метанола.
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком « — »), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем:
Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Рассмотрим цепочку превращений веществ:
При каталитическом дегидрировании этана получается этилен; продукт гидратации этилена – этанол; его окисление приведет к этаналю, а затем – к уксусной кислоте; при ее сгорании образуется углекислый газ и вода.
Определим степени окисления каждого атома углерода в молекулах перечисленных веществ.
Можно заметить, что в ходе каждого из этих превращений постоянно меняется степень окисления одного из атомов углерода. В направлении от этана к оксиду углерода (IV) происходит увеличение степени окисления атома углерода.
Несмотря на то, что в ходе любых окислительно-восстановительных реакций происходит как окисление, так и восстановление, их классифицируют в зависимости оттого, что происходит непосредственно с органическим соединением (если оно окисляется, говорят о процессе окисления, если восстанавливается – о процессе восстановления).
Так, в реакции этанола с перманганатом калия этанол будет окисляться, а перманганат калия – восстанавливается. Реакцию называют окислением этанола.
Составление окислительно – восстановительных уравнений
Для составления уравнений окислительно- восстановительных реакций используют как метод электронного баланса, так и метод полуреакций (электронно — ионный метод). Рассмотрим несколько примеров окислительно- восстановительных реакций с участием органических веществ 3.
1. Горение н-бутана.
Схема реакции имеет вид:
Составим полное уравнение химической реакции методом баланса.
Среднее значение степени окисления углерода в н-бутане:
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:
C учетом найденных коэффициентов уравнение химической реакции горения н-бутана будет выглядеть следующим образом:
Коэффициенты для этого уравнения можно найти и другим методом, о котором уже упоминалось. Рассчитав степени окисления каждого из атомов углерода, видим, что они различаются:
В этом случае схема электронного баланса будет выглядеть так:
Так как в ходе горения н-бутана в его молекулах разрушаются все химические связи, то в данном случае первый подход вполне оправдан, тем более что схема электронного баланса, составленная вторым способом, несколько сложнее.
2. Реакция окисления этилена раствором перманганата калия в нейтральной среде на холоду (реакция Вагнера).
Расставим коэффициенты в уравнении реакции методом электронного баланса.
Полное уравнение химической реакции будет выглядеть так:
Для определения коэффициентов можно воспользоваться и методом полуреакций. Этилен окисляется в этой реакции до этиленгликоля, а перманганат – ионы восстанавливаются с образованием диоксида марганца.
Схемы соответствующих полуреакций:
Суммарное электронно-ионное уравнение:
3. Реакции окисления глюкозы перманганата калия в кислой среде.
А. Метод электронного баланса.
Рассчитаем степени окисления каждого из атомов углерода в молекуле глюкозы:
Схема электронного баланса усложняется по сравнению с предыдущими примерами:
Б. Метод полуреакций в данном случае выглядит следующим образом:
Суммарное ионное уравнение:
Молекулярное уравнение реакции глюкозы перманганататом калия:
В органической химии целесообразно использовать определение окисления как увеличение содержания кислорода или уменьшение содержания водорода [4]. Восстановление в таком случае определяется как уменьшение содержания кислорода или увеличение содержания водорода. При таком определении последовательное окисление органических веществ можно представить следующей схемой:
Практика показывает, что подбор коэффициентов в реакциях окисления органических веществ вызывает определенные затруднения, так как приходится иметь дело с весьма непривычными степенями окисления.[4]. Некоторые учащиеся из-за отсутствия опыта продолжают отождествлять степень окисления с валентностью и, вследствие этого, неправильно определяют степень окисления углерода в органических соединениях. Валентность углерода в этих соединениях всегда равна четырем, а степень окисления может принимать различные значения (от -3 до +4, в том числе дробные значения). Непривычным моментом при окислении органических веществ является нулевая степень окисления атома углерода в некоторых сложных соединениях. Если преодолеть психологический барьер, составление таких уравнений не представляет сложности, например:
Степень окисления атома углерода в сахарозе равна нулю. Переписываем схему реакции с указанием степеней окисления атомов, которые их меняют:
Составляем электронные уравнения и находим коэффициенты при окислителе и восстановителе и продуктах их окисления и восстановления:
Подставим полученные коэффициенты в схему реакции:
Оставшиеся коэффициенты подбираем в такой последовательности: K




Многие вузы включают в билеты для вступительных экзаменов задания по подбору коэффициентов в уравнениях ОВР электронным методом(методом полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то, в основном при окислении неорганических веществ. Попробуем применить метод полуреакций для выше приведенного примера окисления сахарозы перманганатом калия в кислой среде.
Первое преимущество этого метода заключается в том, что нет необходимости сразу угадывать и записывать продукты реакции. Они достаточно легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно проявляет свои окислительные свойства, например, анион MnO


Запишем в молекулярном виде превращения сахарозы:
В левой части не хватает 13 атомов кислорода, чтобы устранить это противоречие, прибавим 13 молекул H
Левая часть теперь содержит 48 атомов водорода, они выделяются в виде катионов Н
Теперь уравняем суммарные заряды справа и слева:
Схема полуреакций готова. Составление схемы второй полуреакции обычно не вызывает затруднений:
Объединим обе схемы:
Сократив обе части уравнения на 65 H

Упражнения. Расставьте коэффициенты методом электронного баланса в уравнениях реакций:
б) С




в) СН






г) С











д) СН





Упражнения. Расставьте коэффициенты методом электронного баланса:
а) С













12MnO












5С













в) C














г) CH











д) СН






1. Матч Дж. Органическая химия. Реакции, механизмы и структура: В 4т./ Пер. с англ.- М.: Мир, 1987-1988.
2. Карцова А.А, Левкин А. Н. Окислительно-восстановительные реакции в органической химии // Химия в школе. — 2004. — №2. – С.55-61.
3. Хомченко Г.П., Савостьянова К.И. Окислительно-восстановительные реакции: Пособие для учащихся . М.- : Просвещение , 1980.
4. Шарафутдинов В. Окислительно-восстановительные реакции в органической химии // Башкортостан уkытыусыhы. — 2002. — №5. – С.79 -81.
📽️ Видео
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Реакция горения гептана. Как уравнять?Скачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

8 класс. Составление уравнений химических реакций.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Горение. 7 класс.Скачать

КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Составление формул органических соединений по названиюСкачать