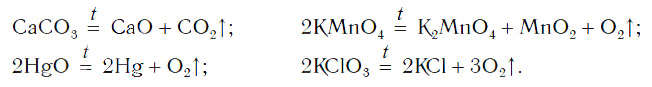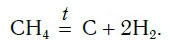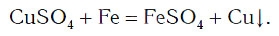В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Видео:Реакции замещенияСкачать

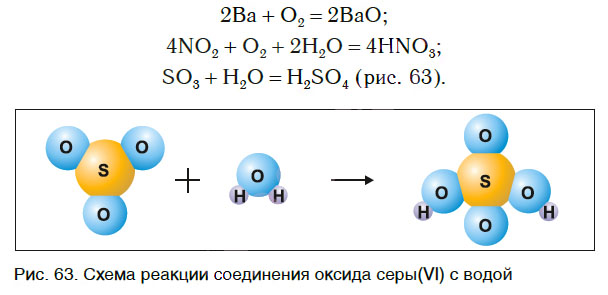
Реакции соединения
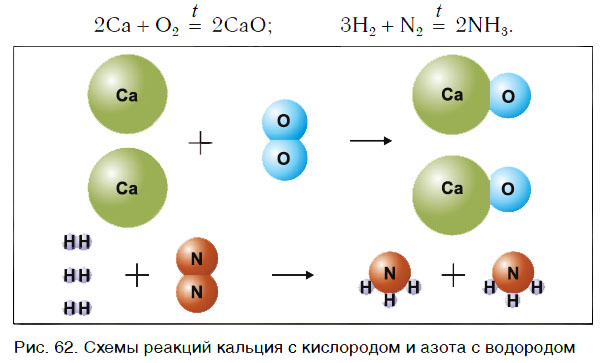
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
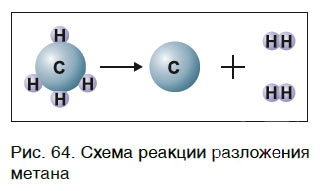
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции замещения
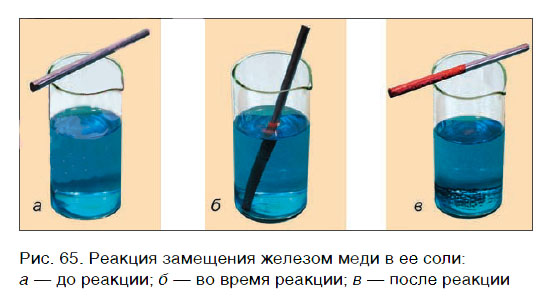
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Реакция замещения
Разделы: Химия
Тип урока: изучение новых знаний.
Вид урока: лабораторная работа.
Обучающие:
- изучить понятие «реакция замещения», его сущность;
- научить учащихся писать уравнения реакций замещения;
- формировать умение предсказывать продукты реакций замещения;
- дать первоначальное понятие об электрохимическом ряде напряжений металлов.
Развивающие:
- развивать умение ставить несложную проблему, формулировать гипотезу и проводить её опытную проверку, опираясь на знания химии;
- совершенствовать умения работать с лабораторным оборудованием и реактивами;
- продолжить формирование умения оформлять результаты учебного эксперимента;
- развивать способность к адекватному само- и взаимоконтролю.
Воспитательные:
- продолжить формирование научного мировоззрения учащихся;
- воспитывать культуру общения через работу в парах «ученик-ученик», «учитель-ученик»;
- воспитывать у учащихся такие качества личности, как наблюдательность, внимание, пытливость, инициатива.
Методы и методические приёмы:
- лабораторная работа;
- фронтальный опрос;
- самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок;
- работа со средствами наглядности: Периодической системой химических элементов Д.И.Менделеева, карточками.
Оснащение урока:
- кодоскоп;
- карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения»;
- карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ».
Оборудование и реактивы:
- лабораторный штатив с пробирками,
- кристаллизатор,
- прибор для получения водорода,
- лучинка,
- спички;
- цинк и магний в гранулах,
- железный гвоздь,
- медная проволока,
- растворы соляной кислоты,
- хлорида меди (II),
- хлорида железа (III).
I. Вхождение в урок.
Учитель: Здравствуйте, ребята! Вот мы и снова встретились в кабинете химии. А какое у вас сегодня настроение? (Используется приём «Мордашки»). Запишите сегодняшнее число; тему урока и нарисуйте мордашку, характеризующую ваше настроение.
Учитель: Поднимите руки, у кого хорошее настроение; среднее настроение; плохое настроение. (Это количество будет необходимо на завершающей стадии урока). Думаю, что сегодняшний урок вам понравится, вы узнаете много нового, и вам не будет скучно, потому что сегодня вы будете сами проводить опыты. Но для начала проверим, как вы усвоили материал, изученный на прошлом уроке.
II. Актуализация знаний.
Фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (1аб; 2г с. 100)
Учитель: На прошлом уроке вы познакомились ещё с одной классификацией химических реакций. По каким признакам мы классифицировали реакции в прошлый раз?
Ученик: Мы классифицировали реакции по количеству вступивших и образовавшихся веществ и по их составу.
Учитель: С какими типами реакций вы познакомились?
Ученик: С реакциями разложения и соединения.
Учитель: Дайте определение реакции разложения.
Ученик: Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель: Какая реакция называется реакцией соединения?
Ученик: Реакцией соединения называется реакция, в результате которой из двух и более простых или сложных веществ образуется одно сложное вещество.
Учитель: Скажите, пожалуйста, для чего в схемах химических реакций мы расставляли коэффициенты?
Ученик: Для того чтобы соблюдался закон сохранения массы веществ.
Учитель: Давайте проверим, как это получилось у ваших товарищей (идёт проверка домашних упражнений, ученики задают дополнительные вопросы отвечающим, выставляются оценки).
Задание 1а, б с.100
Запишите в виде химических уравнений следующие предложения: а) «При обжиге карбоната кальция образуется оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой образуется фосфорная кислота». Каков тип указанных реакций? Какая из них будет экзо- , а какая эндотермической?
Решение
- СаСО3 -> СаО + СО2 — реакция разложения, эндотермическая
- Р2О5 + 3Н2О ->2Н3РО4 — реакция соединения, экзотермическая
Задание 2г с.100
Составьте уравнение по следующей схеме и укажите тип реакции:
- СuOH -> Cu2O + H2O.
Под формулами веществ напишите их названия.
Учитель: Теперь каждому предлагается выполнить задание расставить коэффициенты в схемах химических реакций.
III. Самостоятельная работа (8-10 минут).
Задание: Расставьте коэффициенты, укажите тип химических реакций.
Вариант I Вариант II 1. MgO + CO2 -> MgCO3 1. KNO3 -> KNO2 + O2 2. NO2 + O2 + H2O -> HNO3 2. SO2 + O2 -> SO3 3. Na2O + H2O -> NaOH 3. SO3 + H2O -> H2SO4 4. KClO3 -> KCl + O2 4. K2O + H2O -> KOH 5. CO + O2 -> CO2 5. NO + O2 -> NO2
Учитель: Ребята, поднимите руку, кто выполнил работу на «5»? на «4»? Итак, сегодня вы познакомитесь ещё с одним типом химических реакций — реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться в результате реакций замещения, и потренируетесь в расстановке коэффициентов.
IV. Изучение нового материала.
Учитель: Итак, реакция замещения. Какие ассоциации вызывает у вас название этого типа реакций? (Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим).
Учитель: Каким по составу должно быть вещество, которое замещает — простым или сложным?
Учитель: Тогда каков должен быть состав вещества, в котором происходит замещение?
Ученик: Это вещество должно быть сложным, чтобы атомы одного элемента можно было заместить, а атомы других элементов остались.
Учитель: Давайте обозначим простое вещество А, сложное вещество ВС. Как в этом случае можно записать общую схему реакции замещения? (ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу, которую начали заполнять на прошлом уроке).
Таблица «Классификация реакций на основании количества и состава реагирующих веществ»
| Тип реакции | Уравнение реакции в общем виде. | |
Количество и состав веществ
соединения
разложения
Учитель: Значит, реакцией разложения называется реакция, в которой участвует одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуется новое простое и новое сложное вещество. (запись определения в тетрадь).
Учитель: Но гипотеза, это только наше предположение, давайте подтвердим её практически или опровергнем. Для этого проведём лабораторную работу. (Учащиеся получают карточки с таблицей для составления отчёта по лабораторной работе «Реакции замещения»). В таблице заполнена первая графа, дающая представление о том, что нужно сделать. Вторую и третью графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспоминаем, что работать с растворами кислот нужно осторожно, так как они опасны. С растворами нужно работать по принципу «Не разлей», с твёрдыми веществами — по принципу «Не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта №1.(учащиеся выполняют работы, пользуясь текстом учебника).
Фронтальная беседа (обсуждение результатов опыта).
Учитель: Можем ли мы сказать, что произошла химическая реакция?
Ученик: Да, так как выделился газ.
Учитель: Давайте составим уравнение этой химической реакции и предположим, какие вещества образовались в результате этой химической реакции. (учитель у доски объясняет принцип составления уравнений реакций такого типа и просит ребят расставить коэффициенты).
Учитель: По уравнению химической реакции видно, что получился газ водород, но как доказать это практически. Открою вам маленький секрет — вы сейчас прошли тем самым путём, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории. Но водород ещё нужно было собрать. Догадайтесь, как собрать водород в другую пробирку.
Ученик: Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку?
Учитель: Что находится в пустой пробирке?
Учитель: Посмотрите в таблицу Менделеева, найдите относительную молекулярную массу водорода и скажите, что будет легче: водород или воздух?
Ученик: Водород, потому что его относительная молекулярная масса равна двум.
Учитель: В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ называется способом вытеснения воздуха.
Давайте посмотрим, как получил и собрал водород Генри Кавендиш, а также каким образом он определил, что это именно водород. (демонстрационный опыт).
Учитель: Теперь приступайте к выполнению следующего опыта. (смотреть текст учебника).
Фронтальная беседа (обсуждение результатов опыта).
Учитель: Можем ли мы сказать, что произошла химическая реакция?
Ученик: Да, так как выделился газ.
Учитель: Предположите, какой газ выделился в результате этой химической реакции?
Ученик: Водород, так как магний замещает атомы водорода в соляной кислоте.
Учитель: Самостоятельно составьте уравнение этой химической реакции и расставьте в нём коэффициенты (проверка через кодоскоп).
Учитель: Сравните скорость взаимодействия магния и цинка с соляной кислотой.
Оказывается, что скорость взаимодействия металла с кислотой зависит от активности металла. Активность металлов определена, и все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов.
Учитель: Посмотрите внимательно, какой неметалл занесён в этот ряд?
Учитель: Оказывается, что металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Сможет ли медь вытеснить водород из раствора соляной кислоты?
Ученик: Нет, так как медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель: (Демонстрация опытов и подтверждение выдвинутой гипотезы). Мы с вами можем сделать вывод, что электрохимический ряд напряжений металлов позволяет предсказывать не только продукты реакций, но и возможна ли данная реакция или нет.
Учитель: А теперь приступайте к выполнению опытов № 3,4. (смотреть текст учебника).
Фронтальная беседа (обсуждение результатов опыта):
Учитель: Что вы увидели при проведении этих опытов?
Ученик: Первая реакция произошла, так как гвоздь покрылся красным налётом, а вторая — нет, так как никаких изменений не произошло.
Учитель: Почему невозможна вторая реакция?
Ученик: Так как медь в электрохимическом ряду напряжений металлов находится после железа, значит, она менее активна и не может его вытеснить.
Учитель: Запишите уравнение взаимодействия железа с хлоридом меди (II). (Результаты работы проверяются с помощью кодоскопа).
Итак, сегодня вы познакомились ещё с одним типом химических реакций — реакцией замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнение.
Учитель: На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие — нет. Почему? (Спрашивать по одному ученику на каждое уравнение).
Учитель: Расставьте коэффициенты в схемах возможных химических реакций. (Класс работает самостоятельно, к доске вызываются два ученика для расстановки коэффициентов, затем идёт проверка результатов работы).
VI. Заключительная часть.
Давайте ещё раз выясним, у кого какое настроение — нарисуйте мордашку, характеризующую ваше настроение. (Далее — обратная связь и анализ полученных результатов).
Домашнее задание. Параграф 27, упр. 2а, 3в (с. 100).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакция замещения в химии — как определить, признаки, примеры уравнений
Перераспределение электронов и ядер, при котором образуется новое вещество, называется химической реакцией. Это физико-химическое взаимодействие, приводящее к образованию нового соединения. Если атомы простого реагента занимают места химических элементов в сложном, то этот процесс называют реакцией замещения. При этом может образовываться не одно, а сразу два вещества.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Видео:Алкены. Реакции окисления | Органическая химия| ХИМИЯ ЕГЭ 2024Скачать

Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
🎬 Видео
Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЯ 8 класс : Реакции замещенияСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. Составление уравнений химических реакций.Скачать

Уравнивание реакций горения углеводородовСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Типы химических реакций. 2 часть. 8 класс.Скачать