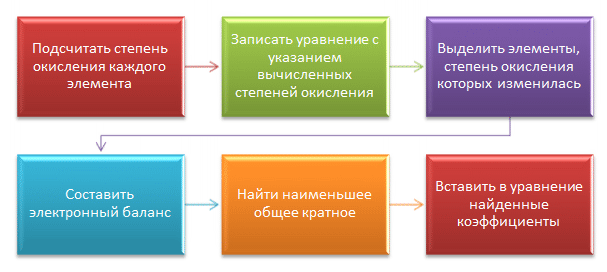
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Метод электронного баланса в доступном изложении
Задача.
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
Применение метода электронного баланса по шагам. Пример «а»
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag 0 + H +1 N +5 O -2 3 → Ag +1 N +5 O -2 3 + N +2 O -2 + H +1 2O -2
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Пример «б»
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca 0 +H +1 2S +6 O -2 4 → Ca +2 S +6 O -2 4 + H +1 2S -2 + H +1 2O -2
Ca 0 — 2e = Ca +2 (коэффициент 4)
S +6 + 8e = S -2
Пример «в»
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
Be 0 + H +1 N +5 O -2 3 → Be +2 (N +5 O -2 3)2 + N +2 O -2 + H +1 2O -2
Be 0 — 2e = Be +2 (коэффициент 3)
N +5 +3e = N +2 (коэффициент 2)
Видео:Как расставлять коэффициенты в химических реакциях | ОВР | Метод электронного баланса, Химия ЕГЭ, ЦТСкачать

Метод электронного баланса
Составляя любое уравнение химической реакции, следует соблюдать закон сохранения масс веществ — кол-во атомов в исходных веществах (левая часть уравнения) и в продуктах реакции (правая часть уравнения) должны совпадать.
Составляя уравнения окислительно-восстановительных реакций, следует также следить за суммой зарядов, которые у исходных веществ и в продуктах реакции должны быть равны.
В уравнениях ОВР в левой части обычно указывают первым вещество-восстановитель (отдает электроны), а затем — вещество-окислитель (принимает электроны); в правой части уравнения первым указывают продукт окисления, затем восстановления, а потом другие вещества, если они имеются.
Главное требование, которое необходимо соблюдать при составлении уравнений окислительно-восстановительных реакций, — кол-во электронов, которое отдал восстановитель, должно быть равно кол-ву электронов, принятых окислителем.
В основе метода электронного баланса лежит сравнение степеней окисления в исходных веществах и продуктах реакции, что подразумевает тот факт, что, составляющий уравнение ОВР методом электронного баланса, должен знать, какие вещества образуются в ходе реакции.
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al 0 +C 0 → Al4 +3 C3 -4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al 0 → Al +3
1Al 0 -3e — → 1Al +3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C 0 → C +4
1C 0 +4e — → 1C -4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом — в схему реакции алюминия:
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al 0 =4Al 0 - Кол-во атомов углерода, вступающих в реакцию:
3·1C 0 =3C 0 - Окончательный вид уравнения:
4Al 0 +3C 0 = Al4 +3 C3 -4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN +5 O3+I2 0 → HI +5 O3+N +2 O+H2O - Азот меняет степень окисления с +5 на +2 — принимает 3 электрона, и является окислителем:
N +5 → N +2
N +5 +3e — → N +2 - Йод меняет степень окисления с 0 на +5 — отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 0 → 2I +5
I2 0 -10e — → 2I +5 - Уравниваем заряды:
- Было до реакции 10·1N +5 =10N +5 , после реакции образовалось: 10·1N +2 =10N +2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I +5 =6I +5 ;
- Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl -1 +Mn +4 O2 → Cl2 0 +Mn +2 Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца — окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl -1 → Cl2 0
2Cl — -2e — → Cl2 0 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn +4 → Mn +2
Mn +4 +2e — → Mn +2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой — 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 — теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H + +4Cl — +MnO2 = Cl2+Mn 2+ +2Cl — +2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S -2 +KMn +7 O4+H2SO4 → S 0 +Mn +2 SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород — восстановитель):
S -2 → S 0
S -2 -2e — → S 0 - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат — окислитель):
Mn +7 → Mn +2
Mn +7 +5e — → Mn +2 - Электронные уравнения:
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4 — +6H + = 5S+2Mn 2+ +8H2O
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
💡 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Задание 20. ОВР и метод электронного баланса - пойми, как это работает | Химия ОГЭ 2023Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Как расставить коэффициенты реакции методом электронного балансаСкачать

Проклятая химическая реакция 😜 #shortsСкачать