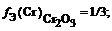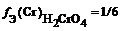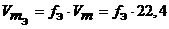Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н + или ОН – , в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н + (кислота проявляет основность 2). Тогда по определению эквивалентом H 3 PO 4 будет являться условная частица 1/2 H 3 PO 4, т.к. если одна молекула H 3 PO 4 предоставляет два иона Н + , то один ион Н + дает половина молекулы H 3 PO 4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН – , следовательно, один ион ОН – потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Частица
Фактор эквивалентности
Примеры
Элемент
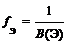
где В(Э) – валентность элемента
Простое вещество
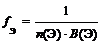
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
f Э (O3) = 1/(3 × 2) = 1/6
Оксид
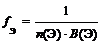
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
Кислота
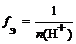
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
Основание
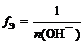
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
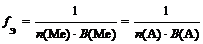
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
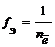
где 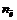
Fe 2+ + 2 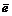
MnO4 – + 8H + + 5 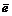
f Э ( MnO 4 – ) = 1/5
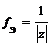
где z – заряд иона
f Э ( SO 4 2– ) = 1/2
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
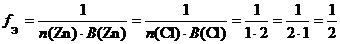
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
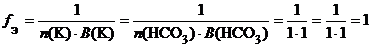
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
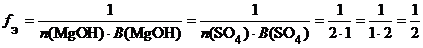
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М × f Э.
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей , например:
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( 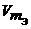
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
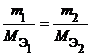
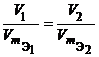
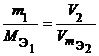
где m 1 и m 2 – массы реагентов и (или) продуктов реакции , г ;
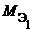
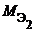
V 1, V 2 – объемы реагентов и (или) продуктов реакции , л ;
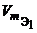
- Эквивалент. Закон эквивалентов
- Эквивалент. Закон эквивалентов
- Эквивалент в кислотно-основных реакциях
- Эквивалент в окислительно-восстановительных реакциях
- Примеры решения задач
- Как правильно рассчитывать фактор эквивалентности элементов и веществ
- Фактор эквивалентности хрома в соединениях
- Определение фактора эквивалентности оксидов. кислот, оснований и солей
- Определение числа молей и числа эквивалентов в гидроксие титана (III)
- Определение объема эквивалентов хлора
- 📽️ Видео
Видео:Фактор эквивалентностиСкачать

Эквивалент. Закон эквивалентов
Материалы портала onx.distant.ru
Видео:Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать

Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO4 2- , например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Видео:132. Фактор эквивалентности. Число эквивалентности.Скачать

Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Видео:133. Эквивалент. Молярная масса эквивалента.Скачать

Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Видео:Расчет молярной массы эквивалентовСкачать

Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

Как правильно рассчитывать фактор эквивалентности элементов и веществ
Видео:Химический эквивалент и фактор эквивалентности в ОВРСкачать

Фактор эквивалентности хрома в соединениях
Задача 232.
Определите эквивалент хрома в следующих соединениях: Cr2O3; CrO3.
Решение:
Эквмвалент = fЭ — фактор эквивалентности элемента (число, показывающее, какая часть молекулы или другой частицы вещества соответствует одному эквиваленту). Эквивалент элемента в оксиде определяется по формуле:
B(Э) — валентность хрома.
Определение фактора эквивалентности оксидов. кислот, оснований и солей
Задача 233.
Определите химические эквиваленты и молярные массы эквивалентов следующих веществ: В2О3; NaOH; H2SO3; NaAl(SO4)2.
Решение:
Молярная масса эквивалента вещества (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М . fЭ, где
М — молярная масса вещества.
а) В2О3
Фактор эквивалентности оксида рассчитывается по формуле:
fЭ = 1/[(nЭ) . B(Э)], где
n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента.
fЭ(B2O3) = 1/(2 . 3) = 1/6, поэтому эквивалентом B2O3 является частица 1/2B2O3.
Зная фактор эквивалентности оксида бора, рассчитаем молярну массу эквивалента данного оксида1, получим:
МЭ(B2O3) = М(B2O3) . fЭ(B2O3) = 69,6182 г/моль . 1/6 = 11,6 г/моль.
б) NaOH
Фактор эквивалентности основания рассчитывается по формуле:
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания).
fЭ(NaOH) = 1/1 = 1 (кислотность равна 1), поэтому эквивалентом NaOH является частица 1NaOH.
Зная фактор эквивалентности гидроксида натрия, рассчитаем молярну массу эквивалента данного основания2, получим:
МЭ(NaOH) = М(NaOH) . fЭ(NaOH) = 40 г/моль . 1 = 40 г/моль.
в) H2SO3
Фактор эквивалентности кислоты рассчитывается по формуле:
n(H + ) – число отданных в ходе реакции ионов водорода (основность кислоты).
fЭ(H2SO3) = 1/2 (основность равна 2), поэтому эквивалентом H2SO3 является частица 1/2H2SO3.
Зная фактор эквивалентности сернистой кислоты, рассчитаем молярну массу эквивалента данной кислоты3, получим:
МЭ(H2SO3) = М(H2SO3) . fЭ(H2SO3) = 82 г/моль . 1/2 = 40 г/моль.
г) NaAl(SO4)2
М[NaAl(SO4)2] = 242 г/моль.
Фактор эквивалентности соли рассчитывается по формуле:
fЭ = 1/[n(Ме) . B(Me)] = 1/[n(A) . B(A)], где
n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка.
Фактор эквивалентности сложной соли можно рассчитать по формуле:
fЭ = 1/<[n(Ме)1 . B(Me)2] + [n(Ме)1 . B(Me)2]> = 1/[n(A) . B(A)], где
n(Ме)1 и n(Ме)2 – число атомов металлов (первого и второго), В(Ме)1 и В(Ме)2 – валентности металлов (первого и второго); n(А) – число кислотных остатков, В(А) – валентность кислотного остатка.
fЭ[NaAl(SO4)2] = 1/<[n(Ме)1 . B(Me)2] + [n(Ме)1 . B(Me)2]> =
= 1/[n(A) . B(A)] = 1/[n(A) . B(A)] = 1[(1 . 1) / (1 . 3)] = 1/(2 . 2) = 1/4, поэтому эквивалентом NaAl(SO4)2 является частица 1/4NaAl(SO4)2.
Зная фактор эквивалентности сульфат алюмииния-наатрия, рассчитаем молярну массу эквивалента данной соли4, получим:
МЭ[NaAl(SO4)2] = М[NaAl(SO4)2] . fЭ[NaAl(SO4)2] = 242 г/моль . 1/4 = 60,5 г/моль.
Определение числа молей и числа эквивалентов в гидроксие титана (III)
Задача 234.
Определите число молей и число эквивалентов в 80 гидроксид титана (III) Ti(OH)3.
Решениие:
m[Ti(OH)3] = 80 г;
М[Ti(OH)3] = 98,89 г/моль ≈ 99 г/моль.
Фактор эквивалентности основания рассчитывается по формуле:
fЭ = 1/n(OH – ), где
где n(ОH – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания).
fЭ[Ti(OH)3] = 1/3 (кислотность равна 3), поэтому эквивалентом Ti(OH)3 является частица 1/3Ti(OH)3.
1. Определим число молей, получим:
2. Определим число эквивалентов, получим:
nfЭ[Ti(OH)3] = n[Ti(OH)3] . fЭ[Ti(OH)3] = 0,8 . 1/3 = 0,269 ≈ 0,27.
Определение объема эквивалентов хлора
Задача 235.
Определите объем 3,3 эквивалентов Cl2 (н.у.).
Решение:
Vm = 22,4 л/моль;
Молярный объем эквивалента (VmЭ или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента рассчитаем по формуле:
VЭ = fЭ . Vm = fЭ . 22,4, где
fЭ — фактор эквиваленттности газообразного вещества, Vm — молярный объем газообразного вещества (равен 22,4 л/моль).
Фактор эквивалентности простого вещества определяется по формуле:
1/[n(Э) . В(Э)], где
n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента.
fЭ(Cl2) = 1/(2 . 1) = 1/2;
VЭ(Cl2) = fЭ . Vm = 1/2 . 22,4 = 11,2 л/моль.
Зная количество эквивалентов хлора [nfЭ(Cl2) = 3,3] и VЭ(Cl2), рассчитаем его объем, получим:
V(Cl2) = nfЭ(Cl2) . VЭ(Cl2) = 3,3(1/2) . 22,4 = 36,96 л.
Рассчет молярной массы эквивалента металла, образующегося при реакции с соляной кислотой
Задача 236.
Рассчитайте молярную массу эквивалента металла и определите какой это металл, если при взаимодействии 1 г его с разбавленной соляной кислотой выделяется водород объемом 220 мл, измеренный при давлении 740 мм. рт. ст. и температуре 21 o С. Каков фактор эквивалентности данного метала?
Решение:
Ввычислим объем водорода при нормальных условиях, используя формулу Клапейрона-Менделеева:
PV/T = PoVo/To, где Ро = 760 мм рт. ст., То = 273 К, V = 0,22 л, Р = 740 мм рт. ст. Т = 294 К, Vo = ?
Vo = PVTo/PoТ = (740 . 0,22 . 273)/(760 . 294) = 0,1989 л.
Рассчитаем количество эквивалентов водорода, получим:
nfЭ(Н2) = V/VЭ(Н2) = 0,1989/11,2 = 0,01776 мольэкв.
Согласно закону эквивалентов следует, вещества реагируют в эквивалентных количествах, то число эквивалентов (молей эквивалентов) металла столько же, т.е. nfЭ(Me) = 0,01776 мольэкв. Следовательно, 1 г металла составляет 0,01776 мольэкв.
Тогда
Вычислим молярную массу эквивалента металла, получим:
МЭ(Ме) = m(Ме)/nfЭ(Me) = 1/0,0178 = 56,306 г/моль.
Если валентность металла Z(Ме) = 1, то М(Ме) = МЭ . (Ме) = 56, 306г/моль — одновалентного металла с такой молярной массой нет (смотри таблицу Менделеева).
Если Z(Ме) = 2, то М(Ме) = 2МЭ(Ме) = 112,712 г/моль ≈ 112 г/иоль – двухвалентный металл с такой молярной массой есть — кадмий.
Фактор эквивалентности кадмия рассчитаем по формуле:
B(Э) — валентность кадмия.
1 Формула определения молярной массы эквивалента оксида:
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8, где
молярная масса эквивалента оксида;
МЭ(элемента) — молярная масса эквивалента элемента;
МЭ(О) — молярная масса эквивалента кислорода, 8 г/моль.
————————————————
2 Формула определения молярной массы эквивалента основания:
МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17, где
МЭ(основания) — молярная масса эквивалента основания;
МЭ(элемента) — молярная масса эквивалента металла;
МЭ(ОН) — молярная масса эквивалента гидроксид-иона, 17 г/моль.
————————————————
3 Формула определения молярной массы эквивалента кислоты:
МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка), где
МЭ(кислоты) — молярная масса эквивалента кислоты;
МЭ(Н) — молярная масса эквивалента водорода, 1 г/моль;
МЭ(кислотного остатка) — молярная масса эквивалента кислотного остатка.
————————————————
4 Формула определения молярной массы эквивалента соли:
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка), где
МЭ(соли) — молярная масса эквивалента соли;
МЭ(Ме) — молярная масса эквивалента металла;
МЭ(кислотного остатка) — молярная масса эквивалента кислотного остатка.
📽️ Видео
Эквивалент и закон эквивалентовСкачать

Фактор эквивалентности ОВТ 1Скачать

Что такое эквивалент?Скачать
Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Решение задач на эквивалентыСкачать

Эквивалент. Часть 2. Эквивалент сложного в-ва: оксидов, оснований, кислот, солей.Скачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Эквивалент. Часть 3. Расчет эквивалента вещества по реакциям ионного обмена.Скачать

Эквивалент. Часть 4. Задачи на эквивалент в окислительно-восстановительных реакциях.Скачать

Молярная масса. 8 класс.Скачать

Находим эквивалент вещества часть 1Скачать