Традиционно сульфид кадмия использовался как краситель. Его можно увидеть на полотнах таких великих художников, как Ван Гог, Клод Моне, Матисс. В последние годы интерес к нему связан с применением сульфида кадмия в качестве пленочного покрытия солнечных батарей и в фоточувствительных устройствах. Данное соединение характеризуется хорошим омическим контактом со многими материалами. Его сопротивление не зависит от величины и направления тока. Благодаря этому материал является перспективным для применения в оптоэлектронике, лазерной технике, светодиодах.
- Общее описание
- Сульфид кадмия: свойства
- Получение
- Применение
- Солнечные батареи на сульфиде кадмия
- Способ получения сульфида кадмия с использованием сульфатредуцирующих бактерий
- Сульфид кадмия
- Содержание
- Распространение в природе
- Структурные свойства
- Применение
- Пигменты
- Оптоэлектроника и люминесценция
- Регистрация элементарных частиц
- Лазерная техника
- Пьезо- и пироэлектрика
- Нанотехнологии
- 📽️ Видео
Видео:Получение СУЛЬФИДА КАДМИЯ. Реакция НИТРАТА КАДМИЯ и СУЛЬФИДА НАТРИЯ. Опыты по химии. Cadmium sulfideСкачать

Общее описание
Сульфид кадмия – это неорганическое соединение, которое встречается в природе в виде редких минералов цинковой обманки и хоулиита. Они не представляют интереса для промышленности. Основным источником сульфида кадмия служит искусственный синтез.
По внешнему виду это соединение – порошок желтого цвета. Оттенки могут варьировать от лимонного до оранжево-красного. Благодаря своей яркой окраске и высокой стойкости к внешним воздействиям сульфид кадмия использовался в качестве высококачественного красителя. Широкую доступность вещество получило начиная с 18 века.
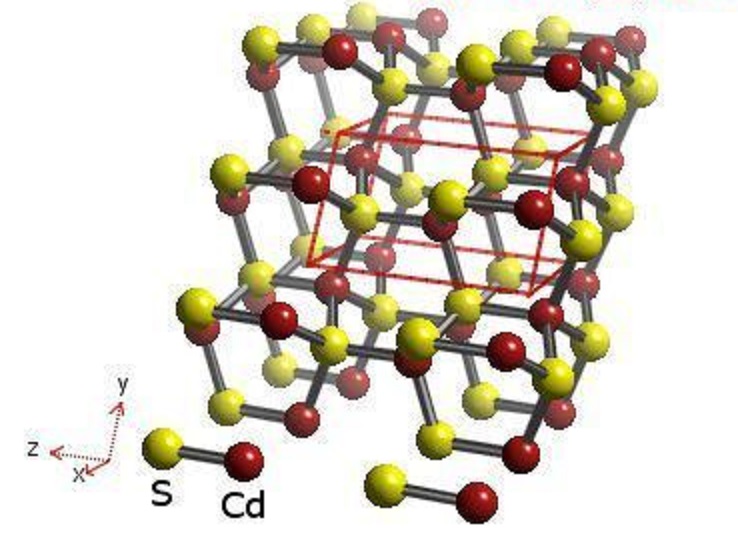
Химическая формула соединения – CdS. Оно имеет 2 структурные формы кристаллов: гексагональную (вюрцит) и кубическую (цинковая обманка). Под воздействием высокого давления образуется также третья форма, как у каменной соли.
Видео:Получение сульфидовСкачать

Сульфид кадмия: свойства
Материал с гексагональной структурой решетки обладает следующими физико-механическими свойствами:
- температура плавления – 1475 °С;
- плотность – 4824 кг/м 3 ;
- коэффициент линейного расширения – (4,1-6,5) мкК -1 ;
- твердость по шкале Мооса – 3,8;
- температура сублимации – 980 °С.
Данное соединение является прямым полупроводником. При облучении светом его проводимость увеличивается, что дает возможность использовать материал в качестве фоторезистора. При легировании медью и алюминием наблюдается эффект люминесценции. Кристаллы CdS могут применяться в твердотельных лазерах.
Растворимость сульфида кадмия в воде – отсутствует, в разбавленных кислотах – слабая, в концентрированной соляной и серной кислоте – хорошая. В нем также хорошо растворяется Cd.
Для вещества характерны следующие химические свойства:
- выпадает в осадок при воздействии на раствор сероводорода или щелочных металлов;
- при реагировании с соляной кислотой образуются CdCl2 и сероводород;
- при нагревании в атмосфере с избыточным содержанием кислорода окисляется до сульфата или окиси (это зависит от температуры в печи обжига).
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Получение
Сульфид кадмия синтезируют несколькими способами:
- при взаимодействии паров кадмия и серы;
- в реакции сераорганических и кадмийсодержащих соединений;
- осаждением из раствора под воздействием H2S или Na2S.
Пленки на основе этого вещества изготавливают при помощи специальных методов:
- химическим осаждением с применением тиокарбамида в качестве источника сульфидных анионов;
- пульверизацией с последующим пиролизом;
- методом молекулярно-пучковой эпитаксии, при которой происходит выращивание кристаллов в условиях вакуума;
- в результате золь-гель процесса;
- способом ионного распыления;
- анодированием и электрофорезом;
- методом трафаретной печати.
Для изготовления пигмента осажденный твердый сульфид кадмия промывают, прокаливают для получения гексагональной формы кристаллической решетки, а затем измельчают до порошкообразного состояния.
Видео:Катионы кадмия с сульфид анионамиСкачать

Применение
Красители на основе данного соединения обладают высокой термо- и светостойкостью. Добавки из селенида, теллурида кадмия и сульфида ртути позволяют изменять цвет порошка на зелено-желтый и красно-фиолетовый. Пигменты используются в производстве полимерных изделий.
Существуют и другие области применения сульфида кадмия:
- детекторы (регистраторы) элементарных частиц, включая гамма-излучение;
- тонкопленочные транзисторы;
- пьезоэлектрические преобразователи, способные работать в диапазоне ГГц;
- изготовление нанопроволок и трубок, которые используются в качестве люминесцентных меток в медицине и биологии.
Видео:Получение сульфида цинка и кадмия.Скачать

Солнечные батареи на сульфиде кадмия
Тонкопленочные солнечные батареи – это одно из последних изобретений в альтернативной энергетике. Развитие этой отрасли промышленности становится все актуальнее, так как запасы полезных ископаемых, служащих для получения электроэнергии, быстро истощаются. Преимуществами солнечных батарей на основе сульфида кадмия являются следующие:
- более низкие материальные затраты при их изготовлении;
- увеличение эффективности преобразования солнечной энергии в электрическую (с 8% для традиционных видов батарей до 15% у CdS/CdTe);
- возможность выработки энергии при отсутствии прямых лучей и использования батарей в туманных районах, в местах с повышенной запыленностью воздуха.
Пленки, применяемые для изготовления солнечных элементов, имеют толщину всего 15-30 мкм. Они обладают зернистой структурой, размер элементов которой составляет 1-5 мкм. Ученые считают, что тонкопленочные батареи в будущем смогут стать альтернативой поликристаллическим благодаря неприхотливым условиям эксплуатации и длительному сроку службы.
Видео:Кадмий - Токсичный Металл из Старых Батареек!Скачать

Способ получения сульфида кадмия с использованием сульфатредуцирующих бактерий
Владельцы патента RU 2526456:
Изобретение может быть использовано в неорганической химии. Способ получения кристаллического сульфида кадмия включает помещение сульфатредуцирующих бактерий в синтетическую среду, содержащую металлы, и добавление питательных веществ, включающих в себя растворы витаминов, солей, кофакторов. При культивировании используют сульфатредуцирующие бактерии Desulfovibrio sp. A2, и синтетическую среду, содержащую источник ионов кадмия — раствор хлорида кадмия. Концентрация ионов кадмия в синтетической среде 150 мг/л. В емкость для культивирования помещают алюминиевую фольгу, культивирование проводят при температуре 28°C в течение 18 суток. Собранный с фольги и со дна флакона осадок, содержащий кристаллы сульфида кадмия, высушивают. Изобретение позволяет получить сульфид кадмия из сточных вод и жидких отходов металлургических предприятий. 2 ил., 3 табл., 1 пр.
Изобретение относится к способу получения чистого сульфида кадмия (CdS) из растворов, содержащих металлы, с использованием сульфатредуцирующих бактерий (СРБ).
Предложенный способ можно использовать для получения чистого сульфида кадмия из сточных вод, содержащих ионы металлов, включая кадмий, и жидких отходов добывающих и перерабатывающих металлургических предприятий. При применении предложенного способа возможно избирательное осаждение кадмия в виде сульфидов. Эта особенность позволяет использовать жидкие отходы металлургических предприятий и сточные воды в качестве вторичного источника сырья для получения сульфидов кадмия. Сульфид кадмия применяется в полупроводниковых лазерах, является материалом для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофор, пигментов для художественных красок, стекла и керамики. Пигменты на основе сульфида кадмия ценятся за их хорошую температурную стабильность во многих полимерах, например, конструкционных пластмассах. При замещении части атомов серы селеном в кристаллах CdS можно получать самые разнообразные цвета красителей от зелено-желтого до красно-фиолетового. Сульфид кадмия является широкозонным полупроводником. Это свойство CdS используется в оптоэлектронике, как в фотоприемниках, так и в солнечных батареях. Из монокристаллов сульфида кадмия изготавливают сцинтилляторы для регистрации элементарных частиц и гамма-излучения.
В природе сульфид кадмия существует в виде минералов гринокит и хоулиит, которые встречаются в виде желтых налетов на сфалерите (ZnS) и смитсоните. Так как эти минералы не широко распространены в природе, то для промышленного использования и научно-технических работ сульфид кадмия получают путем синтеза.
Получают сульфиды кадмия химическими методами — нагреванием серы с кадмием или пропусканием сероводорода над кадмием, оксидом или хлоридом кадмия при нагревании. Известен способ получения порошкообразных сульфидов кадмия и свинца (патент РФ, №2203855, C01G 11/02, C01G 21/21, 2003). Изобретение относится к способам получения порошковых материалов в расплавленных солях. Синтез проводят в расплавленной среде. Расплавленная среда образована кристаллической тиомочевиной, а в качестве металлосодержащего компонента включает безводные ацетаты кадмия или свинца. Синтез осуществляют путем смешивания порошков одной из указанных солей и тиомочевины при 2-4-кратном мольном избытке тиомочевины и дальнейшей выдержке при 160-180°C в течение 20-30 мин. Практический выход продуктов, получаемых предлагаемым способом, свыше 95%. Кроме того, они содержат примесь элементарной серы (3-4 мас.%), которая в зависимости от дальнейшего использования продукта может быть удалена промывкой органическим растворителем (толуол, четыреххлористый углерод и т.д.). Недостатками данного способа является энергозатратность производства, необходимость использования специального, дорогостоящего оборудования. Кроме того, химическое производство негативно сказывается на состоянии окружающей среды.
Известно образование кристаллитов сульфида кадмия на поверхности клеток бактериями Klebsiella pneumonia и Clostridium thermoaceticum (Aiking H. et al. Detoxification of mercury, cadmium, and lead in Klebsiella aerogenes NCTC 418 growing in continuous culture // Appi Environ Microbiol. 1985 Nov;50(5). — P.1262-1267; P.R. Smith et al. PHOTOPHYSICAL AND PHOTOCHEMICAL CHARACTERIZATION OF BACTERIAL SEMICONDUCTOR CADMIUM-SULFIDE PARTICLES // Journal of the Chemical Society. Faraday transactions. — 1998, 94(9). — pp.1235-1241).
Кристаллиты CdS, синтезированные на поверхности бактерии К. pneumonia, эффективно поглощают УФ свет, что защищает бактерию от его губительного действия. Глубоководная морская флуоресцирующая бактерия Pseudomonas aeruginosa удаляет кадмий из среды путем образования кристаллитов CdS на клеточной стенке (Wang C.L. et al. Cadmium removal by a new strain of Pseudomonas aeruginosa in aerobic culture // Appl. Environ. Microbiol. — 1997, 63. — pp.4075-4078). Размеры кристаллитов сульфида кадмия варьируют от десятков микрон вне клеток до десятков ангстрем внутри клеток или на их поверхности. Кристаллиты сульфида кадмия образуются лишь в определенных условиях для перенесения организмами неблагоприятных условий среды.
Наиболее близким по сущности и достигаемому результату к заявленному изобретению является способ удаления ионов кадмия низких концентраций с использованием биореактора с сульфатредуцирующими бактериями (Hiroshi H. et al. Removal of Low Concentrated Cadmium Ions Using Fixed-bed Sulfate-Reducing Bioreactor with FS Carrier // Journal of the Mining and Materials Processing Institute of Japan. — 2003. — V.119, №9. — pp.559-563). Восстановление ионов тяжелых металлов из воды происходило в биореакторе, с использованием сульфатредуцирующих бактерий, иммобилизованных на волокнистом шлаке, который был использован в качестве бионосителя. В этом процессе сульфат-ионы в жидкости биологически преобразуются в сероводород (H2S), который реагирует с ионами металлов с образованием ультрадисперсных частиц сульфида металла. Затем образовавшиеся частицы собираются на поверхности носителя в верхней части реактора, в результате чего накапливаются ионы тяжелых металлов, так и их сульфиды. При непрерывной обработке воды, загрязненной 6 мг/л кадмия, почти полное удаление было проведено за период около 30 дней.
Недостатком известного способа является то, что его применение возможно только при низких концентрациях ионов кадмия в среде и не образуется кристаллического сульфида кадмия.
Задачей настоящего изобретения является разработка способа получения кристаллического сульфида кадмия из растворов с повышенным содержанием ионов кадмия (до 150 мг/л), не содержащего примеси других сульфидов металлов, с использованием сульфатредуцирующих бактерий, устойчивых к повышенным концентрациям ионов кадмия.
Поставленная задача решается путем помещения высокоустойчивых к ионам кадмия СРБ в синтетическую среду, моделирующую сточные воды, содержащие металлы, с добавлением питательных веществ, включающих в себя растворы витаминов, солей, кофакторов, лактата, сульфида натрия, с дальнейшим культивированием в термостате и высушиванием, но, в отличии от прототипа, используются СРБ, обладающие устойчивостью к ионам кадмия, в среду добавляется алюминиевая фольга, культивирование проводят при температуре 28°C в течении 18 суток.
Культивирование проводят в синтетической среде (таблица 1 — состав синтетической среды) с внесением питательных веществ, стимулирующих рост бактерий. В синтетическую среду перед посевом культуры бактерий вносятся питательные вещества и двухвалентный кадмий. Состав питательных веществ и последовательность их внесения указаны в таблице 2. Все питательные вещества, кроме витаминов, автоклавируют при 1 атм 30 мин. Витамины стерилизуют фильтрованием с помощью бактериального фильтра (0,20 мкм).
Посев проводят в стерильные емкости с вложенной фольгой, объем инокулята (культуры СРБ) в количестве 10% от объема емкости. Емкости с инокулятом заливают синтетической средой (со всеми внесенными питательными веществами) до верха. рН среды доводят до 7,0-7,8 раствором NaHCO3. Флаконы закрывают алюминиевыми колпачками, запечатывают и помещают в термостат при температуре 28°C. Образование кристаллов сульфида кадмия происходит на фольге и частично на дне флакона. После культивирования осадок собирают с фольги и центрифугированием со дна флакона и высушивают на воздухе. Примеры осуществления изобретения в лабораторных условиях приведены ниже.
Чистую культуру СРБ Desulfovibrio sp. A2 культивировали на синтетической среде, содержащей двухвалентный кадмий в концентрации 150 мгCd/л и алюминиевую фольгу. Кристаллы сульфида кадмия получали на фольге и частично на дне флакона объемом 120 мл. Флаконы с алюминиевой фольгой стерилизовали сухим жаром в стерилизаторе при 160°C 2,2 часа.
Посев проводили в стерильном ламинарном шкафу, который перед этим дезинфицировали ультрафиолетом 30 минут. Перед посевом синтетическую среду (таблица 1) доводили до кипения и затем быстро охлаждали под струей холодной воды для удаления растворенного кислорода. В охлажденную до комнатной температуры среду вносили питательные вещества (таблица 2) (в расчете на 1 л) в следующей последовательности: витамины (2 мл), раствор солей (10 мл), раствор кофакторов (1 мл), органический субстрат — лактат (1,6 мл), раствор МаНСО3 (рН доводили до 7,0-7,8), раствор сульфида натрия (2 мл). Стоковый раствор кадмия (CdCl2×2,5H2O 2 г на 100 мл воды) добавляли в количестве 16,72 мл на 1 литр синтетической среды (таким образом достигалась концентрация кадмия в среде 150 мг/л).
Во флаконы с фольгой вносили около 50 мл синтетической среды с внесенными в нее добавками и 10 мл инокулята (культуры бактерий), после чего доливали средой до верха. Резиновые пробки притирали к краям флаконов с помощью стерильной иглы, что уменьшало вероятность проникновения кислорода воздуха. В конце посева флаконы закрывали алюминиевыми колпачками, запечатывали флакон закаточной машинкой и помещали термостат при температуре 28°C. Кристаллизация сульфида кадмия начинается после 10 суток культивирования, при культивировании 18 суток сульфид кадмия кристаллизуется полностью. Образованный осадок собирали с фольги и центрифугированием со дна флакона и высушивали на воздухе. Масса образовавшегося осадка — 0,38 г.
Изучение образованных осадков проводили с использованием сканирующей электронной микроскопии (Philips SEM515 с анализатором EDAX ECON IV). Кристаллическую фазу определяли методом рентгенофазового анализа на дифрактометре Shimadzu XRD 6000.
Размер кристаллов, определенный под сканирующим электронным микроскопом, составлял 50-300 мкм, рисунок 1 — микрофотографии (СЭМ) осадков, полученных при культивировании Desulfovibrio sp. A2 в присутствии ионов Cd (150 мг/л) в течение 18 суток, и соответствующие им ЭДС. Осадки, полученные при культивировании штамма Desulfovibrio sp. A2, содержали кадмий, серу, железо, кислород, углерод и натрий, при этом углерод и кислород происходили из углеродной подложки, на которой лежал образец. Соотношение элементов представлено в таблице 3 — элементный состав осадков, полученных при культивировании Desulfovibrio sp. A2 в присутствии ионов Cd (150 мг/л) в течение 18 суток (элементы С и О происходят с подложки, на которой лежал образец).
При изучении осадков с помощью рентгенофазового анализа было показано образование кристаллического сульфида кадмия в течение 18 суток (рисунок 2 — дифрактограмма осадков, полученных при культивировании Desulfovibrio sp. A2 в присутствии начальной концентрации Cd (150 мг/л) в течение 18 суток. Обозначения на дифрактограмме: CdS — сульфид кадмия).
В контрольных осадках, полученных при инкубировании без добавления инокулята, кристаллической фазы не наблюдали и основными элементами были кадмий и кислород. Предлагаемый нами способ включает в себя возможность использования в качестве синтетической среды для получения сульфида кадмия сточных вод и жидких отходов добывающих и перерабатывающих металлургических предприятий.
| Таблица 1 | |
| Реактив | Концентрация, мг/л |
| Na2SO4 | 4000 |
| MgCl2 6H2O | 400 |
| NaCl (25%) | 0,0125* |
| FeSO4*7H2O | 2,1 |
| Н3ВО3 | 0,03 |
| MnCl2*4H2O | 0,1 |
| CoCl2*6H2O | 0,19 |
| NiCl2*6H2O | 0,024 |
| CuCl2*2H2O | 0,002 |
| ZnSO4*7H2O | 0,144 |
| Na2MoO4*2H2O | 0,036 |
| CuSO4*7H2O | 750 |
| H2O | 1 л |
| * — мл/л |
| Таблица 2 | ||
| Раствор (вносимое количество на 1 литр синтетической среды) | ||
| Реактив | Концентрация | |
| 4-аминобензойная кислота | 4 мг/л | |
| Биотин (витамин Н) | 1 мг/л | |
| Никотиновая кислота (витамин B5) | 10 мг/л | |
| 1. Витамины (2 мл/л) | Кальция пантотенат (витамин В3) | 5 мг/л |
| Пиридоксин дигидрохлорид (витамин В6) | 15 мг/л | |
| Цианкобаламин (витамин B12) | 5 мг/л | |
| Тиамин (витамин B1) | 10 мг/л | |
| Рибофлавин (витамин В2) | 0,5 мг/л | |
| Фолиевая кислота | 0,2 мг/л | |
| KH2PO4 | 20 г/л | |
| NH4Cl | 25 г/л | |
| 2. Раствор солей (10 мл/л) | NaCl | 100 г/л |
| KCl | 50 г/л | |
| CaCl2 | 11,3 г/л | |
| H2O | 1 л | |
| 3. Раствор кофакторов (1 мл/л) | NaOH | 4 г/л |
| Na2SeO3×5H2O | 6 мг/л | |
| Na2WO4×2H2O | 8 мг/л | |
| 4. Раствор лактата (1,6 мл/л) | ||
| Лактат | 40% | |
| 5. Раствор Na2S (2 мл/л) | ||
| Na2S×9H2O | 4,8 г |
| Таблица 3 | ||
| Элемент | Весовая доля (Wt %) | Атомная доля (At %) |
| С | 7,56 | 15,1 |
| O | 2,75 | 4,1 |
| Na | 0,41 | 0,4 |
| S | 23,3 | 44,5 |
| Cd | 64,7 | 35,4 |
| Fe | 1,28 | 0,5 |
Способ получения кристаллического сульфида кадмия путем помещения сульфатредуцирующих бактерий в синтетическую среду, содержащую металлы, с добавлением питательных веществ, включающих в себя растворы витаминов, солей, кофакторов, отличающийся тем, что при культивировании используют сульфатредуцирующие бактерии Desulfovibrio sp. A2, используют синтетическую среду, содержащую источник ионов кадмия — раствор хлорида кадмия, причем концентрация ионов кадмия в синтетической среде 150 мг/л, при этом в емкость для культивирования помещают алюминиевую фольгу, культивирование проводят при температуре 28°C в течение 18 суток, а собранный с фольги и со дна флакона осадок, содержащий кристаллы сульфида кадмия, высушивают.
Видео:СУЛЬФИД НАТРИЯ, СЕРОВОДОРОД и многое другое!Скачать

Сульфид кадмия
| Сульфид кадмия | |
|---|---|
 | |
| Систематическое наименование | сульфид кадмия |
| Традиционные названия | сернистый кадмий, как пигмент: кадмиевая желть, кадмиевый жёлтый |
| Хим. формула | CdS |
| Рац. формула | CdS |
| Состояние | кристаллическое |
| Молярная масса | 144,46 г/моль |
| Плотность | 4,82 г/см³ |
| Температура | |
| • плавления | 1748 °C (гексаг.) |
| • сублимации | 980 °C |
| Энтальпия | |
| • образования | −144 кДж/моль |
| Растворимость | |
| • в воде | нерастворим |
| Кристаллическая структура | цинковой обманки a = 0.58320 нм; вюрцита a = 0.41348 нм, c = 0.6749 нм; |
| Рег. номер CAS | 1306-23-6 |
| PubChem | 14783 |
| Рег. номер EINECS | 215-147-8 |
| SMILES | |
| RTECS | EV3150000 |
| ChEBI | 50833 |
| Номер ООН | 2570 |
| ChemSpider | 7969586 |
| Фразы риска (R) | R45 , R22 , R48/23/25 , R62 , R63 , R68 , R53 |
| Фразы безопасности (S) | S53 , S45 , S61 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид кадмия — химическое соединение кадмия и серы с формулой CdS. Сульфид кадмия существует в виде минералов гринокит и хоулиит, которые встречаются в виде жёлтых налетов на сфалерите (ZnS) и смитсоните.
Видео:Задача недели. Химия. №45. Раствори сульфид, если сможешьСкачать

Содержание
- 1 Распространение в природе
- 2 Структурные свойства
- 3 Применение
- 3.1 Пигменты
- 3.2 Оптоэлектроника и люминесценция
- 3.3 Регистрация элементарных частиц
- 3.4 Лазерная техника
- 3.5 Пьезо- и пироэлектрика
- 3.6 Нанотехнологии
Видео:Кадмий - Cd. Реакция Хлорида Кадмия и Цинка. Реакция Zn и CdCl2.Скачать

Распространение в природе
На территории бывшего СССР хоулитсодержащие руды встречаются в Алтын-Топкан в Узбекистане. Гринокит, как правило, обнаруживается в ксантохроите в виде рентгеноаморфной разности. Минералы гринокит и хоулиит не широко распространены в природе, поэтому для промышленного использования и научно-технических работ сульфид кадмия получают путём синтеза.
Видео:Соединения серы. 9 класс.Скачать

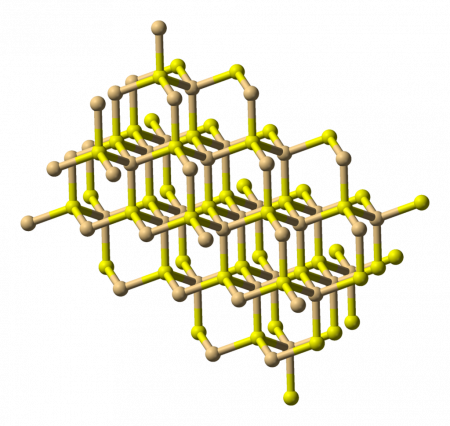
Структурные свойства
Сульфид кадмия кристаллизуется в двух основных модификациях — сфалерит (цинковая обманка) и вюрцит. Для гринокита характерна гексагональная структура вюрцита. Он имеет желтоватый цвет с удельной массой 4,7 г/см³ и твердостью Мооса 3,8. Хоулиит имеет кубическую структуру сфалерита (цинковой обманки).
Видео:Составление формул соединений. 8 класс.Скачать

Применение
Пигменты
Пигменты на основе сульфида кадмия ценятся за их хорошую температурную стабильность во многих полимерах, например, конструкционных пластмассах. При замещении части атомов серы селеном в кристаллах CdS можно получать самые разнообразные цвета красителей от зелёно-жёлтого до красно-фиолетового. Климатическая устойчивость для этого красителя равна 8, то есть он устойчив к солнечному ультрафиолетовому излучению. Краска на основе сульфида кадмия называется кадмиевая желть, кадмиевый жёлтый или просто кадмий.
Оптоэлектроника и люминесценция
Сульфид кадмия является широкозонным полупроводником с шириной запрещённой зоны 2,42 эВ при 300 K . Это свойство CdS используется в оптоэлектронике, как в фотоприёмниках, так и в солнечных батареях. Сульфид кадмия используют для изготовления фоторезисторов (приборов, электрическое сопротивление которых меняется в зависимости от освещенности). Сульфид кадмия применяется в качестве люминофора (также в смеси с сульфидом цинка и прочими примесями).
Регистрация элементарных частиц
Из монокристаллов сульфида кадмия изготавливают сцинтилляторы для регистрации элементарных частиц и гамма-излучения.
Лазерная техника
Монокристаллы сульфида кадмия могут использоваться в качестве рабочего тела твердотельных лазеров.
Пьезо- и пироэлектрика
Обе кристаллические модификации CdS (кубическая и гексагональная) проявляют пьезоэлектрические свойства, а гексагональная, кроме того, — пироэлектрические.
Нанотехнологии
На основе сульфида кадмия создают наноструктурированные материалы (квантовые точки, нанопроволоки, нанотрубки и т. д.), то есть обычные соединения, синтезированные в искусственно созданных границах «ограниченной геометрии». Такие материалы находят применение в медицине и биологии в качестве люминесцентных меток. Также они могут использоваться в оптоэлектронике, лазерах, светодиодах, QD-LED дисплеях и т. д.
📽️ Видео
Кадмий 48. Жёлтый яд вокруг нас.Скачать

Получение кадмияСкачать

Электронные конфигурации атомов. Химия – простоСкачать

Сульфид кадмия для осаждения золота(из цианидных растворов) из аккумуляторов от шуруповертаСкачать

Электролиз. 10 класс.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]Скачать
![Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]](https://i.ytimg.com/vi/CRgMweu9_nE/0.jpg)
Химические уравнения. Как составлять химические уравнения.Скачать

Реакция Нитрата кадмия и сульфида натрияСкачать