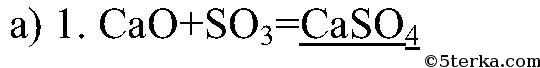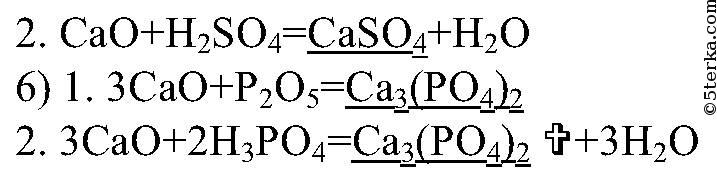Сульфат кальция CaSO4 — соль металла кальция и серной кислоты. Белый. Весьма гигроскопичный. При плавлении разлагается. Мало растворяется в воде.
Относительная молекулярная масса Mr = 136,14; относительная плотность для тв. и ж. состояния d = 2,96; tпл = 1450º C (разлагается).
- Способ получения
- Качественная реакция
- Химические свойства
- Вопрос № 8 Какими двумя способами из оксида кальция можно получить: а) сульфат кальция; б) ортофосфат кальция? Составьте уравнения реакций.
- Сульфат кальция: свойства, польза и вред, реакции, применение
- Что такое сульфат кальция, формула, уравнение
- Химический состав, характеристики, пищевая ценность
- Соединения, взаимодействия, уравнения
- Получение и производство
- Воздействие на организм
- Вред для организма, противопоказания, побочные эффекты
- Полезные свойства
- Применение сульфата кальция
- Применение сульфата кальция в пищевой промышленности
- Применение сульфата кальция в медицине и косметологии
- Допустимые нормы приема
- Класс опасности, хранение
- Где купить и сколько стоит сульфат кальция
- Заключение
- 🎦 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. В результате взаимодействия хлорида кальция и сульфата калия при 800º С образуется сульфат кальция и хлорид калия:
2. Сульфат магния взаимодействует с перхлоратом кальция с образованием сульфата кальция и перхлората магния:
3. Гидроксид кальция вступает в реакцию с серной кислотой и образует сульфат кальция и воду:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция
Качественная реакция на сульфат кальция — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат кальция образует сульфат бария и хлорид кальция:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства
1. Сульфат кальция реагирует с простыми веществами :
1.1. Сульфат кальция взаимодействует с углеродом (коксом) при 900º С и образует сульфид кальция, угарный газ или углекислый газ:
CaSO4 + 4C = CaS + 4CO
2. Сульфат кальция вступает в реакцию со многими сложными веществами :
2.1. Сульфат кальция взаимодействует с оксидами :
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид кальция и углекислый газ:
CaSO4 + 4CO = CaS + 4CO2
2.2. Сульфат кальция может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой сульфат кальция образует гидросульфат кальция:
2.3. Сульфат кальция реагирует с солями :
2.3.1. Сульфат кальция взаимодействует с концентрированным раствором карбоната натрия . При этом образуются карбонат кальция и сульфат натрия:
3. Сульфат кальция разлагается при температуре выше 1450º С, образуя оксид кальция, оксид серы и кислород:
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Вопрос № 8 Какими двумя способами из оксида кальция можно получить: а) сульфат кальция; б) ортофосфат кальция? Составьте уравнения реакций.

задача №8
к главе «Глава V. Обобщение сведений о важнейших классах неорганических соединений. Задачи к § 33 (стр. 97)».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Сульфат кальция: свойства, польза и вред, реакции, применение
Сульфат кальция – это неорганическое вещество, соль серной кислоты. В промышленности используется как в безводном виде, так и в форме дигидратов. Активно применяется в косметологии, медицине, пищевой промышленности. Веществу присвоен код пищевой добавки Е516, относится к агентам, предотвращающим слёживание, обладает стабилизирующими и пластифицирующими свойствами. Сульфат кальция считается безопасным для человека, может быть использован для восполнения дефицита кальция, обогащает продукты питания минералами.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Что такое сульфат кальция, формула, уравнение
Сульфат кальция – это средняя кальциевая соль серной кислоты. Химическая формула CaSO4. Лишенное воды соединение в нормальных условиях – порошкообразный ангидрид высокой плотности с бесцветными или беловатыми кристаллами ромбической кристаллической решетки, иногда возможно наличие желтоватого оттенка.
Порошок лишен запаха, вкус неприятный: кисло-горький, соленый. Плохо растворяется в воде, с при нагревании растворимость уменьшается, не растворим в спиртах. Растворяется в органических растворителях: эфирах, глицерине, кислотах, аммонийных солях. Плавится медленно, отличается высокой гигроскопичностью.
В природе сульфат кальция встречается в виде дигидрата – молекулы соли, соединенной с двумя молекулами воды: CaSO4 * 2H2O, наиболее известного как гипс. Гипс – это осадочный материал, издревле применяемый людьми во многих сферах. Из минерала изготавливали декоративные скульптуры, использовали в архитектуре, а также в качестве удобрения. До сих пор гипс необходим в медицине для накладывания фиксирующих повязок.
Гипс имеет ровный стеклянный блеск, раскалывается на тонкие пластинки в одном направлении, образуя неровный излом. Цветовая гамма от белого до красного, может быть бурым, серым, розовым или желтым. Месторождений множество, в России встречается во многих регионах: Пермь, Татарстан, Самара, Краснодар.
Алебастр – это разновидность гипса, имеющая зернистую структуру, распространена повсеместно. Сегодня добывается как сырье для получения кальциевой соли серной кислоты, в прошлом активно использовался в декоративно-прикладном творчестве. Селенит (лунный камень) отличается тем, что имеет волокнистое строение, достаточно мягкий, встречается в крупных месторождениях глиняных осадочных пород. Применим как вставочный натуральный камень в недорогие украшения, хорошо шлифуется и просвечивает.
Дигидрат отличается по свойствам от ангидрида. Он способен переходить в другие формы при нагревании. При повышении температуры до 180 °С часть воды испаряется, вещество становится полуводным. Если продолжить нагревание, доведя температурный режим до 220 °С, сульфат кальция полностью отдаст воду. При длительном хранении он очень медленно переходит в полуводную форму. Химическая реакция трансформации дигидрата в полугидрат:
Когда ангидрид продолжают обрабатывать высокими температурами (свыше 900 °С), он становится гидравлическим, при контакте с водой быстро застывает. Это явление важно для косметологии и медицины.
Кристаллическая структура сульфата кальция
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химический состав, характеристики, пищевая ценность
Добавка сульфат кальция не калорийна, не имеет выраженной пищевой ценности. Практическое значение заключается в том, что при употреблении в организм попадает дополнительное количество кальция, что важно для водно-солевого обмена. 100 грамм пищевой добавки содержит:
| Вещество | Содержание |
| Сульфат кальция | не менее 95,7% |
Примеси:
| не более 4,3% |
Видео:Сульфат кальция, растворимость в водеСкачать

Соединения, взаимодействия, уравнения
Сульфат кальция вступает во все реакции, присущие средним солям. Качественной реакцией на вещество является взаимодействие с хлоридом бария, при этом выпадает осадок белого цвета:
Термическое разложение сульфата кальция протекает при температуре свыше 1450 °С:
Соединение реагирует с простыми веществами, например, с углеродом с образованием углекислого газа и сульфида кальция:
В реакциях со сложными веществами, оксидами при нагревании до 700-800 °С выделяется угарный газ и сульфид кальция:
Сульфат кальция при взаимодействии с кислотами сернокислый кальций переходит в кислую соль:
Сульфат кальция не реагирует с щелочами, но может вступать в реакцию с солями:
В результате формируется нерастворимый осадок светлого оттенка карбоната кальция, происходит образование двух солей.
Видео:Получение аммиака и сульфата аммонияСкачать

Получение и производство
В лабораторных условиях получение сульфата кальция идёт несколькими путями. Для этого необходимы реактивы, очищенные от примесей. Синтез возможен при нагреве до 800 °С при взаимодействии кальциевой соли соляной кислоты и сернокислым калием:
Вещество также получают реакцией сульфата магния со сложным неорганическим соединением – перхлоратом кальция (соль кальция и хлорной кислоты):
Сульфат кальция синтезируют также путём нейтрализации серной кислоты гашеной известью:
В промышленном производстве чаще всего используется механическая добыча из природных минералов (дигидратов), а также химическую реакцию сплавления хлористого кальция с сернокислым калием. Реже применяют обработку молотого известняка концентрированными растворами серной кислоты.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Воздействие на организм
Сульфат кальция в организме распадается, при этом макроэлемент всасывается в плазму крови в тонком кишечнике и включается в метаболизм, оказывая положительное действие на здоровье. Пищевая добавка не вредит человеку, разрешена во всех странах мира, предельно допустимая концентрация не регламентирована.
Вред для организма, противопоказания, побочные эффекты
Сернокислый кальций (сульфат кальция) не приносит вреда. Неумеренное употребление добавки может привести к расстройству желудочно-кишечного тракта, вызванное слабительным действием добавки. При комбинации соединения с другими кальцийсодержащими препаратами может возникнуть состояние гиперкальциемии – избыточное повышение содержания макроэлемента в плазме крови. При этом происходит откладывание минерала в стенках сосудов, что снижает их эластичность и увеличивает вероятность повреждения.
Противопоказание к приёму продуктов питания, богатых добавкой Е516 – индивидуальная непереносимость. Это крайне редкое явление, поскольку вещество часто встречается в природе и легко и быстро усваивается. Непереносимость может заключаться в сбоях в работе ЖКТ, тошноте, рвоте. Побочные эффекты обычно не возникают.
Полезные свойства
Польза сульфата кальция заключается в уникальных физико-химических свойствах. Способность ангидридов поглощать влагу после обработки высокими температурами позволяет применять их в медицине и косметологии. В пище вещество выполняет стабилизирующие и эмульгирующие функции, выступает в качестве заменителя хлорида натрия, позволяет смешивать несмешиваемые продукты.
Обогащение крови кальцием приводит к положительным результатам. Этот важный макроэлемент играет роль во многих биохимических реакциях, а также:
- поддерживает плотность костной и зубной ткани;
- в качестве антагониста ионов калия участвует в нервно-мышечных реакциях, особенно в процессах возбуждения и торможения ритмики миокарда;
- регулирует работу ферментных систем;
- воздействует на проницаемость клеточных мембран;
- является необходимым компонентом процесса свёртывания крови;
- ответственен за передачу гормональных сигналов;
- укрепляет иммунитет.
Приём продуктов питания, в составе которых имеется пищевая добавка сульфат кальция, обогащает рацион, делает его более сбалансированным. Макроэлемент также способствует усвоению других минеральных соединений, оказывает общеукрепляющие действие.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Применение сульфата кальция
Кальциевая соль серной кислоты применяется во многих сферах. Вещество важно для медицинского пользования как быстро затвердевающий компонент гипсовых повязок, для приготовления слепков зубного ряда. В пищевой промышленности сульфат кальция ценится как качественный и натуральный осушитель, стабилизатор и эмульгатор. В косметологии минеральное соединение входит в состав лицевых масок.
Применение сульфата кальция в пищевой промышленности
Сернокислый кальций забирает воду из продуктов, поэтому применяется как пищевая ядобавка при заготовке сушеных грибов, сухофруктов, овощей. Осушающие свойства необходимы и при производстве сухого молока, супов быстрого приготовления, соусов, различных пряностей.
Для обогащения продукта кальцием и улучшения структуры пищевую добавку Е516 вносится в состав продукции:
- хлебобулочные изделия;
- хлебопекарные дрожжи;
- замороженные морепродукты;
- крабовые палочки;
- алкогольные напитки (вино, пиво);
- сыры и творожные продукты;
- консервированные фрукты и овощи.
В алкогольных напитках пищевая добавка играет роль регулятора кислотности. Она стабилизирует pH виноградного сусла и пивного солода. В фруктово-овощной консервации пищевая добавка Е516 сохраняет хрустящую структуру, предотвращает разрыхление волокон растительной ткани. Пищевая добавка Е516 обеспечивает формирование качественного сгустка в сырах, твороге и тофу. Внесение добавки продлевает цикл заморозки-разморозки у продукции, хранящейся при отрицательных температурах. В диетическом питании соединение выступает как аналог поваренной соли.
В хлебопекарной деятельности пищевая добавка сульфат кальция применяется как подкормка для дрожжевых культур, а также в качестве улучшителя муки, для подавления жизнедеятельности патогенных микроорганизмов и плесневых грибков, для повышения эластичности и однородности готового теста.
Применение сульфата кальция в медицине и косметологии
Затвердевающие гипсовые повязки основаны на способности прокалённого ангидрида сульфата кальция твердеть при контакте с водой. Гипсовые листы предварительно смачиваются в воде и последовательно накладываются на поврежденную конечность. Применение необходимо при переломах, трещинах и сильных ушибах с целью иммобилизовать участок для улучшения срастания и снижения боли.
В ортопедической стоматологии сернокислый кальций входит в состав оттискных материалов, которые нужны для производства зубных протезов. В этой сфере соединение выполняет несколько функций:
- Фиксирует очертания зубного ряда, челюсти.
- Входит в состав формовочной смеси.
- Вносится при паянии протезов.
- Дополнительно используется при установке готовых моделей в стоматологические инструменты.
В косметических средствах Е516 – пластифицирующий компонент альгинатных масок. После нанесения на кожу они застывают и легко снимаются целиком. Выпускаются на основе морских водорослей и других растений, сульфат кальция выступает как натуральная эмульгирующая и стабилизирующая добавка. В скрабах и других средствах для пилинга вещество выступает в качестве матирующего агента.
Продаются термические маски, в которых присутствует добавка сульфат кальция. Они характеризуются самостоятельным разогреванием после намазывания на тело. За счёт повышения температуры открываются поры. Минеральное соединение в таких товарах способствует образованию гомогенной смеси, ускоряет застывание.
Видео:Решение цепочек превращений по химииСкачать

Допустимые нормы приема
Для сульфата кальция не установлено допустимых норм приёма, что связано с его абсолютной безопасностью для организма, быстрым усваиванием и выведением с продуктами обмена. Отсутствие нормативных документов, регламентирующих приём Е516, указывает на то, что практически невозможно через продукты питания и косметику злоупотребить данным соединением.
Видео:Кальций сульфатСкачать

Класс опасности, хранение
Сульфат кальция (сернокислый кальций) относится к 3 классу опасности, оказывает умеренно опасное действие на организм. Это относится к аэрозолю сульфата, распылённого на производствах в воздухе в виде мельчайших капель.
Сульфат кальция необходимо хранить в сухом месте, при относительной влажности не более 70%. Помещение должно быть вентилируемое, пищевая добавка Е516 хранится в оригинальной упаковке, защищённый от воздействия солнечного света. Срок годности 2 года с момента изготовления при температуре не выше 25-30 °С.
Видео:Получение Оксида Кальция - CaO. Разложение Нитрата Кальция - Ca(NO3)2Скачать

Где купить и сколько стоит сульфат кальция
Пищевую добавку сульфат кальция можно приобрести оптом у заводов-производителей. В России существует только одна фирма, осуществляющая производство и продажу Е516. Лидер среди импортёров – Китай. Цена колеблется от 80 до 170 рублей за кг при минимальном заказе от 20-25 кг.
Видео:Химия. Молекулярные и ионные уравненияСкачать

Заключение
Сульфат кальция – это неорганическое соединение, с которым давно знакомо человечество. Оно добывается из природных источников или синтезируется из химических реактивов в лабораторных условиях. Вещество обладает особенными физическими свойствами, химически активно. При употреблении насыщает организм кальция, оказывая положительное влияние на здоровье. Соль применяется в различных областях, в том числе в медицине, косметологии. В пищевой промышленности сернокислый кальций имеет статус пищевой добавки Е516 и используется как эмульгатор, стабилизатор, осушитель.
🎦 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать