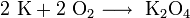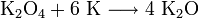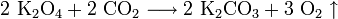Пероксид калия K2O2 — соединение щелочного металла калия и кислорода. Белый. При нагревании на воздухе желтеет и разлагается, плавится под избыточным давлением O2.
Относительная молекулярная масса Mr = 110,19; относительная плотность для тв. и ж. состояния d = 2,40; tпл = 545º C под избыточным давлением.
Видео:Галилео. Эксперимент. Разложение перекиси водородаСкачать

Получение
1. Пероксид калия можно получить путем сгорания калия в кислороде (воздухе), образуется пероксид калия и надпероксид калия:
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Химические свойства
1. Пероксид калия при разложении при температуре выше 500º C образует оксид калия и кислород:
2. Реагируя с водой , пероксид калия образует гидроксид калия и пероксид водорода, если вода холодная, а если вода горячая, то образует гидроксид калия и кислород:
3. Пероксид калия способен реагировать с простыми веществами :
3.1 . Реагируя с кислородом (воздухом) при комнатной температуре пероксид калия образует надпероксид калия:
3.2. При 100º С взаимодействуя с углеродом (графитом) пероксид калия образует карбонат калия и оксид калия:
4. Пероксид калия реагирует со сложными веществами :
4.1. Пероксид калия может взаимодействовать с кислотами :
4.1.1. В результате взаимодействия пероксида калия и разбавленной и холодной хлороводородной кислоты образуется хлорид калия и пероксид водорода:
4.1.2. Реагируя с разбавленной и горячей серной кислотой пероксид калия образует сульфат калия, воду и кислород:
4.2. Возможны реакции между пероксидом калия и оксидами :
4.2.1. В результате реакции при комнатной температуре между пероксидом калия и углекислым газом образуется карбонат калия и кислород:
Видео:Получение кислорода из пероксида водородаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Пероксид водородаСкачать  Калий | |||||||
| Атомный номер | ||||||||
| Внешний вид простого вещества | ||||||||
| Свойства атома | ||||||||
|---|---|---|---|---|---|---|---|---|
| Атомная масса (молярная масса) | ||||||||
| Радиус атома | ||||||||
| Энергия ионизации (первый электрон) | ||||||||
| Электронная конфигурация | ||||||||
| Химические свойства | ||||||||
| Ковалентный радиус | ||||||||
| Радиус иона | ||||||||
| Электроотрицательность (по Полингу) | ||||||||
| Электродный потенциал | ||||||||
| Степени окисления | ||||||||
| Термодинамические свойства простого вещества | ||||||||
| Плотность | ||||||||
| Молярная теплоёмкость | ||||||||
| Теплопроводность | ||||||||
| Температура плавления | ||||||||
| Теплота плавления | ||||||||
| Температура кипения | ||||||||
| Теплота испарения | ||||||||
| Молярный объём | ||||||||
| Кристаллическая решётка простого вещества | ||||||||
| Структура решётки | ||||||||
| Параметры решётки | ||||||||
| Отношение c/a | — | |||||||
| Температура Дебая | ||||||||
| K | 19 |
| 39,0983 | |
| 4s 1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium ; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Видео:йодид калия и перекись водорода = реакцияСкачать

Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Видео:ПЕРОКСИД ВОДОРОДА | Химические свойства перекиси водорода | ПЕРЕКИСЬ | Химические реакции | ХимияСкачать

Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K
2Cl − − 2e − → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH − − 4e − → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Видео:ОКСИД МАРГАНЦА - Пероксид Водорода И Перманганат КалияСкачать

Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Видео:Поджигаем спичку марганцовкой и перекисью водорода #shortsСкачать

Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
🔍 Видео
Перманганат калия разложениеСкачать

Решаем два варианта Добротина за 2 часаСкачать

Перекись водорода. Что будет, если..? или как получить хлор... в желудке.Скачать

Как получают перекись водородаСкачать

ОВР. Реакция взаимодействия дихромата калия с пероксидом водорода в кислой следеСкачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Вода, марганцовка, жидкое мыло, перекись водородаСкачать

Перекись водорода с йодидом калияСкачать

Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Тетрапероксохромат Kалия - K3Cr(O2)4. Реакция Хромата Калия, Гидроксида Калия и Пероксида Водорода.Скачать

ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать