Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой . Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Видео:Как получить Гидроксид Натрия??? NaOH 2 способа.Скачать

Оксид натрия
Натрий является наиболее распространенным в природе и широко применяемым щелочным металлом, занимающим в таблице Менделеева 11-ое место (находится в 1-ой группе, главной подгруппе, 3-го периода). При взаимодействии с кислородом воздуха образует пероксид Na2O2. Можно ли сказать, что это высший оксид натрия? Конечно, нет, так как это вещество не относится к классу оксидов, а его структурная формула записывается в таком виде: Na—O—O—Na. Высшими же называют такие окислы, в которых химический элемент, связанный с кислородом, имеет высшую степень окисления. Натрий имеет только одну степень окисления, равную +1. Поэтому для этого химического элемента понятия «высший оксид» не существует.
Оксид натрия является неорганическим веществом, молекулярная формула его Na2O. Молярная масса равняется 61,9789 г/моль. Плотность окиси натрия равняется 2,27 г/см³. По внешнему виду это белое твердое негорючее вещество, которое плавится при температуре плюс 1132 °С, кипит при температуре плюс 1950 °С и при этом разлагается. При растворении в воде окисел бурно реагирует с ней, в результате образуется гидрооксид натрия, который следует правильно называть гидроксид. Это можно описать уравнением реакции: Na2O + H2O → 2NaOH. Главной опасностью данного химического соединения (Na2O) является то, что оно бурно реагирует с водой, в результате чего образуется агрессивная едкая щелочь.
Оксид натрия может быть получен нагреванием металла до температуры не выше 180 °С в среде с невысоким содержанием кислорода: 4Na + O2 → 2Na2O. В этом случае не удается получить чистый окисел, так как в продуктах реакции будет содержаться до 20% пероксида и только 80% целевого вещества. Есть и другие способы получения Na2O. Например, при нагревании смеси перекиси с избытком металла: Na2O2 + 2Na → 2Na2O. Кроме того, окисел получают путем реакции металлического натрия с его гидроксидом: 2Na + NaOH → 2Na2O + H2↑, а также при взаимодействии соли азотистой кислоты со щелочным металлом: 6Na + 2NaNO2 → 4Na2O + N2↑. Все эти реакции протекают при избытке натрия. Кроме того, при нагревании карбоната щелочного металла до 851 °С могут получаться углекислый газ и окись этого металла по уравнению реакции: Na2CO3→ Na2O + CO2.
Оксид натрия обладает ярко выраженными основными свойствами. Кроме того, что он бурно реагирует с водой, он также активно взаимодействует с кислотами и кислотными окислами. В результате реакции с соляной кислотой образуется соль и вода: Na2O + 2HCl → 2NaCl + H2O. А при взаимодействии с бесцветными кристаллами диоксида кремния образуется силикат щелочного металла: Na2O + SiO2 → Na2SiO3.
Оксид натрия, как и оксид другого щелочного металла — калия, большого практического значения не имеет. Это вещество обычно применяется как реактив, является важным компонентом промышленного (содово-известкового) и жидкого стекла, но не входит в состав оптических стекол. Как правило, промышленное стекло содержит около 15% окиси натрия, 70% кремнезема (диоксида кремния) и 9% извести (оксид кальция). Карбонат Na служит в качестве флюса для снижения температуры, при которой плавится диоксида кремния. Содовое стекло имеет более низкую температуру плавления, чем калийно-известковое или калийно-свинцовое. Оно является наиболее распространенным, используется для изготовления оконного стекла и стеклянной тары (бутылки и банки) для напитков, продуктов питания и некоторых других товаров. Стеклянная посуда часто изготавливается из закаленного натриево-кальциево-силикатного стекла.
Сода-силикатное стекло получают путем плавки сырья — карбоната Na, извести, доломита, диоксида кремния (кремнезема), оксида алюминия (глинозема), а также небольшого количество агентов (например, сульфата Na, хлорида Na) — в стекловаренной печи при температуре до 1675 °С. Зеленые и коричневые бутылки получают из сырья, содержащего оксид железа. Количество оксида магния и оксида натрия в тарном стекле меньше, чем в стекле, которое применяется для изготовления окон.
Видео:Получение Диоксоферрата Натрия. Реакция Оксида Железа и Гидроксида Натрия.Скачать

Оксид натрия
| Оксид натрия | |
|---|---|
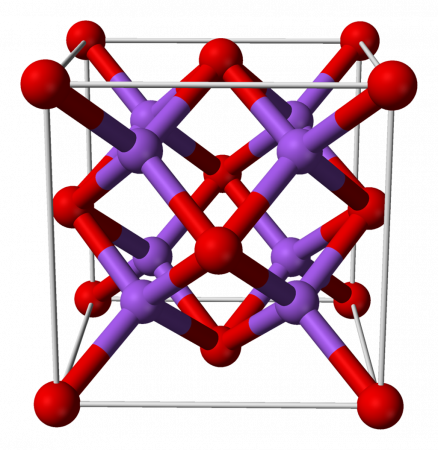 | |
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES | |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
Видео:Как получить гидроксид натрия в домашних условиях ?Скачать

Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Видео:ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
Видео:Как сделать гидроксид натрияСкачать

Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Na2O + 2 HCl ⟶ 2 NaCl + H2O
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
🎥 Видео
Решаем два варианта Добротина за 2 часаСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Оксиды. Химические свойства. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

🔥 Как получить НАТРИЙ из средства для ЧИСТКИ ТРУБ?Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Получение оксидовСкачать

Оксид натрияСкачать

Получение Алюмината Натрия - NaAlO2.Реакция Расплава Гидроксида Натрия и Алюминия. Реакция Al и NaOHСкачать

