Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
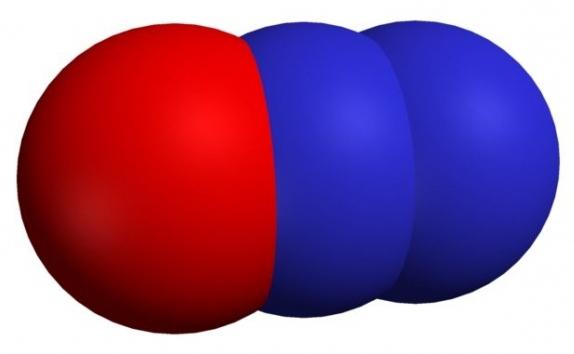
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Его довольно просто получить, для этого нужно нагреть до 1200-1300 о С смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
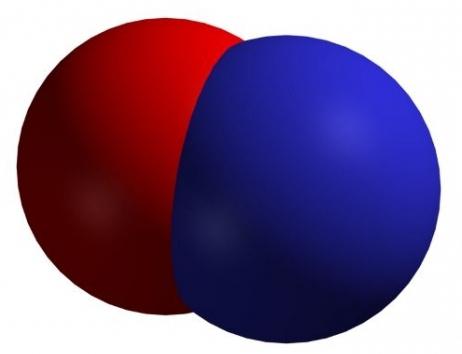
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
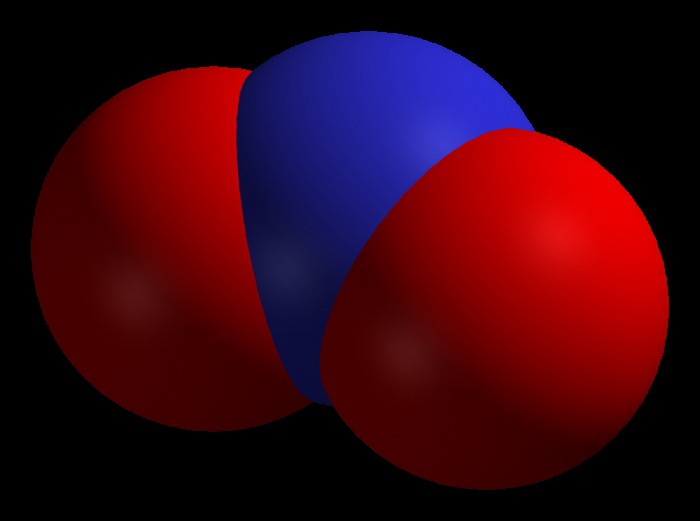
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
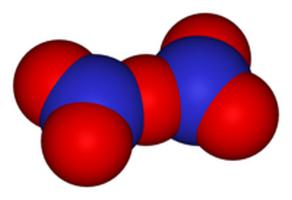
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3 о С.
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Please wait.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

We are checking your browser. gomolog.ru
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2c270f28954218 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Оксид азота V: получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Получение оксида азота (V)
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства оксида азота (V)
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например , оксид азота (V) реагирует с гидроксидом натрия:
Еще пример : оксид азота (V) реагирует с оксидом кальция:
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель .
Например , он окисляет серу:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
💥 Видео
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

В каком веществе донорно-акцепторная связь отсутствует? A) N2O5 В) СO2 С) СО D) HNO3Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

25. Схема реакции и химическое уравнениеСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Оксиды. Химические свойства. 8 класс.Скачать