Окислитель – это частица (атом, молекула), которые присоединяют к себе электроны. Перманганат калия (KMnO4) является типичным окислителем, в котором Mn имеет максимальную степень окисления — +7. Чаще всего его используют в лабораториях.
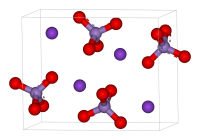
KMnO4 представляет собой растворимую соль, имеющую фиолетовый цвет.
Соли-перманганаты существуют только в растворах. Все соли (металл — щелочные металлы, аммоний, серебро и алюминий) растворимы в воде и образуют фиолетово-черные кристаллы.
При нагревании перманганаты разлагаются до манганатов:
В кислой среде он восстанавливается до Mn +2 :
В щелочной среде – до Mn +6 :
В нейтральной среде – до Mn +4 :
- Применение перманганата калия.
- Перманганат калия ГОСТ 20490-75
- Содержание
- Физические свойства
- Термодинамические свойства
- Химические свойства
- Применение
- Медицинское применение
- Фармакологическое действие
- Показания
- Противопоказания
- Способ применения и дозы
- Предосторожности
- Другие сферы применения
- Получение
- Ограничение на покупку
- Acetyl
- 🎬 Видео
Видео:КАК НАПИСАТЬ РЕАКЦИЮ KMnO4 + MnSO4 + H2O и УРАВНЯТЬ ЕЁ / Реакция перманганата и сульфата марганцаСкачать

Применение перманганата калия.
Перманганат калия чаще всего используют в медицине. В зависимости от концентрации он оказывает различное воздействие на кожу: либо прижигающее, либо вяжущее. Так как перманганат при разложении дает свободный кислород (активный) его часто используют при обработке глубоких инфекционных ран.
Видео:Химическая реакция KMnO4 с H2SO4 и H2O2Скачать

Перманганат калия ГОСТ 20490-75
| Перманганат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Перманганат калия |
| Традиционные названия | Марганцовокислый калий, марганцовка |
| Хим. формула | KMnO4 |
| Состояние | твердое (хрупкие кристаллы) |
| Молярная масса | 158,034 г/моль |
| Плотность | 2,703 г/см³ |
| Т. разл. | 240 °C |
| Мол. теплоёмк. | 119,2 Дж/(моль·К) |
| Энтальпия образования | -813,4 кДж/моль |
| Растворимость в воде | 6,38 (20 °C) |
| Рег. номер CAS | ГОСТ 5777-84 ГОСТ 20490-75 |
| Рег. номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Рег. номер EINECS | 231-760-3 |
| SMILES | |
| Рег. номер EC | 231-760-3 |
| RTECS | SD6475000 |
| Номер ООН | 1490 |
| ChemSpider | 22810 |
| Токсичность | низкая |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Перманганат калия (лат. Kalii permanganas , распространённое название в быту — марганцовка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.
Видео:Решение цепочек превращений по химииСкачать

Содержание
- 1 Физические свойства
- 1.1 Термодинамические свойства
- 2 Химические свойства
- 3 Применение
- 3.1 Медицинское применение
- 3.1.1 Фармакологическое действие
- 3.1.2 Показания
- 3.1.3 Противопоказания
- 3.1.4 Способ применения и дозы
- 3.2 Предосторожности
- 3.3 Другие сферы применения
- 3.1 Медицинское применение
- 4 Получение
- 5 Ограничение на покупку
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Видео:Химическая реакция FeSO4 с KMnO4 и H2SO4Скачать

Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E 0 , В |
|---|---|---|---|
| MnO4 − | MnO4 2− | OH − | +0,56 |
| MnO4 − | H2MnO4 | H + | +1,22 |
| MnO4 − | MnO2 | H + | +1,69 |
| MnO4 − | MnO2 | OH − | +0,60 |
| MnO4 − | Mn 2+ | H + | +1,51 |
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
- в кислой среде:
2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
- в нейтральной среде:
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- в щелочной среде:
2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
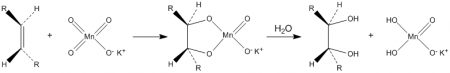
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Другие названия | |
|---|---|
| Лекарственные формы | |
| Классификация | |
| Химическое соединение | |
| Перманганат калия | |
| Kalii permanganas | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO₄ |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| порошок для приготовления раствора | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
| Перманганат калия | |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
При передозировке: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отёчная, тёмно-коричневого, фиолетового цвета, возможен отёк гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и одышкой. Смертельная доза для детей — около 3 г , для взрослых — 0,3—0,5 г/кг .
Лечение: метиленовый синий ( 50 мл 1 % раствора), аскорбиновая кислота (внутривенно — 30 мл 5 % раствора), цианокобаламин — до 1 мг , пиридоксин (внутримышечно — 3 мл 5 % раствора).
Способ применения и дозы
Наружно, в водных растворах для промывания ран ( 0,1—0,5 % ), для полоскания рта и горла ( 0,01—0,1 % ), для смазывания язвенных и ожоговых поверхностей ( 2—5 % ), для спринцевания ( 0,02—0,1 % ) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Очень опасно растирание сухого перманганата калия с органическими веществами и порошками активных металлов и неметаллов (кальцием, алюминием, магнием, фосфором, серой и др.) — весьма вероятен взрыв.
Другие сферы применения
- Применяется для определения перманганатной окисляемости при оценке качества воды согласно ГОСТ 2761-84 по методу Кубеля.
- Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ.
- Растворы (концентрации примерно 3 г/л) широко применяются при тонировании фотографий.
- В пиротехнике применяют в качестве сильного окислителя.
- Применяют в качестве катализатора разложения перекиси водорода в космических жидкостно-ракетных двигателях.
- Водный раствор перманганата калия используется для травления дерева, в качестве морилки.
- Водный раствор применяется также для выведения татуировок. Результат достигается посредством химического ожога, при котором отмирают ткани, в которых содержится красящее вещество. Данный метод немногим отличается от простого срезания кожи, обычно он менее эффективен и более неприятен, так как ожоги заживают намного дольше. Татуировка не удаляется полностью, на её месте остаются шрамы.
- Перманганат калия или бихромат натрия используются в качестве окислителя при получении мета- и парафталевых кислот из мета- и параксилолов соответственно (см. Терефталевая кислота).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Видео:Окисление органических соединений перманганатом калияСкачать

Ограничение на покупку
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ.
Видео:Химическая реакция KMnO4 с H2SO4 и NaNO2Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎬 ВидеоОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  Арены. Окисление с KMnO4 и K2Cr2O7. Все 12 реакций ЕГЭ.Скачать  Альдегиды. Окисление с KMnO4 и K2Cr2O7. Все 7 реакций ЕГЭ.Скачать  89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать  ЕГЭ Химия 2022 | Электронный баланс | ОВР с KMnO4Скачать  Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭСкачать  Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать  Спирты. Окисление с KMnO4 и K2Cr2O7. Все 12 реакций ЕГЭ.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  |