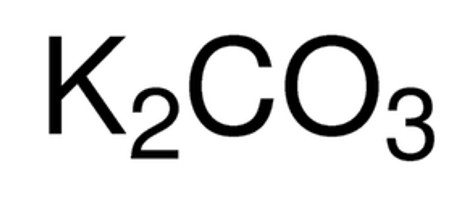Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Карбонат калия (поташ): получение, применение и химические свойства
- Историческая справка
- Применения поташа в истории
- Современные способы получения
- Общие свойства карбоната калия
- Применение
- Пищевая добавка Е501
- Первая помощь при вдыхании и попадании на кожу карбоната калия
- Карбонат калия
- 🎦 Видео
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
Видео:Поташ (углекислый калий) из золы.Скачать

Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
Видео:Поташ (Щелок) из золыСкачать

Химические свойства
1. Карбонат калия может реагировать с простыми веществами :
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
2. Карбонат калия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
2.3. Карбонат калия способен реагировать с кислотами :
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой . В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы . При этом образуются карбонат калия и углекислый газ:
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Карбонат калия (поташ): получение, применение и химические свойства
Карбонат калия также известен как пищевая добавка Е501. Это мелкий кристаллический порошок, образующийся в результате химической реакции диоксида углерода и гидроксида калия. Вещество это достаточно давно известно. В старину его называли «поташ».
Видео:Карбонат калия в домашних условиях.Скачать

Историческая справка
Углекислый калий с давних времен назывался поташ. Слово это имеет латинское происхождение. Дословно его можно перевести так: потт — горшок, аш — зола. Вот такой получается интересный перевод – горшок золы. Почему такое странное название? Это связано со старинным способом его получения.
Большую популярность поташ приобрел в 17-19 веках. Он выступал как основной химический реагент. Его использовали практически во всех отраслях промышленности тех лет. В Российской империи небезызвестный своими новаторскими идеями Петр Первый ввел монополию на производство поташа в 1721 году. Сегодня же карбонат калия относится к 3-му классу опасных веществ. Его производят во многих странах.
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Применения поташа в истории
Итак, история исследования и использования такого вещества, как поташ, насчитывает не один век. Интересно, что он был известен еще древним римлянам. Они по достоинству оценили свойства данного вещества и использовали его для стирки. Именно они впервые подметили, что зола способна удалить даже сильные жирные пятна с вещей. Только спустя несколько веков этому нашли научное подтверждение. Оказывается, что поташ, попадая в воду, создает щелочную среду. Жирные вещества в ней просто напросто расщепляются.
Примечательно, что в больших объемах научились добывать карбонат калия уже в начале семнадцатого века. Такое производство по праву можно было назвать промышленным. Процесс его получения был трудоемок. Сначала строились большие каменные очаги. В них раздували сильный костер, поддерживая его дровами. Затем в специальном деревянном корыте смешивали сильно горячую воду и приготовленную древесную золу. Получался раствор, которым, как ни странно это звучит, поливали костер, следя, чтобы он не потух. Конечно, здесь требовалось мастерство и умение. Появились даже специальные люди обученные ремеслу, которых называли «поливала». Но как же получали сам поташ? Под костром, который долгое время периодически поливали раствором золы, появлялся слой карбоната калия. И чем больше по времени протекал этот процесс, тем наслоение было толще. Теперь только оставалось дождаться, пока он остынет. Потом его долбили и закатывали по небольшим бочкам. Но экономичным этот процесс нельзя было назвать. Чтобы получить один килограмм поташа уходил кубометр древесины.
Видео:химическая реакция взаимодействия карбоната калия и соляной кислотыСкачать

Современные способы получения
Легче всего карбонат калия получить из щелочи в процессе выщелачивания водой золы из водорослей и злаков. Поташа больше всего содержится в растворимой составляющей растительных остатков. Еще сравнительно недавно принцип получения этого вещества был такой. В глиняный сосуд с маленьким отверстием на дне помещали золу. Затем ее утрамбовывали. Заливали строго отмеренным количеством горячей воды. Она должна была пройти через весь слой золы и стечь в емкость. Потом ее снова заливали в сосуд, так до тех пор, пока жидкость не приобретала густую консистенцию. Затем лишнюю воду выпаривали и после остывания получали поташ. Весь процесс был куда более экономичным, чем предыдущий. Требовалось уже не так много золы.
Сегодня это вещество получают в результате электролиза KCl. Это цепь сложных химических реакций. В итоге осуществляется гидролиз карбоната калия. Во взаимодействие вступают гидроксид К и углекислый газ. Формула реакции выглядит следующим образом: 2(КОН) + СО2 → К2СО3 + Н2О
Видео:Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Общие свойства карбоната калия
Это химическое вещество обладает следующими свойствами:
— Оно мгновенно растворяется в воде.
— Данное вещество не расщепляется в этаноле.
— Температура плавления кристаллического карбоната калия составляет 891 градус по Цельсию.
— Вещество обладает выраженным вкусом щелочи.
— Углекислый калий не имеет запаха.
Важно знать, в кристаллическом состоянии карбонат калия оказывает кератолитическое и выраженное противомикробное действие. Его бактерицидные свойства можно объяснить тем, что сухое вещество и его раствор – это сильная щелочь. При этом чем выше его температура, тем сильнее проявляются эти свойства. Поташ издревле использовался как средство, убивающее микробов и микроскопических вредителей.
Видео:Калий - САМЫЙ ГОРЮЧИЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

Применение
Благодаря своим щелочным свойствам углекислый калий способен регулировать уровень кислотности. Также ему под силу бороться с избытком влаги, перемешивать масляные и водные растворы в однородную массу. Он может применяться в качестве разрыхлителя теста в выпечке. Данное вещество используют в производстве алкогольных напитков. Здесь его применяют как стабилизатор. Естественно, что карбонат калия — вещество опасное, поэтому в пищевой промышленности он используется в малых количествах.
В сельском хозяйстве уже достаточно долгое время поташ известен как удобрение. Он препятствует размножению на культурных растениях насекомых и прочих вредителей. Раствор углекислого калия способен значительно улучшить качество пашни. Его свойства способствуют тому, что из почвы выводится излишняя кислотность. Раствором этого вещества дезинфицируют помещения. Особенно там, где долгое время содержится скот. Это курятники, конюшни, свинарники.
Нашел свое применение карбонат калия и в фармацевтике. Это активное вещество противопаразитарных мазей и суспензий. Они эффективно борются с такими паразитами, как вши и чесоточные клещи.
Видео:Получение Карбоната Кальция - чистого мела. CaCO3.Скачать

Пищевая добавка Е501
Пищевая добавка Е501 – это мелкозернистый порошок. Его используют как компонент кулинарных изделий и алкогольных напитков. Он является примесью питьевой соды. В настоящее время она признана во многих странах опасной. В старину карбонат калия добавляли в малых количествах в пряники.
Помимо своего основного названия, эта пищевая добавка скрывается и под другими не менее известными наименованиями. Это и дикалий карбонат, и поташ, и калий углекислый. Но в действительности это одно и то же вещество. Оно небезопасно для здоровья человека и может спровоцировать сильные раздражения.
В результате исследований доказано, что карбонат калия (формула К2СО3) наносит вред организму человека. Но справедливости ради нужно отметить, что опасен он только во взвешенном состоянии. Если он попадает в верхние дыхательные пути, то непременно вызовет сильнейшее раздражение и аллергическую реакцию. Могут также проявиться астматические приступы у больных с хронической формой.
Это вещество также вызывает местное раздражение и зуд, если попадает на влажные кожные покровы и слизистую рта и глаз. Проявляется и в форме экземы. Если порошок попадает на руки или лицо, его необходимо немедленно смыть водой.
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Первая помощь при вдыхании и попадании на кожу карбоната калия
Данное вещество не угрожает жизненно важным процессам в организме. Но между тем оно может спровоцировать массу негативных симптомов. При вдыхании наблюдается раздражение и отек. Поэтому необходимо незамедлительно вызвать скорую помощь. Затем вынести пострадавшего на свежий воздух.
Если вещество попало на слизистые или кожу, то его нужно сразу же смыть. Промывают холодной проточной водой в течение 15 минут. Если вещество попало по каким-то причинам в желудок, то делают промывание.
Видео:Получение: Гидроксида калия - KOHСкачать

Карбонат калия
Из слабой угольной кислоты (она является малоустойчивой и может существовать только в разбавленных растворах) при взаимодействии со щелочами получаются кислые и средние соли, которые иначе называются гидрокарбонаты и карбонаты соответственно. Уравнения реакций можно записать: H2CO3 + KOH → KHCO3 + H2O и H2CO3 + 2KOH → K2CO3 + 2H2O. В первом получается гидрокарбонат калия, а во втором — карбонат калия. Формула кислой соли — KHCO3, а средней — K2CO3. Молярная масса углекислого калия равняется 138,2 г/моль. По внешнему виду соль напоминает белый мелкокристаллический порошок, который не является горючим, плавится при температуре 891 С, не достигнув температуры кипения, соль разлагается. Углекислый калий гигроскопичен, хорошо растворяется в воде: в 100 мл при 20 С — 110,5 г, а при 100 С — 156 г соли. Но в спирте или в ацетоне это вещество не растворяется.
В старину карбонат калия называли поташ, слово произошло от латинского названия «potassa». Углекислый калий является одной из самых старых солей, которые были известных людям издавна. В Европе до прошлого столетия поташ являлся одним из наиболее важных химических реагентов, имеющих промышленное значение. В России на производство поташа Петром Первым в 1721 году была установлена монополия. В настоящее время на территории Российской федерации, а также в Армении, Казахстане, Беларуси, Украине, Туркменистане, Молдове, Узбекистане на это химическое вещество распространяется межгосударственный стандарт ГОСТ 10690-73. Поташ относится, согласно ГОСТу 12.1.005-88, к веществам третьего класса опасности, при попадании на слизистые оболочки или влажную кожу вызывает раздражение.
Если смешать карбонат калия с водой, то при его растворении выделяется много тепла, то есть реакция гидролиза K2CO3 является экзотермической, а под действием воды происходит образование новых веществ. Соль двухосновной угольной кислоты гидролизуется ступенчато. Сначала образуется кислая соль: H2O + K2CO3 → KHCO3 + KOH. Затем слабо протекает вторая ступень разложения водой уже кислой соли: H2O + KHCO3 → H2CO3 + KOH. Так как гидролиз карбоната калия, как и других солей слабых кислот, протекает с образованием гидроксильных ионов OH-, то рН их водных растворов бывает всегда более 7, а среда является щелочной.
Углекислый калий в 17 веке в России получали выщелачиванием древесной золы. В деревянных корытах готовили раствор щелочи, обливая горячей водой золу. Затем этот раствор лили в кирпичный очаг с горящими дровами. Карбонат калия кристаллизовался очень плотным слоем на дне очага, с помощью лома поташ добывали и раскладывали по бочкам, закупоривая их герметично. Требовалась определенная сноровка, чтобы раствор упаривался, а костер не тух. Поэтому ремеслу «поливачей» начинали обучать в подростковом возрасте, и только через несколько лет рабочий приобретал определенные навыки и становился мастером своего дела. Для примера: при сжигании костра всегда образуется белая зола, основная ее часть — это поташ. Сегодня реализован другой промышленный способ — через полученную электролизом гидроокись калия пропускают углекислый газ: 2KOH + CO2 → K2CO3 + H2O. В результате получается поташ и вода.
Карбонат калия используется в производстве мыла и стекла. В лаборатории его применяют в качестве мягкого осушителя в тех случаях, когда другие средства, такие как хлорид кальция или сульфат магния, не допускаются. Он не подходит для сушки кислотных соединений, но может быть использован для сушки органических продуктов с небольшим содержанием кислых примесей. Карбонат калия применяется для тушения пожаров класса B, так как относится к химическим порошкам, способным и ингибировать, и тушить процесс горения. Он обладает большей огнетушащей эффективностью, чем такие соли, как карбонат натрия, сульфат натрия, фторид натрия или гидрокарбонат натрия. Его ингибирующая эффективность процессов горения также выше, чем у карбоната натрия, сульфата натрия, оксида алюминия и карбоната кальция. В стекольной промышленности K2CO3 используют в производстве лабораторного (тугоплавкого), оптического или поташного стекла, а также стекла для изготовления посуды. Кроме того, углекислый калий востребован в химической, сельскохозяйственной, медицинской, пищевой отраслях.
🎦 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Карбонат натрия из пищевой содыСкачать

Цианистый Калий. Самый известный ЯД и как пахнет синильная кислота.Скачать

Химия Заново 1. Поташ 1765.Скачать

Получение сильной щёлочи. Едкий кали.Скачать

Реакция большого количества натрия с водой.Скачать

Тест состава: Карбонат калия и ПАМ. K2CO3 и MgAlСкачать