Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
- Способ получения
- Качественная реакция
- Химические свойства
- Кальций
- Содержание
- История и происхождение названия
- Нахождение в природе
- Изотопы
- В горных породах и минералах
- Миграция в земной коре
- В биосфере
- Получение
- Физические свойства
- Химические свойства
- Применение
- Биологическая роль
- №20 Кальций
- История открытия:
- Нахождение в природе и получение:
- Физические свойства:
- Химические свойства:
- Важнейшие соединения:
- Применение:
- 🌟 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

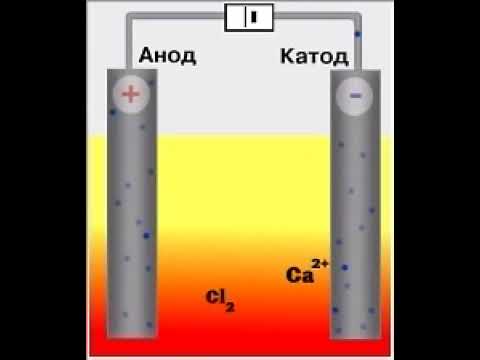
Способ получения
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Видео:Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Химические свойства
1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли :
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Кальций
| Кальций | |
|---|---|
| Умеренно твёрдый, серебристо-белый металл | |
 |
(молярная масса)
(первый электрон)
Кальций (Ca от лат. Calcium ) — элемент второй группы (по старой классификации — главной подгруппы второй группы), четвёртого периода, с атомным номером 20. Простое вещество кальций — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. Впервые получен в чистом виде Г. Дэви в 1808 году.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Изотопы
- 2.2 В горных породах и минералах
- 2.3 Миграция в земной коре
- 2.4 В биосфере
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 7 Биологическая роль
Видео:8 класс. Составление уравнений химических реакций.Скачать

История и происхождение названия
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Гемфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием.
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности (3-е среди металлов) после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л .
Изотопы
Кальций встречается в природе в виде смеси шести изотопов: 40 Ca, 42 Ca, 43 Ca, 44 Ca, 46 Ca и 48 Ca, среди которых наиболее распространённый — 40 Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20 . Изотопы 40
20 Ca 20
и 48
20 Ca 28
являются двумя из пяти существующих в природе дважды магических ядер.
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48 Ca, самый тяжёлый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58)⋅10 19 лет .
В горных породах и минералах
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Осадочная порода, состоящая в основном из скрытокристаллического кальцита — известняк (одна из его разновидностей — мел). Под действием регионального метаморфизма известняк преобразуется в мрамор.
Миграция в земной коре
В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната:
(равновесие смещается влево или вправо в зависимости от концентрации углекислого газа).
Огромную роль играет биогенная миграция.
В биосфере
Соединения кальция находятся практически во всех животных и растительных тканях (см. ниже). Значительное количество кальция входит в состав живых организмов. Так, гидроксиапатит Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Ca(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. В живых тканях человека и животных 1,4—2 % Ca (по массовой доле); в теле человека массой 70 кг содержание кальция — около 1,7 кг (в основном в составе межклеточного вещества костной ткани).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75—80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C 4CaO + 2Al → CaAl2O4 + 3Ca
Видео:РАЗБОР ВАРИАНТА ЦТ (ЧАСТЬ 1)Скачать

Физические свойства
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α -Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм ), выше устойчив β -Ca с кубической объемно-центрированной решеткой типа α -Fe (параметр a = 0,448 нм ). Стандартная энтальпия ΔH 0 перехода α → β составляет 0,93 кДж/моль .
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются).
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические свойства
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло-серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca 2+ /Ca 0 −2,84 В , так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом, йодом) кальций реагирует при обычных условиях:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Кроме получающихся в этих реакциях фосфида кальция Ca3P2 и силицида кальция Ca2Si, известны также фосфиды кальция составов CaP и CaP5 и силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
Ион Ca 2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, йодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат CaC2O4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция CaCO3, кислый карбонат кальция (гидрокарбонат) Ca(HCO3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а в тех местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
Так в природе происходит перенос больших масс веществ. В результате под землёй могут образоваться огромные карстовые полости и провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет вре́менную жёсткость воды. Вре́менной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает CaCO3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Видео:Оксид кальцияСкачать

Применение
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудно восстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом применяются в некоторых видах аккумуляторных батарей и при производстве подшипников. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов. Чистый металлический кальций широко применяется в металлотермии при получении редкоземельных элементов.
Кальций широко применяется в металлургии для раскисления стали наряду с алюминием или в сочетании с ним. Внепечная обработка кальцийсодержащими проволоками занимает ведущее положение в связи с многофакторностью влияния кальция на физико-химическое состояние расплава, макро- и микроструктуры металла, качество и свойства металлопродукции и является неотъемлемой частью технологии производства стали. В современной металлургии для ввода в расплав кальция используется инжекционная проволока, представляющая из себя кальций (иногда силикокальций или алюмокальций) в виде порошка или прессованного металла в стальной оболочке. Наряду с раскислением (удалением растворенного в стали кислорода) использование кальция позволяет получить благоприятные по природе, составу и форме неметаллические включения, не разрушающиеся в ходе дальнейших технологических операций.
Изотоп 48 Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Это связано с тем, что кальций-48 является дважды магическим ядром, поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Биологическая роль
Кальций — распространённый макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10 −4 ммоль/л , в межклеточных жидкостях около 2,5 ммоль/л .
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19—50 лет и детей 4—8 лет включительно дневная потребность (RDA) составляет 1000 мг , а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки . В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12—19 лет достигают своих потребностей. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины, зелень, орехи. Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Усвоению кальция препятствуют некоторые животные жиры (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла). В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки (около 340 г сыра Эдам).
№20 Кальций
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

История открытия:
Природные соединения кальция (мел, мрамор, известняк, гипс) и продукты их простейшей переработки (известь) были известны людям с древних времен. В 1808 г. английский химик Хэмфри Дэви подверг электролизу влажную гашеную известь (гидроксид кальция) с ртутным катодом и получил амальгаму кальция (сплав кальция с ртутью). Из этого сплава, отогнав ртуть Дэви получил чистый кальций.
Он же предложил название нового химического элемента, от латинского «сalx» обозначавшего название известняка, мела и других мягких камней.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Нахождение в природе и получение:
Кальций — пятый по распространенности элемент в земной коре (более 3%), образует множество пород, в основе многих из которых — карбонат кальция. Некоторые из этих пород имеют органическое происхождение (ракушечник), показывающее важную роль кальция в живой природе. Природный кальций — смесь 6 изотопов с массовыми числами от 40 до 48, причем на 40 Ca приходится 97% общего количества. Ядерными реакциями получены и другие изотопы кальция, например радиоактивный 45 Ca .
Для получения простого вещества кальция используется электролиз расплавов его солей или алюмотермия:
4CaO + 2Al = Ca(AlO2)2 + 3Ca
Видео:Катион кальция Ca2+. Качественная реакция #химия #химияЕГЭ #химияОГЭСкачать

Физические свойства:
Серебристо-серый металл с кубической гранецентрированной решеткой, значительно более твердый, чем щелочные металлы. Температура плавления 842°C, кипения 1484°C, плотность 1,55 г/см 3 . При высоких давлениях и температурах около 20K переходит в состояние сверхпроводника.
Видео:Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)
Химические свойства:
Кальций не столь активен как щелочные металлы, тем не менее его приходится хранить под слоем минерального масла или в плотно запаянных металлических барабанах. Уже при обычной температуре он реагирует с кислородом и азотом воздуха, а также с водяными парами. При нагревании сгорает на воздухе красно-оранжевым пламенем, образуя оксид с примесью нитридов. Подобно магнию кальций продолжает гореть в атмосфере углекислого газа. При нагревании реагирует с другими неметаллами, образую не всегда очевидные по составу соединения, например:
Ca + 6B = CaB6 или Ca + P => Ca3P2 (а также CaP или CaP5)
Во всех своих соединениях кальций имеет степень окисления +2.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Важнейшие соединения:
Оксид кальция CaO — («негашёная известь») вещество белого цвета, щелочной оксид, энергично реагирует с водой («гасится») переходя в гидроксид. Получают термическим разложением карбоната кальция.
Гидроксид кальция Ca(OH)2 — («гашёная известь») белый порошок, мало растворим в воде (0,16г/100г), сильная щелочь. Раствор («известковая вода») используется для обнаружения углекислого газа.
Карбонат кальция CaCO3 — основа большинства природных минералов кальция (мел, мрамор, известняк, ракушечник, кальцит, исландский шпат). В чистом виде вещество белого цвета или бесцв. кристаллы, При нагревании (900-1000 С) разлагается, образуя оксид кальция. Не р-рим, реагирует с кислотами, способен растворяться в воде, насыщенной углекислым газом, переходя в гидрокарбонат: CaCO3 + CO2 + H2O = Ca(HCO3)2. Обратный процесс приводит к появлению отложений карбоната кальция, в частности таких образований, как сталактиты и сталагмиты
Встречается в природе также в составе доломита CaCO3*MgCO3
Сульфат кальция CaSO4 — вещество белого цвета, в природе CaSO4*2H2O («гипс», «селенит»). Последний при осторожном нагревании (180 С) переходит в CaSO4*0,5H2O («жжёный гипс», «алебастр») — белый порошок, при замешивании с водой снова образующий CaSO4*2H2O в виде твердого, достаточно прочного материала. Мало растворим в воде, в избытке серной кислоты способен растворяться, образуя гидросульфат.
Фосфат кальция Ca3(PO4)2 — («фосфорит»), нерастворим, под действием сильных кислот переходит в более растворимые гидро- и дигидрофосфаты кальция. Исходное сырье для получения фосфора, фосфорной кислоты, фосфорных удобрений. Фосфаты кальция входят также в состав апатитов, природных соединений с примерной формулой Са5[PO4]3Y, где Y = F, Cl, или ОН, соответственно фтор-, хлор-, или гидроксиапатит. Наряду с фосфоритом апатиты входят в состав костного скелета многих живых организмов, в т.ч. и человека.
Фторид кальция CaF2 — (природн.: «флюорит», «плавиковый шпат»), нерастворимое в-во белого цвета. Природные минералы имеют разнообразные окраски, обусловленные примесями. Светится в темноте при нагревании и при УФ-облучении. Увеличивает текучесть («плавкость») шлаков при получении металлов, чем обусловлено его применение в качестве флюса.
Хлорид кальция CaCl2 — бесцв. крист. в-во хорошо р-римое в воде. Образует кристаллогидрат CaCl2*6H2O. Безводный («плавленый») хлорид кальция — хороший осушитель.
Нитрат кальция Ca(NO3)2 — («кальциевая селитра») бесцв. крист. в-во хорошо р-римое в воде. Составная часть пиротехнических составов, придающее пламени красно-оранжевый цвет.
Карбид кальция CaС2 — реагирует с водой, к-тами образуя ацетилен, напр.: CaС2 + H2O = С2H2 + Ca(OH)2
Видео:Получение Оксида Кальция - CaO. Разложение Нитрата Кальция - Ca(NO3)2Скачать

Применение:
Металлический кальций используется как сильный восстановитель при получении некоторых трудновосстанавлиевых металлов («кальциетермия»): хром, РЗЭ, торий, уран и др. В металлургии меди, никеля, специальных сталей и бронз кальций и его сплавы используется для удаления вредных примесей серы, фосфора, избыточного углерода.
Кальций используется также для связывания малых количеств кислорода и азота при получении глубокого вакуума и очистке инертных газов.
Нейтрон-избыточные ионы 48 Ca используются для синтеза новых химических элементов, например элемента №114, флеровия >>. Другой изотоп кальция, 45 Ca , используется как радиоактивная метка при исследованиях биологической роли кальция и его миграции в окружающей среде.
Основной областью применения многочисленных соединений кальция является производство строительных материалов (цемент, строительные смеси, гипсокартон и т.д.).
🌟 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

хлорид кальция ; электролизСкачать