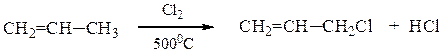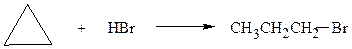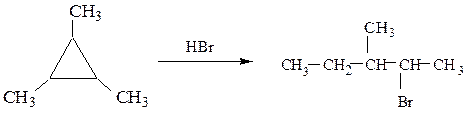Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Получение алкенов
Рассмотрим промышленные и лабораторные способы получения алкенов.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Видео:Уравнивание реакций горения углеводородовСкачать

2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
| Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен. |
Видео:Галогенопроизводные углеводородов: строение, свойства, получение, номенклатураСкачать

При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
| Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. |
| Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт. |
Видео:10 класс § 42 "Галогенопроизводные углеводородов".Скачать

4. Дегидратация спиртов
При нагревании спиртов (выше 140 о С) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
| Например, при дегидратации этанола при высокой температуре образуется этилен. |
Дегидратация более сложных молекул также протекает по правилу Зайцева.
| Например, при дегидратации бутанола-2 преимущественно образуется бутен-2. |
Видео:Реакции нуклеофильног замещения. Галогенпроизводные углеводородовСкачать

5. Дегалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов.
Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Видео:Галогенопроизводные углеводородов. ЕГЭ, химияСкачать

ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
К галогенопроизводным относятся органические соединения, молекулы которых кроме углерода и водорода содержат только атомы галогенов. Это один из самых реакционноспособных классов органических соединений. Они находят широкое применение в синтетической органической химии.
Классификация галогенопроизводных:
1) По типу углеводородного радикала они подразделяются на алифатические,
алициклические и ароматические (алифатические и алициклические могут
быть предельными и непредельными).
2) По природе атома галогена соединения подразделяются на фтористые,
хлористые, бромистые и йодистые.
3) По числу атомов галогена различают: моно-, ди-, полигалогенпроизводные.
Номенклатура. В основе систематических и рациональных наименований лежат названия соответствующих углеводородов. Галогенопроизводные несложного строения называют по соответствующим радикалам, а также по обычным правилам рациональной номенклатуры или номенклатуры IUPAC:
(CH3)2CHСl хлористый изопропил; 2-хлорпропан
СН2I2 йодистый метилен; дихлорметан
СH3CHF2 фтористый этилиден; 1,1-дифторэтан
ClCH2CH2CH2CH2Cl хлористый тетраметилен; 1,4-дихлорбутан
Полностью замещенные соединения получают приставку «пер-» :
Способы получения.Свободные галогенопроизводные в природе не встречаются. Они могут быть синтезированы из углеводородов уже рассмотренными способами или из других классов органических соединений.
I. Замещение водорода на галоген.
Прямое галогенирование возможно лишь для получения хлоридов и
В ароматических углеводородах в зависимости от условий может
замещаться водород в бензольном кольце или в боковой цепи:
Фторирование свободным фтором обычно приводит к полному
расщеплению молекулы углеводорода
Для получения фторзамещенных используют трехфтористый кобальт,
который, разлагаясь при нагревании, медленно выделяет фтор; при этом,
как правило, образуются перфторпроизводные:
Йод с насыщенными и ароматическими углеводородами не реагирует.
II. Реакции присоединения (подробно рассматривались при изучении свойств углеводородов).
1. Присоединение галогенов:
а) по двойной связи
б) по тройной связи
HC≡CH + Cl2 ¾® Cl–CH=CH–Cl ¾® Cl–CH–CH–Cl
1,2-дихлорэтен Cl Cl
в) к малым циклам
Галогенирование алкенов можно также осуществить путем замещения атома водорода в аллильном положении. Реакцию проводят при высокой температуре на свету. Реакция носит радикальный характер.
Аллильное бромирование алкенов удобно осуществлять по методу Воля – Циглера с помощью N-бромсукцинимида:
2. Присоединение галогеноводородов (НCl, HBr)
а) присоединение хлороводорода подчиняется правилу Марковникова
б) в присутствии пероксидов или даже кислорода воздуха бромоводород
присоединяется против правила Марковникова.
в) к циклопропану
III. Замещение гидроксильных групп на галоген.
а) Гидроксильная группа в спиртах (но не фенолах) замещается на
хлор или бром действием соответствующих галогеноводородов.
При получении галогенопроизводных по обменной обратимой реакции:
R–OH + H–X 
галогеноводороды используют в виде концентрированных кислот или газов. Реакционная способность спиртов в этой реакции уменьшается от третичных к первичным; замещение на бром протекает легче, чем на хлор (в случае HCl обычно дополнительно используют безводный ZnCl2), причем первичные спирты (за исключением бензилового и аллилового спиртов) с хлороводородом практически не взаимодействуют. Равновесие сдвигают вправо удаляя образующуюся воду добавлением веществ, связывающих ее или азеотропной отгонкой.
Йодоводород в условиях реакции восстанавливает гидроксильную группу.
Недостатки метода: обратимость замещения, побочные реакции
б) Значительно легче реагируют спирты с галогенидами фосфора
R–OH + P + I2 ¾® R–I (низкий выход) + P(OH)3
Удобным реагентом для замещения гидроксильной группы на хлор
является хлористый тионил
этиленгликоль 2-хлорэтанол-1 1,2-дихлорэтан
Галогениды фосфора замещают также атом кислорода карбонильной
группы в альдегидах (Rٰ = H) и кетонах на два атома галогена
пропионовый альдегид 1,1-дихлорпропан
IV. Замещение аминогруппы на галоген.
1. В алифатических аминах осуществляется действием хлористого или
2. В ароматических аминах через соли диазония по реакции Зандмейера:
Этим методом удается получать ароматические йодиды, недоступные йодированием аренов:
При термическом разложении борфторидов солей арилдиазония
получают ароматические фторпроизводные (реакция Шимана):
V. Замещение одного галогена другим.
Метод используется для получения труднодоступных фторидов и йодидов
R–Cl + AgF ¾® R–F + AgCl ↓
Равновесие сдвинуто вправо, т.к. серебряные соли более тяжелых галогенов
хуже растворимы в спирте, ацетоне и других растворителях
R–Cl + NaI ¾® R–I + NaCl ↓
Напротив, NaI гораздо лучше растворим в ацетоне, чем NaBr или NaCl.
VI. Алкилгалогениды можно синтезироватьдействием галогена насеребряные или ртутные соли карбоновых кислот (реакция Бородина-Хунсдиккера).
Физические свойствагалогенопроизводных зависят от природы, числа атомов галогена в молекуле и длины углеводородного радикала. Температура кипения, плавления и плотности фторпроизводных мало отличаются от свойств соответствующих углеводородов. Эти характеристики резко возрастают в ряду R–F → R–Сl → R–Br → R–I и с количеством атомов хлора, брома и йода.
Газообразными при комнатной температуре являются CH3F, CH2F2, CHF3, CF4, C2H5F, C3H7F, FCH2CH2F, CH3CHF2, CH3Cl, C2H5Cl (т.кип. +12 0 С), CH3Br (т.кип. +3 0 С). Удлинение углеводородного радикала на одну СH2-группу, в среднем, повышает температуру кипения на 30 0 С (та же зависимость наблюдается в ряду алканов). Плотность же галогеналканов при этом снижается. Монофтор- и монохлорзамещенные легче воды, бромиды и йодиды
тяжелее (CH3I 2,3 г/cм 3 ; CH2I2 3,3 г/cм 3 ; CHI3 4,0 г/cм 3 ; CI4 4,3 г/cм 3 ; последниедва вещества представляют собой кристаллические соединения;
йодистый метилен – самая тяжелая органическая жидкость). Все галогено-производные легко растворимы друг в друге, в углеводородах, эфирах; не растворяются в воде. Хлориды широко применяются в качестве растворителей. Низшие галогенопроизводные обладают сладковатым запахом и наркотическим действием. Хлористый этил применяется для местного обезболевания. Не огнеопасны. Полигалогениды, например четыреххлористый углерод, благодаря большой летучести и высокой плотности паров можно использовать для тушения пожаров. Большинство галогенопроизводных токсичны, хлориды применяются в качестве инсектицидов, перфторпроизводные – безвредны. Легкие фториды – фреоны, например фреон 12 (CF2Cl2) используются в качестве хладоагентов, они не оказывают вредного действия при контакте с пищевыми продуктами. Испытывался в качестве заменителя крови перфтор-1-метилдекалин. Он хорошо растворяет кислород и углекислый газ (даже лучше, чем кровь), не поражает кроветворные органы, выводится через легкие.
Перфторполимеры, например, перфторполиэтилен (тефлон) химически очень инертны, устойчивы в любых агрессивных средах. Весьма ценными свойствами обладают фторкаучуки, однако стоимость их очень высока.
Химические свойства
Типичные реакции галогенопроизводных обусловлены наличием в молекуле полярной связи. Полярность связи под влиянием реагентов и растворителей может увеличиваться в результате поляризуемости. Поляризуемость связи тем больше, чем больше объем и подвижность электронной оболочки атома,образующего связь. При этом также возрастает длина связи и уменьшается ее прочность. Большинство реакций галогенопроизводных протекают с разрывом этих связей.
Таблица 9. Свойства σ-связей углерода с галогенами.
| C — F | C — Cl | C — Br | C — I | |
| Длина связи (А) Энергия связи (ккал/моль) | 1,33 | 1,76 | 1,94 | 2,18 |
Таблица 10. Физические свойства галогенопроизводных углеводородов
| Название | Формула | Т . пл., ºС | Т. кип., ºС | ρ, г· см -3 |
| Хлористый метил Бромистый метил Йодистый метил Хлористый этил Бромистый этил Йодистый этил Хлористый пропил Бромистый пропил Бромистый изопропил Хлористый бутил Бромистый бутил Йодистый бутил Бромистый изобутил Бромистый третбутил Хлористый пентил Бромистый пентил Йодистый пентил Хлористый гексил Бромистый гексил Йодистый гексил Хлористый октил Бромистый октил Йодистый октил Хлористый винил Бромистый винил Бромистый аллил Хлористый метилен Бромистый метилен Йодистый метилен Хлороформ Бромоформ Йодоформ Тетрахлорид углерода Тетрабромид углерода Тетрайодид углерода 1,2-дихлорэтан 1,2-дибромэтан 1,2-дийодэтан 1,1-дихлорэтан 1,1-дибромэтан 1,1-дийодэтан Тетрахлорэтан | CH3Cl CH3Br CH3I CH3CH2Cl CH3CH2Br CH3CH2I CH3CH2CH2Cl CH3CH2CH2Br (CH3)2CHBr CH3CH2CH2CH2Сl CH3CH2CH2CH2Br CH3CH2CH2CH2I (CH3)2CHCH2Br (CH3)3CBr CH3(CH2)3CH2Cl CH3(CH2)3CH2Br CH3(CH2)3CH2I CH3(CH2)4CH2Cl CH3(CH2)4CH2Br CH3(CH2)4CH2I CH3(CH2)6CH2Cl CH3(CH2)6CH2Br CH3(CH2)6CH2I СH2=СH–Сl СH2=СH–Br СH2=СH–CH2Br СH2Cl2 СH2Br2 СH2l2 СHCl3 СHBr3 CHI3 CCl4 CBr4 CI4 Cl CH2CH2Сl BrCH2CH2Br ICH2CH2l CH3CHСl2 CH3CHBr2 CH3CHI2 Cl2CHCHСl2 | — 97 — 93 — 64 — 139 — 119 — 111 — 123 — 110 — 89 — 123 — 112 — 103,5 — 120 — 20 — 99 — 88 — 86 — 83 — 85 ─ — 160 — 138 — 119 — 97 — 53 — 63,5 ─ 171 (разл) — 35 — 10 — 97 ─ ─ — 42,5 | — 24 4,5 59,5 101,5 132,4 — 14 180 (разл) 61,5 149,5 210 (разл) 76,5 189,5 90 (возг) разл. | 0,920 1,732 2,279 0,910 1,430 1,933 0,890 1,353 1,310 0,884 1,300 1,617 1,250 1,223 0,883 1,246 1,517 0,872 1,173 1,441 0,969 1,517 1,398 1,336 2,495 3,325 1,500 2,890 4,008 1,595 3,42 4,32 1,257 2,170 2,132 1,174 2,089 2,840 1,602 |
I. Реакции замещения
1. Восстановление (замещение галогена на водород) может быть осуществлено каталитическим гидрированием или действием алюмогидридом лития LiAlH4 , боргидрид натрия NaBH4 и других восстановителей.
2. Гидролиз (замещение галогена на гидроксил)
Реакцию обычно проводят в щелочной среде. Равновесие полностью
сдвинуто вправо за счет связывания галогеноводорода щелочью
Геминальные дигалогенопроизводные (содержащие два атома галогена
при одном углеродном атоме) при этом образуют альдегиды или кетоны.
Геминальные тригалогенопроизводные гидролизуются легче, даже в
R–C– R’ + 2 H2O ¾® [ R–C– R’ ] ¾¾® R–C– R’
3. Реакции с алкоголятами (фенолятами) щелочных металлов (образование
простых эфиров по Вильямсону)
этилат натрия хлористый пропил этилпропиловый эфир
С этой реакцией конкурирует реакция отщепления галогеноводорода.
4. Образование сложных эфиров. Классической реакцией является взаимо-
действие галогеналканов с серебряными солями карбоновых кислот:
бромистый пропил ацетат серебра пропиловый эфир
Возможно также применение солей щелочных металлов в полярных
5. Образование меркаптанов и дисульфидов. Галогеналканы легко взаимо-
действуют с сульфидами и гидросульфидами щелочных металлов:
бромистый изобутил изобутилмеркаптан
6. Взаимодействие с аммиаком и аминами.
Реакция широко используется для синтеза аминов
Взятый в большом избытке аммиак связывает образующийся галогено-водород ( NH3 + HI ¾® NH4I). Галогеноводород может также связываться избытком исходного амина или добавлением щелочного реагента.
7. Получение нитросоединений. Галогеналканы взаимодействуют с нитритами серебра или щелочных металлов в полярных растворителях
В сольватирующих растворителях (вода, спиртах) могут образовываться также нитриты R–O–N=O (эфиры азотистой кислоты).
8. Реакция с цианидами позволяет удлинить в молекуле цепочку углеродных атомов
нитрил масляной кислоты
Реакция с солями серебра дает, преимущественно изонитрилы.
9. Алкилирование ароматических соединений. Галогеналканы алкилируют бензол в присутствии хлорида алюминия (реакция Фриделя – Крафтса)
10. Замещение галогена галогеном (см. с. 82). Реакция применяется для получения фторидов и йодидов из более доступных хлоридов и бромидов.
Основные превращения галогенопроизводных углеводородов см. на схеме
Нетрудно заметить, что во всех реакциях связь между углеродом и новым заместителем образуется за счет пары электронов, предоставленной этим заместителем, а электронная пара разрывающейся связи С–Hal уходит с анионом галогена.
При реакции происходит атака нуклеофильной частицы, поставляющей электронную пару ( ¯ OH, ¯ OR, ¯ CN, :NH3 , Hal ¯ , NO2 ¯ и др. на атом углерода. Такие реакции называются реакциями нуклеофильного замещения SN (substitution nucleofilic).
Для реакций замещения галогена при насыщенном атоме углерода достоверны два механизма SN1 иSN2. Особенно хорошо они изучены на примере реакции гидролиза.
Нуклеофильное замещение первого порядка (SN1).
Скорость реакции гидролиза может быть пропорциональна концентрации галогеналкана в первой степени и не зависить от концентрации щелочи
Рассмотрим механизм этой реакции. Скорость реакции определяется скоростью наиболее медленной ее стадии. Следовательно в медленной стадии ионы гидроксила участия не принимают. На первой, медленной стадии происходит диссоциация молекулы галогенопроизводного на анион галогена и карбкатион.
Вторая, быстрая стадия заключается в присоединении к карбкатиону иона гидроксила или молекулы воды. Суммарная скорость реакции не изменяется.

Нуклеофильное замещение второго порядка (SN2).
Скорость реакции прямо пропорциональна и концентрации галогеналкана и нуклеофила. Следовательно в медленной стадии принимают участие оба реагента
На медленной стадии образуется переходное состояние, от которого быстро отщепляется анион галогена.
Порядок реакции нуклеофильного замещения определяется:
1) стабильностью соответствующего карбкатиона;
2) доступностью атома углерода для атаки нуклеофильной частицей.
Известно, что третичные карбкатионы наиболее стабильны, а первичные – наименее. Первичные же атомы углерода наиболее доступны для атаки, а третичные – наименее из-за пространственных затруднений. Естественно, что замещение у третичного атома углерода должно идти по механизму SN1, а у первичного – по SN2. Так оно на самом деле и происходит. Замещение же при вторичном атоме углерода может идти и по SN1, и по SN2, и по двум механизмам одновременно. Скорость реакции, как правило, ниже, чем в случае третичных или первичных галогеналканов.
Механизм реакции изучают, исследуя ее кинетику и стереохимию.
Стереохимия механизма SN1.
Промежуточно образующийся карбкатион имеет плоское строение, поэтому подход нуклеофила и его присоединение равновероятно с обеих сторон. Если возможно образование двух пространственных изомеров, то они образуются в примерно равных количествах

Мономолекулярные реакции часто осложняются побочными процессами, связанными со склонностью карбокатионов к перегрппировкам.
Так, гидролиз 1-хлор-2-метилпропана в результате 1,2-гидридного сдвига приводит не к 2-метилпропанолу-1, а к трет-бутанолу.
Стереохимия механизма SN2. В переходном состоянии центральный атом углерода и три заместителя лежат в одной плоскости. Естественно, нуклеофильная частица подходит со стороны, противоположной атому галогена. В случае, если возможно образование пространственных изомеров, то образуется лишь один из них.
транс-2-хлор-1- переходное цис-2-метилцикло-
метилциклопентан состояние пентанол-1
Происходит полное обращение конфигурации.
В некоторых примерах реакций SN возможны два направления протекания процесса, приводящие к образованию различных веществ. Это происходит благодаря способности некоторых нуклеофилов проявлять амбидентные свойства, т.е. обладать в зависимости от условий реакции двойственной реакционной способностью. Так, результат нуклеофильной атаки нитрит-анионом 
Подобно нитрит-аниону NO2 — двойственной реакционной способностью, обладает также цианид-анион имея два нуклеофильных центра, различающихся по основности: 
Материал, изложенный выше, относился к замещению галогена у насыщенного углеродного атома. Атомы галогена, находящиеся у ненасыщенного атома углерода (в состоянии sp 2 или sp-гибридизации), значительно менее подвижны. Связь С–Hal короче и прочнее связи в насыщенных галогенопроизводных, благодаря эффекту сопряжения. К группе галогенопроизводных с пониженной реакционной способностью принадлежат арилгалогениды, в которых атом галогена связан непосредственно с углеродом ароматического цикла. Галогены обладают положительным мезомерным эффектом (+М), находятся в сопряжении с ароматическим кольцом и электронная плотность частично втянута в цикл. Связь углерод-галоген частично двойная, значительно прочнее связи углерод (sp 3 )-галоген.

Напротив, реакционная способность атома галогена в аллильном положении очень высока. Замещение его всегда идет по механизму SN1.
В карбкатионе положительный заряд компенсируется наполовину сдвигом
π-электронов соседней двойной связи CH2 ¼ CH ¼ CH2 поэтому равно-вероятно присоединение и к 1- и к 3-атомам углерода. В более сложных соединениях может образоваться смесь изомерных продуктов замещения.
-NaCl нитрил 3-пентеновой нитрил 2-метил-3-
кислоты -бутеновой кислоты
Вследствие сопряжения неподеленной пары электронов с единым π-электронным облаком атом галогена в бензольном ядре наиболее инертен. Замещение в мягких условиях может проходить лишь при наличии в ядре активирующих заместителей.
Здесь реализуется механизм нуклеофильного замещения второго порядка, но переходное состояние внешне напоминает σ-комплекс в электрофильном замещении. Такой механизм принято называть SN2 (аром.). Сильные акцепторы поляризуют бензольное кольцо, наводя положительный заряд в о— и п-положениях. Фтор в меньшей степени, чем другие галогены способен компенсировать δ+ за счет +С-эффекта, поэтому влияние на его подвижность заместителей-акцепторов наиболее сильно
Поскольку галогеноарены – соединения с низкой реакционной способностью – реакции нуклеофильного замещения, характерные для насыщенных галогенопроизводных, в этом ряду не имеют такого большого значения.
В отсутствие электронодонорных заместителей атомы галогенов в бензольном ядре замещаются на гидроксил только в весьма жестких условиях.
пара-Нитрохлорбензол вступает в аналогичную реакцию уже при 160 о .
Еще легче протекает замещение галогена в ди- и тринитрохлорбензолах.
Также в жестких условиях, в присутствии катализатора Ульмана (мелкораздробленная медь) протекают и другие реакции замещения галогена.
Замещение атома хлора и брома на аминогруппу происходит под действием амида натрия в жидком аммиаке.
В боковой цепи ароматических галогенопроизводных атом галогена, удаленный от ядра, обладает нормальной подвижностью галогена в предельных соединениях. В α-положении к ядру галоген особенно подвижен. Замещение его всегда идет по механизму SN1.
При диссоциации образуется один из самых стабильных карбкатионов, где заряд компенсируется сдвигом π-электронного облака.
Итак, можно написать два ряда сравнительно подвижности атома галогена в молекулах галогенопроизводного (реакционная способность в приведенных рядах падает слева направо):
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🌟 Видео#34. Химические свойства спиртов. Реакции замещения.Скачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Урок № 8 Галогенпроизводные углеводородовСкачать  Галогенпроизводные углеводородов. КлассификацияСкачать  Химия 10 класс. Введение галогенопроизводные углеводородовСкачать  Химия 9 класс (Урок№30 - Производные углеводородов. Спирты.)Скачать  Галогеналканы. Химические свойства. 10 класс.Скачать  Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать  ХИМИЯ ЕГЭ 2023 Задание 16 Галогенпроизводные алканов Окисление спиртов Органическая химия ВидеоурокСкачать  6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Генетическая связь углеводородов, спиртов, альдегидов и карб. кислот | Химия 10 класс #33 | ИнфоурокСкачать  |