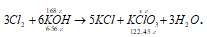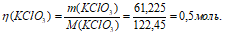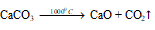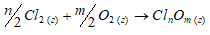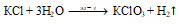Хлорная известь представляет собой химический высококачественный раствор, состоящий из смеси бесцветных кристаллов основной соли гипохлорита кальция Ca(ClO)2, гашеной извести Ca(OH)2 и кальциевой соли соляной кислоты CaCl2. Интересно, что делать отбеливающий порошок из хлора придумал английский химик Charles Tennant в далеком 1799 году.
Видео:Получение ХЛОРНОЙ КИСЛОТЫ и не только!Скачать

Хлорная известь — применение
Прежде всего, известь хлорная ГОСТ 9179 77 является дезинфицирующим средством. Дезинфекция обеспечивается использованием препарата в сухом агрегатном состоянии. Кроме этого, возможны следующие варианты применения:
- в виде кашицы. Для этого 1 долю активного вещества разводят 3 частями жидкости
- хлорного молока. Такое молоко готовится из 1 части извести и 9 частей воды
- присыпки. Для этого берется 1 часть хлорки на 2 части талька
- хлорных таблеток, которыми удобно обеззараживать воду.
Перед использованием стоит помнить, что сухая хлорная известь активна по отношению к ряду возбудителей бактериальной инфекции или другой болезнетворной микрофлоры исключительно в том случае, если ее нанести на сырую поверхность. Обработка хлорной известью сухой плоскости не имеет ни малейшего смысла. Также не забывайте о правилах работы с данным веществом, так оно является высокотоксичным и едким.

- рабочую плоскость, стенки и мебель в абсолютно всех лечебных учреждениях
- деревья и кустарники в садоводстве
- транспорт, в котором перевозят животных
- в уборных, как общественных, так и дома
- посуда, которой пользовались инфекционные больные.
- На основе хлорной извести создают:
- пестициды
- обеззараживающие соединения
- вещества для мытья и отбеливающие препараты
- медикаменты
- средства для цветной металлургии.
Видео:Гипохлорит Кальция 65 (Хлор, Хлорная известь)Скачать

Раствор хлорной извести
Чтобы сделать раствор для дезинфекции дома нужно развести 10% осветленный состав препарата. Вам понадобится килограмм вещества, к которому нужно прилить небольшой объем слегка теплой воды. Перемешивать этот состав стоит деревянной лопаткой. Когда масса станет однородной можно добавить воды до метки десять литров. После этого полученный раствор нужно прикрыть и оставить на 24 часа в темной месте.
Такой концентрированный раствор хранится не более 6 суток. Чтобы сделать рабочий раствор, нужно развести водой заранее приготовленный концентрированный раствор. Например, если вам нужно приготовить раствор с концентрацией 0,2%, то вам понадобится 200 миллилитров 10% раствора хлорной извести и 10 л воды.
Рабочий раствор хлорной извести любой концентрации нужно использовать за один день. Какую концентрацию раствора выбрать для обработки конкретной поверхности? Приведем несколько примеров:
- 0,2% раствор подходит для ликвидации возбудителей инфекционных заболеваний на инвентаре
- от 0,2 до 0,5% раствором можно обрабатывать используемое оборудование
- 1% состав подходит для устранения возбудителей заразных заболеваний на полу, стенах, дверях, деревянном полу
- 2% раствор можно использовать для уборочных инструментов, салона автотранспорта
- 5% раствором очищают сантехнические изделия
- 10% раствором проводят дезинфекцию ванной и туалета.
В порошкообразной форме содержится около 28% активного хлора. Обеззараживающие свойства химического вещества могут быть усилены при помощи добавления особого активатора, в качестве которого может выступать гидроксида аммония. Такой раствор будет обладать наиболее эффективными бактерицидными свойствами.
Видео:Как сделать хлорку (хлорную известь)самомуСкачать

Техника безопасности
По уровню влияния на организм хлорку относят к токсичным веществам. Емкости, в которых находится хлорка, при нагревании могут воспламениться. Кроме этого, к взрыву приводит связь элемента с нефтепродуктами, а также удар и трение.
По окончанию дезинфекции хлорсодержащими веществами стоит обязательно проветрить помещение. Перед началом работы нужно обязательно ознакомиться с инструкцией по использованию хлорной извести.
В обязательном порядке нужно использовать средства индивидуальной защиты:
- перчатки
- респираторы
- специальные защитные очки
- прорезиненные фартуки.
При попадании на кожу и слизистые оболочки возможно возникновение неприятных болевых ощущений, отека и поверхностных язв различного размера. Если такое вещество попадет в дыхательные пути, то человек почувствует одышку, ему будет трудно дышать, а также будет першить горло. В тяжелых случаях наблюдается обильное слезоотделение, боль в животе, тошнота и пожелтение дермы.
Первая помощь заключается в немедленном промывании обильным количеством воды всей пораженной поверхности тела, включая глаза и носоглотку. После этого, потерпевшего нужно вывести на улицу и напоить молоком до приезда скорой помощи.
Видео:❗️МОЙ СЕКРЕТНЫЙ МЕТОД ВОССТАНОВЛЕНИЯ ОРХИДЕЙ МЕТОД 12/12 И ОРХИДЕЯ БЕЗ КОРНЕЙ С ЛИСТЬЯМИ-ТРЯПОЧКАМИ!Скачать

Хлорная известь — получение
Хлорную известь получают в результате реакции взаимодействия газообразного хлора с сухой гидроокисью кальция, или как ее иначе называют — гашеной известью Са(ОН)2.
Полученный хлор в процессе электролиза раствора NaCl подвергают разбавлению воздухом. Подающийся на хлорирование газ чаще всего содержит 40—50% СI2. Допустимое содержание в газе Н2 и С02 менее 1,5% и 0,4% соответственно, из расчета на 90—98%ный газ по хлору. Объем влаги не должен превышать 0,06%.
Гашеную известь делают из порошкообразной извести, в которой содержится много кальция.
Полноценный цикл производства хлорной извести включает следующие этапы:
- обжиг известняка
- получение пушонки (гашение извести)
- хлорирование пушонки.
Известь получается в процессе обжига известняка или мела в условиях 950—1100°градусов. Известняк – это более плотная порода, по сравнению с мелом, который имеет существенную пористость и высокий уровень влажности – 90%.
Для обжига берут известняк с размерами кусков от 70 до 120 мм. В нем должно присутствовать как минимум 91% СаСОз, а также максимум 1,7% MgC03 и 0,2% R203. Примерно 1% примесей в известняке в результате обжига даст практически 2% примесей в обожженной извести. Определенные натуральные высокосортные известняки имеют в своем составе:
97—95% СаС03
1 — 1,5% MgCO3
0,2—0,5% CaS04
0,2—0,5% нерастворимых веществ
0,8—1% влаги
0,1—0,2% FeSO3
0,2—0,4% АI203
0,3—0,5% Si02
0,2—0,4% прочих добавок.
В процессе обжига известняка наблюдается реакция диссоциации карбоната кальция:
Требуемое количество тепла достигается путем сжигания кокса или иных типов топлива. При этом, в коксе должно присутствовать не более: 0,7% S, 12% влаги, 5% золы, и 1,7% летучих соединений. Твердое топливо используют кусками с размерами 40—60 мм.
Процесс диссоциации известняка происходит с достаточной полнотой уже при 900°. Тем не менее, чтобы ускорить обжиг температура в самой горячей зоне должна быть в пределах 1000—1100°. Если температура будет более низкой, то часть известняка внутри крупных кусков не успеет разложиться и получится «недожог» или «недопал», который ухудшает качество конечного продукта и увеличивает объем отходов при ее гашении.
В тоже время более высокая температура также не приносит пользы процессу. Она является причиной оплавления кусков извести в результате присутствия внутри известняка и золы угля примесей кремнезема, окислов железа, алюминия, магния и других, которые образуют легкоплавкие силикаты. Известь подобного состава медленно поддается гашению водой, а часть ее вместе с «недопалом» отсеивается по окончанию гашения от дисперсной пушонки в виде крупных не успевших загаситься кусочков «пережога» или «перепала».
Процесс обжига известняка проводится в шахтных пересыпных печах, а также в печах с выносными топками. Минимальный объем загрязнения обожженной извести золой и несгоревшими кусочками топлива наблюдается в печах с выносными топками (газовые печи). Такие устройства обладают существенными достоинствами перед пересыпными печами в результате возможности использования более бюджетных типов топлива (в сравнении с коксом и антрацитом).
Далее хлор вступает во взаимодействие с гашёной известью:
Фактически мы получаем продукт, который представляет собой смесь соединений, состоящих из молекул Ca(OCl)2, CaCl2, Ca(OH)2 и кристаллизационной воды. В том случае, если изначально был взят довольно чистый гидроксид, а обработку хлором проводили до полного насыщения, то состав свежеприготовленной хлорной извести будет выглядеть следующим образом:
Видео:Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Лабораторный и промышленный способы получения хлората калия. Получение хлорной извести
Задача 827.
Рассчитать, какое количество бертолетовой соли можно получить из 168 г гидроксида калия.
Решение:
М(КОН) = 56 г/моль, m(KOH) = 6 . 56 = 336 г;
М(KClO3) = 122,45 г/моль, m(KClO3) = 122,45 г.
Уравнение реакции имеет вид:
Находим массу бертолетовой соли из пропорции:
168 : 336 = х : 122,45; х = (168 . 122,45)/336 = 61,225 г.
Количество бертолетовой соли рассчитаем из уравнения:
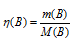
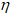
m(B) — масса вещества, г;
M(B) — молярная масса вещества (В), г/моль.
Ответ: m(KClO3) = 61,225 г; М(KClO3) = 0,5 моль.
Задача 828.
Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Написать уравнения процессов, которые необходимо для этого осуществить. Какие при этом получаются побочные продукты?
Решение:
Получение хлорной извести, исходя из карбоната кальция, хлорида натрия и воды.
а) При нагревании в 1000 0 С карбонат кальция разлагается на оксид кальция и углекислый газ:
б) Оксид кальция, растворяясь в воде, образует гидроксид кальция:
в) Электролизом водного раствора хлорида натрия можно получить хлор, который выделяется у анода:
у катода: 2Н2О + 2 
у анода: 2Cl — +2 
г) При действии хлора на гашеную известь получается так называемая белильная (или хлорная) известь и вода:
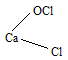
CaOCl2 соответствует структурная формула:
Хлорная известь применяется для отбелки растительных волокон (тканей, бумаги) и для дезинфекции.
Задача 829.
Обосновать невозможность получения оксидов хлора непосредственным взаимодействием хлора с кислородом.
Решение:
Хлор непосредственно не взаимодействует с кислородом. Это обусловлено небольшой энергией связи Cl—O и невозможностью использования высоких температур для осуществления реакций:
Для них 



2Cl2(г) + О2(г) → 2Cl2O; 
Из данного уравнения реакции видно, что процесс идёт с поглощением теплоты. Так как 

Исходя из уравнения:



При положительном значении дельта 






Задача 830.
Указать лабораторный и промышленный способы получения хлората калия.
Решение:
а) В лаборатории хлорат калия получают электролизом горячего раствора КCl:
При охлаждении раствора хлорат калия выпадает в осадок, так как мало растворим в холодной воде.
б) В промышленности хлорат калия получают пропусканием хлора в горячий раствор гидроксида калия:
3Cl2 + 6KOH 
Поскольку хлорат калия (или бертолетовая соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Видео:Хлорная известь различной фасовки оптом и в розницу в компании Аквахим!Скачать

Хлорная известь
Хлорная известь (белильная известь, в просторечии хлорка) — техническая смесь гипохлорита, хлорида и гидроксида кальция.
Процесс производства отбеливающего порошка из хлора и гашёной извести изобретён в 1799 году Чарльзом Теннантом (англ. Charles Tennant ; 3 мая 1768 — 1 октября 1838) — британским химиком и предпринимателем.
ГОСТ Р 54562-2011
Видео:Получение реактива на золото. В домашних условиях легко!Скачать

Содержание
Видео:Хлороводородная кислота. 9 класс.Скачать

Получение
Получают взаимодействием хлора с гашёной известью (гидроксидом кальция):
Реальный продукт, получаемый хлорированием гидроксида кальция, является смесью соединений, образованных молекулами Ca(ClO)2, CaCl2, Ca(OH)2 и кристаллизационной воды. Если исходный гидроксид был достаточно чистым, а обработка хлором велась до полного насыщения и с соблюдением температурного режима, то состав свежеприготовленной хлорной извести может быть довольно точно выражен формулой Ca(OCl)2·CaCl2·Ca(OH)2·2H2O, которую для большего удобства можно формализовать как 3Ca(OH)2·2Cl2.
Видео:Часть 2 ! РЕЗУЛЬТАТ !!! НЕОБЫЧНОГО УКОРЕНЕНИЯ !!! Завершаем наш эксперемент !Скачать

Свойства
При обычных условиях хранения хлорная известь медленно разлагается, в основном, по схеме:
2Ca(Cl)OCl + CO2 ⟶ CaCl2 + CaCO3 + Cl2O↑ , теряя при этом около 5 % активного хлора в год. Под действием влажного воздуха, содержащего углекислый газ, хлорная известь превращается в хлорноватистую кислоту. 2Ca(Cl)OCl + CO2 + H2O ⟶ CaCl2 + CaCO3 + 2HOCl↑ При действии соляной кислоты на хлорную известь выделяется хлор. Ca(Cl)OCl + 2HCl ⟶ CaCl2 + Cl2 + H2O 2Ca(Cl)OCl ⟶ 2CaCl2 + O2↑ , термическое разложение CaCl(OCl) + H2SO4 ⟶ CaSO4 + H2O + Cl2
В растворе (при нагревании или на свету), содержащийся в смеси гипохлорит подобно другим гипохлоритам диспропорционирует:
3Ca(OCl)2 ⟶ Ca(ClO3)2 + 2CaCl2
Видео:Приготовление дезинфицирующих растворовСкачать

Применение, опасность применения
Широко используется для отбеливания и дезинфекции, а также для удаления известкового налёта.
В прошлом применялась в промышленной добыче золота методом хлоринационного выщелачивания. Выделяющийся при реакции гипохлорита кальция и соляной кислоты хлор реагировал с золотом с образованием водорастворимых хлоридов золота.
Хлорная известь — едкое, коррозионно-активное вещество. Гипохлорит и гидроксид кальция относятся ко 2-му классу опасности (высокоопасные вещества).
🎬 Видео
СТАЛ ИЗВЕСТЕН СПОСОБ ПОЛУЧИТЬ ХЛОРЕЛЛУ БЕСПЛАТНО! Доступно абсолютно каждому! БЕЗ ЗАКВАСКИ!Скачать

Как получить золото из камня...Самый эффективный способ(хлорирование)...GOLDEN CHANNEL...Скачать

Как приготовить рабочий раствор?Скачать

Получение Хлора. Красивые опыты.Скачать

Получение хлорида железа 3Скачать

Сибирь. Обзор всходов цветов.Скачать

Задачи на примеси. 1 часть. 9 класс.Скачать

оказался ЖИВОТВОРЯЩИЙ для корней орхидеи // орхидеи после пересадкиСкачать

Добываем Золото ХлоромСкачать

ЗОЛОТО ИЗ РУДЫ С ПОМОЩЬЮ "БЕЛИЗНЫ" и "ЭЛЕКТРОЛИТА"! ПРОСТОЙ СПОСОБ ДОБЫЧИ ЗОЛОТА БЫТОВЫМИ СРЕДСТВАМИСкачать