гидроксид аммония представляет собой соединение NH молекулярной формулы4ОН или Н5НЕ производится растворением газообразного аммиака (NH3в воде. По этой причине он получает названия аммиачной воды или жидкого аммиака.
Это бесцветная жидкость с очень интенсивным и острым запахом, которая не изолирует. Эти характеристики имеют прямую связь с концентрацией NH3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может покрывать его огромное количество, растворенное в небольшом объеме воды.
Значительно небольшая часть этих водных растворов состоит из катионов NH.4 + и ОН-анионы — . С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак можно найти в форме гидратов, таких как: NH3∙ H2О, 2НХ3∙ H2O и NH3H 2H2О.
Любопытно, что облака Юпитера образованы разбавленными растворами гидроксида аммония. Однако космическому зонду Galileo не удалось обнаружить воду в облаках планеты, что можно было бы ожидать из знания того, что известно образование гидроксида аммония; то есть они кристаллы NH4ОН абсолютно безводный.
Ион аммония (NH4 + ) вырабатывается в просвете почечных канальцев путем соединения аммиака и водорода, секретируемых клетками почечных канальцев. Аналогичным образом, аммоний вырабатывается в клетках почечных канальцев в процессе превращения глютамина в глутамат и, в свою очередь, при превращении глутамата в α-кетоглутарат..
Аммиак производится промышленным способом по методу Хабера-Боша, в котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакцию проводят при высоких давлениях (150-300 атмосфер) и высоких температурах (400-500 ºC) с выходом 10-20%..
В реакции образуется аммиак, который при окислении производит нитриты и нитраты. Они необходимы при получении азотной кислоты и удобрений, таких как аммиачная селитра.
- 1 Химическая структура
- 1.1 Аммиачный лед
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешний вид
- 2.4 Концентрация
- 2.5 Запах
- 2.6 Вкус
- 2.7 Пороговое значение
- 2.8 Точка кипения
- 2.9 Растворимость
- 2.10 Растворимость в воде
- 2.11 Плотность
- 2.12 Плотность пара
- 2.13 Давление пара
- 2.14 Коррозионное действие
- 2,15 рН
- 2.16 Константа диссоциации
- 3 Номенклатура
- 4 Растворимость
- 5 рисков
- 5.1 Реакционная способность
- 6 использует
- 6.1 В еду
- 6.2 Терапия
- 6.3 Промышленное и разное
- 6.4 В сельском хозяйстве
- 7 ссылок
- Химическая структура
- Аммиачный лед
- Аммиачная вода: получение, формула, применение
- Образование иона аммония
- Меры предосторожности
- Получение гидроксида аммония. Физические свойства
- Химические свойства гидроксида аммония
- Аммиачная вода: применение в разных отраслях хозяйства
- Соли аммония: свойства и практическое значение
- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- 🔥 Видео
Видео:Аммиак. 9 класс.Скачать

Химическая структура
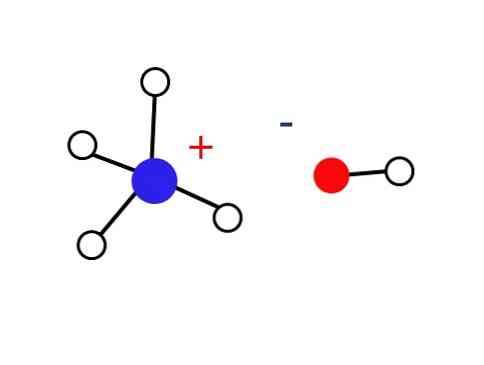
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4 + и ОН — сольватированные молекулами воды.
Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
По этой причине ионы NH4 + и ОН — им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака.
Видео:Аммиак и соли аммония. 11 класс.Скачать

Аммиачная вода: получение, формула, применение
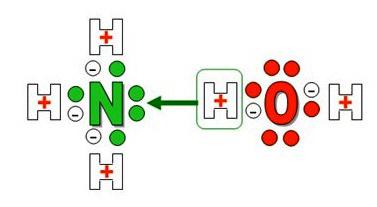
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Видео:Гидрат аммиака (гидроксид аммония) и его свойства. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Образование иона аммония
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Видео:Как составить формулы гидроксидов и соответствующих им оксидов I ЕГЭ по химииСкачать

Получение гидроксида аммония. Физические свойства
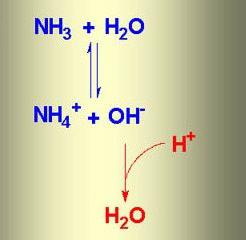
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Видео:Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Видео:Химические свойства не растворимы оснований, гидроксида аммония и амфотерных оснований, 11 подг-ка.Скачать

Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
🔥 Видео
Гидролиз солей. 9 класс.Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Аммиак. Химия 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Решение цепочек превращений по химииСкачать

Щёлочи: химические свойства и способы получения #основания #гидроксиды #щелочи #химшкола #видеоурокСкачать