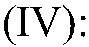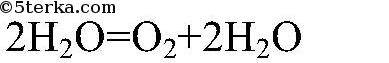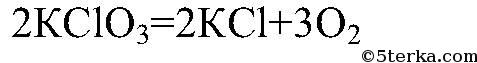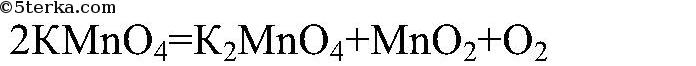Запишите уравнения реакций получения кислорода в лаборатории. Каким образом можно: а) собрать кислород в пробирку; б) доказать наличие кислорода в сосуде.
В лаборатории чаще всего кислород получают из перманганата калия:
KMnO4 t ⟶ K2MnO4 + MnO2 + O2↑
Другим лабораторным способов является разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 MnO₂ ⟶ 2H2O + O2↑
а) Кислород можно собрать методом вытеснения воздуха (пробирка дном вниз) или методом вытеснения воды.
б) Доказать наличие кислорода в сосуде можно с помощью тлеющей лучины. При внесении тлеющей лучины в пробирку с кислородом она вспыхивает ярким пламенем.
- Вопрос № 2 Как получают кислород в лаборатории ив промышленности? Напишите уравнения соответствующих реакций. Чем отличаются эти способы друг от друга?
- Контрольная работа по химии : » Классы неорганических веществ» методическая разработка по химии (8 класс) на тему
- Скачать:
- Предварительный просмотр:
- 🌟 Видео
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Вопрос № 2 Как получают кислород в лаборатории ив промышленности? Напишите уравнения соответствующих реакций. Чем отличаются эти способы друг от друга?
Вопрос № 2 Как получают кислород в лаборатории ив промышленности? Напишите уравнения соответствующих реакций. Чем отличаются эти способы друг от друга?
В лаборатории кислород можно получить следующими способами:
1) Разложение перекиси водорода в присутствии катализатора (оксида марганца
2) Разложение бертолетовой соли (хлората калия):
3) Разложение перманганата калия:
В промышленности кислород получают из воздуха, в котором его содержится около 20% по объему. Воздух сжижают под давлением и при сильном охлаждении. Кислород и азот (второй основной компонент воздуха) имеют разные температуры кипения. Поэтому их можно разделить перегонкой: азот имеет более низкую температуру кипения, чем кислород, поэтому азот испаряется раньше кислорода.
Отличия промышленных и лабораторных способов получения кислорода:
1) Все лабораторные способы получения кислорода химические, то есть при этом происходит превращение одних веществ в другие. Процесс получения кислорода из воздуха — физический процесс, поскольку превращение одних веществ в другие не происходит.
2) Из воздуха кислорода можно получать в гораздо больших количествах.

задача №2
к главе «Глава II. Кислород. Горение Задачи к §§ 18-21 (стр. 53)».
Видео:Ошибка! смотри коммент. Контрольная #2 Вариант 2 Химия 8 класс. Классы неорганических соединенийСкачать

Контрольная работа по химии : » Классы неорганических веществ»
методическая разработка по химии (8 класс) на тему
Контрольная работа по химии: «Классы неорганических веществ»
Видео:Получение кислорода в лаборатории и проба на кислород. Задание 13. Химия ОГЭСкачать

Скачать:
| Вложение | Размер |
|---|---|
| dokument_microsoft_office_word.docx | 20.03 КБ |
Видео:Опыты по химии. Получение кислорода из перманганата калияСкачать

Предварительный просмотр:
Контрольная работа 2
Вариант 1
- Как получают водород в лаборатории? Запишите уравнение реакции.
- Из приведенного перечня выпишите формулы оксидов и назовите их: Fe, MgSO 4 , CaO, H 3 PO 4 , CaCO 3 , Mg, HCl, SO 2 .
- Определите валентность элемента и назовите оксиды: Na 2 O, SO 3 , Mn 2 O 7 , FeO, P 2 O 3 .
- Составьте формулы соединений: оксид железа(III), хлорид кальция, нитрат бария, угольная кислота, ортофосфат натрия, соляная кислота, оксид углерода(IV), сульфат алюминия.
- Замените названия веществ формулами и расставьте коэффициенты
оксид серы (VI) + вода ⎯→
оксид ртути(II) + водород ⎯→
водород + хлор ⎯→ хлороводород
- Воспользовавшись таблицей растворимости, выпишите формулы трех растворимых солей и назовите их.
- Сколько граммов соли и воды необходимо взять для приготовления 300 г 2%-ного раствора?
- Как получают кислород в лаборатории? Запишите уравнение реакции.
- Из приведенного перечня выпишите формулы металлов, вытесняющих водород из кислот, и назовите их: Fe, MgSO 4 , CaO, S, Ca, Mg, HCl, Cu, Sn, SO 2 .
- Определите валентность элемента и назовите оксиды: SO 2 , Ag 2 O, MnO 2 , CO, Fe 2 O 3 .
- Составьте формулы соединений: оксид меди (I), хлорид калия, карбонат бария, азотная кислота, сульфат натрия, серная кислота, оксид хлора (IV), ортофосфат железа(II).
- Замените названия веществ формулами и расставьте коэффициенты
оксид углерода (IV) + вода ⎯→
оксид меди(II) + водород ⎯→
ацетилен (С 2 Н 2 ) + кислород ⎯→
- Воспользовавшись таблицей растворимости, выпишите формулы трех малорастворимых солей и назовите их.
- Сколько граммов соли и воды необходимо взять для приготовления 200 г 5%-ного раствора?
- Как получают водород в промышленности? Запишите уравнение реакции.
- Из приведенного перечня выпишите формулы кислот и назовите их: Fe, MgSO 4 , CaO, H 2 S, CaH 2 , Mg, HCl, Cu, HNO 3 , SO 2 .
- Определите валентность элемента и назовите оксиды: SiO 2 , Al 2 O 3 , MnO, SO 3 , K 2 O.
- Составьте формулы соединений: оксид свинца (IV), хлорид магния, нитрат железа(III), соляная кислота, карбонат натрия, сульфат алюминия, азотная кислота, оксид хлора (I), ортофосфат кальция.
- Замените названия веществ формулами и расставьте коэффициенты
оксид фосфора (V) + вода ⎯→
оксид свинца(II) + водород ⎯→
цинк + соляная кислота ⎯→
- Воспользовавшись таблицей растворимости, выпишите формулы трех нерастворимых солей и назовите их.
- Сколько граммов соли выделится при выпаривании 300 г 10%-ного раствора?
- Пристли получал кислород разложением оксида ртути(II). Запишите уравнение реакции.
- Из приведенного перечня выпишите формулы солей и назовите их: Fe, MgSO 4 , CaO, KCl, CaH 2 , Mg, HCl, CuCO 3 , HNO 3 , SO 2 .
- Определите валентность элемента и назовите оксиды: NO 2 , N 2 O 3 , CaO, ClO 3 , Cu 2 O.
- Составьте формулы соединений: оксид кремния (IV), ортофосфат магния, сульфат железа(III), серная кислота, карбонат кальция, сульфат калия, угольная кислота, оксид меди (I), хлорид кальция.
- Замените названия веществ формулами и расставьте коэффициенты
оксид азота (V) + вода ⎯→
оксид железа (III) + водород ⎯→
цинк + серная кислота ⎯→
метан (CH 4 ) + кислород ⎯→
- Воспользовавшись таблицей растворимости, выпишите формулы трех растворимых кислот и назовите их.
- Сколько граммов соли выделится при выпаривании 400 г 3%-ного раствора?
🌟 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

получение кислородаСкачать

Кислород. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение кислородаСкачать

Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

Кислород химический элемент и простое вещество Получение кислородаСкачать

Водород и кислород. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

33. Кислород. Методы полученияСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

контрольная работа 8 класс рудзитис параграфы 22-35 кислород водород вода растворыСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Практическая работа " Получение кислорода и изучение его свойств"/ химия8Скачать