- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Хлористый водород: формула, получение, физические и химические свойства, техника безопасности
- Физические свойства
- Химические свойства
- Получение
- Применение
- Техника безопасности
- Первая помощь
- Урок №18. Хлороводород: получение и свойства
- 💥 Видео
Видео:Опыты по химии. Получение хлороводорода и растворение его в водеСкачать

We are checking your browser. gomolog.ru
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Получение хлороводородаСкачать
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2f85b9adf17b57 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Получение соляной кислотыСкачать

Хлористый водород: формула, получение, физические и химические свойства, техника безопасности
Хлористый водород — что это такое? Хлороводород — это бесцветный газ, обладающий резким запахом. Он легко растворяется в воде, образуя соляную кислоту. Химическая формула хлористого водорода — HCl. Он состоит из атома водорода и хлора, соединенных ковалентной полярной связью. Хлороводород легко диссоциирует в полярных растворителях, что обеспечивает хорошие кислотные свойства данного соединения. Длина связи составляет 127,4 нм.
Видео:ВЗОРВАЛИ ХЛОР. Фотохимическая реакция получения HClСкачать

Физические свойства
Как было сказано выше, в нормальном состоянии хлороводород — это газ. Он несколько тяжелее воздуха, а также обладает гигроскопичностью, т. е. притягивает пары воды прямо из воздуха, образуя при этом густое облака пара. По этой причине говорят, что хлористый водород «дымит» на воздухе. Если охлаждать данный газ, то на отметке -85 °С он сжижается, а к -114 °C становится твердым веществом. При температуре 1500 °С разлагается на простые вещества (исходя из формулы хлористого водорода, на хлор и водород).
Раствор HCl в воде называют соляной кислотой. Она представляет собой бесцветную едкую жидкость. Иногда имеет желтоватый оттенок из-за примесей хлора или железа. Из-за гигроскопичности максимальная концентрация при 20 °С — 37-38 % по массе. От нее же зависят и другие физические свойства: плотность, вязкость, температуры плавления и кипения.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
Сам хлороводород обычно в реакции не вступает. Лишь только при высокой температуре (более 650 °С) он реагирует с сульфидами, карбидами, нитридами и боридами, а также оксидами переходных металлов. В присутствии кислот Льюиса может взаимодействовать с гидридами бора, кремния и германия. А вот ее водный раствор гораздо более химически активен. По своей формуле хлористый водород — это кислота, поэтому он обладает некоторыми свойствами кислот:
- Взаимодействие с металлами (которые стоят в электрохимическом ряду напряжений до водорода):
- Взаимодействие с амфотерными и основными оксидами:
- Взаимодействие со щелочами:
NaOH + HCl = NaCl + H2O
Взаимодействие с некоторыми солями:
- При взаимодействии с аммиаком образуется соль хлорида аммония:
Но соляная кислота не взаимодействует со свинцом из-за пассивации. Это обусловлено образованием на поверхности металла слоя хлорида свинца, который нерастворим в воде. Таким образом, этот слой защищает металл от дальнейшего взаимодействия с соляной кислотой.
В органических реакциях она может присоединятся по кратным связям (реакция гидрогалогенирования). Также она может реагировать с белками или аминами, образуя органические соли — хлоргидраты. Искусственные волокна, типа бумаги, при взаимодействии с соляной кислотой разрушаются. В окислительно-восстановительных реакциях с сильными окислителями хлороводород восстанавливается до хлора.
Смесь концентрированной соляной и азотной кислоты (3 к 1 по объему) называют «царской водкой». Она является крайне сильным окислителем. Из-за образования в этой смеси свободного хлора и нитрозила царская водка может растворять даже золото и платину.
Видео:Лабораторная работа №10. Изучение свойств раствора хлороводородной кислоты. 9 класс.Скачать

Получение
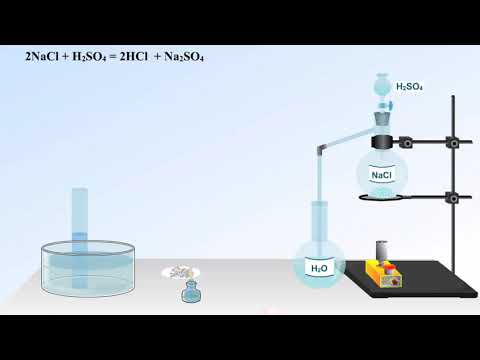
Ранее в промышленности соляную кислоту получали путем взаимодействия хлорида натрия с кислотами, обычно с серной:
Но этот способ недостаточно эффективен, а чистота получаемого продукта невысока. Сейчас используется другой способ получения (из простых веществ) хлористого водорода по формуле:
Для реализации такого способа существуют специальные установки, где оба газа подаются непрерывным потоком на пламя, в котором происходит взаимодействие. Водород подается в небольшом избытке для того, чтобы прореагировал весь хлор и не загрязнял получаемый продукт. Далее хлороводород растворяют в воде и получают соляную кислоту.
В лаборатории возможны более разнообразные способы получения, например гидролиз галогенидов фосфора:
Получить соляную кислоту можно и путем гидролиза кристаллогидратов некоторых хлоридов металлов при повышенной температуре:
Также хлороводород является побочным продуктом реакций хлорирования многих органических соединений.
Видео:Хлороводородная кислота. 9 класс.Скачать

Применение
Сам хлороводород на практике применения не находит, так как очень быстро впитывает воду из воздуха. Почти весь произведенный хлористый водород идет на производство соляной кислоты.
Применяется в металлургии для очистки поверхности металлов, а также для получения чистых металлов из их руд. Это происходит путем перевода их в хлориды, которые легко восстанавливаются. Так, например, получают титан и цирконий. Широкое применение кислота получила в органическом синтезе (реакции гидрогалогенирования). Также из соляной кислоты иногда получают чистый хлор.
Находит применение и в медицине как лекарство в смеси с пепсином. Его принимают при недостаточной кислотности желудка. Соляная кислота используется в пищевой промышленности в качестве добавки Е507 (регулятор кислотности).
Видео:Получение хлороводородаСкачать

Техника безопасности
При высоких концентрациях соляная кислота — это едкое вещество. Попадая на кожу, она вызывает химические ожоги. Вдыхание газообразного хлороводорода вызывает кашель, удушье, а в тяжелых случаях даже отек легких, который может привести к смерти.
По ГОСТу имеет второй класс опасности. Хлористый водород по стандарту NFPA 704 имеет третью категорию опасности из четырех. Кратковременное воздействие может привести к серьезным временным или умеренным остаточным последствиям.
Видео:Химия 8 класс. Хлороводород и соляная кислотаСкачать

Первая помощь
При попадании соляной кислоты на кожу рана должна быть обильно промыта водой и слабым раствором щелочи или ее соли (например, содой).
При попадании паров хлороводорода внутрь дыхательных путей пострадавшего необходимо вынести на свежий воздух и сделать ингаляцию кислородом. После этого следует прополоскать горло, промыть глаза и нос 2 % раствором гидрокарбоната натрия. Если соляная кислота попала в глаза, то после этого стоит закапать их раствором новокаина и дикаина с адреналином.
Видео:ПОЛУЧЕНИЕ ХЛОРОВОДОРОДА. Получение HCl. Реакция концентрированной серной кислоты и хлорида натрияСкачать

Урок №18. Хлороводород: получение и свойства
Хлороводород (Хлористый водород)
Молекулярная формула: НCl
Структурная формула: Н – Сl
Вид связи: ковалентная полярная, σ (s-p) – сигма связь
Физические свойства
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1: 400).
Получение
1) Промышленный – сжигание водорода в хлоре:
H 2 + Cl 2 = t˚C = 2HCl Опыт
«Получение хлороводорода и растворение его в воде»
NaCl(тв.) + H 2 SO 4 (конц.) = t =18-20˚C = NaHSO 4 + HCl↑
2NaCl(тв.) + H 2 SO 4 (конц.) = сильное нагревание = Na 2 SO 4 + 2HCl↑
💥 Видео
Опыты по химии. Получение этилена и опыты с нимСкачать

Хлороводородный фонтан, получение соляной кислоты. (химия)Скачать

Получение хлороводорода и соляной кислотыСкачать

Галилео. Эксперимент. Взрыв водородаСкачать

Хлор. 9 класс.Скачать

Химия, 9-й класс, Хлороводород и соляная кислотаСкачать

Лабораторный опыт №8 «Реакция нейтрализации хлороводородной кислоты» Химия 7 классСкачать

Галогены. 9 класс.Скачать

Реакции кислот с металлами. Урок 23. Химия 7 класс.Скачать