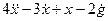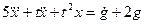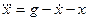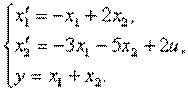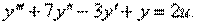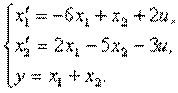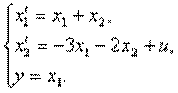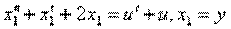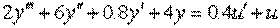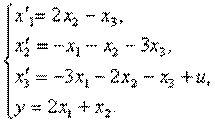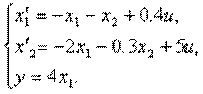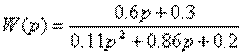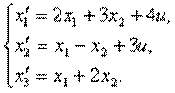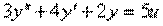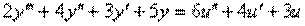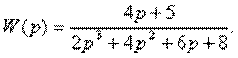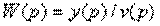- Структурные формулы — это просто!
- Углеводороды
- Двойные и тройные связи
- Циклические углеводороды
- Изомеры
- Бензол и скелетные формулы
- Трехмерные изображения
- Формулы с окружностью
- Знакомство с кислородом. Спирты
- Карбоновые кислоты
- Радикалы
- Знакомство с азотом. Амины
- Рациональные формулы
- Система Хилла
- Немного о системе easyChem
- АЛГОРИТМ ПОСТРОЕНИЯ СТРУКТУРНОЙ СХЕМЫ
- Задачи и пример решения одной из них по теме «Структурный метод»
- Страницы работы
- Содержание работы
- 📺 Видео
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Структурные формулы — это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Считается, что они сложны для понимания, поэтому в школе их изучают в выпускных классах. Но я уверен, что через 10 минут вы разберетесь, как легко составлять структурные формулы.
Перед нами структурная формула метана — самого простого органического вещества.
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H. C означает углерод, а H — водород. Это два самых важных элемента, которые входят в состав любых органических веществ. А что означают палочки? Это химические связи. В них кроется практически весь секрет органической химии.
Фокус в том, что валентность углерода равна 4. Поэтому у каждой буквы C должно быть 4 палочки. А валентность водорода равна 1, поэтому у него палочка должна быть только одна.
По-моему, палочки отлично демонстрируют такие «страшные» понятия, как химические связи и валентность.
Структурные формулы могут слегка менять свой внешний вид. В них главное — количество элементов и наличие нужных связей. Например, формула метана может иметь и такой вид:
В общем, структурные формулы не являются какими-то жесткими конструкциями. Если вдруг Вам захотелось бы сделать модель молекулы из подручных материалов, то для этого лучше всего подошли бы шарики, соединённые пружинками или резинками. Под шариками я конечно подразумеваю атомы, а резинки — химические связи.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. Достаточно распространены так называемые истинные формулы. Для метана истинная формула записывается так:
Стоит упомянуть, что метан — это природный газ, который знаком всем, у кого есть газовая плита. Но не будем на нём долго задерживаться. Пора посмотреть, какие ещё бывают варианты органических структур.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить — мы здесь изучаем химические формулы. А все упоминаемые вещества служат для иллюстрации.
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Брутто-формула | |||
|---|---|---|---|---|---|---|
| Этан | H-C-C-H; H|#2|H; H|#3|H | CH3-CH3 | Пропан | H-C-C-C-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH3 | Бутан | H-C-C-C-C-H; H|#2|H; H|#3|H; H|#4|H; H|#5|H | CH3-CH2-CH2-CH3 | Пентан | H-C-C-C-C-C-H;H|#2|H;H|#3|H;H|#4|H;H|#5|H;H|#6|H | CH3-CH2-CH2-CH2-CH3 | Гексан | H-C-C-C-C-C-C-H;H|#2|H;H|#3|H;H|#4|H;H|#5|H;H|#6|H;H|#7|H |
| Вещество | Развёрнутая формула | Упрощённая формула | Брутто-фломула |
|---|---|---|---|
| Этен (Этилен) | $slope(55)HC _(x1,N2)C /H | CH2=CH2 | |
| Пропен (Пропилен) | $slope(45)HC-C/C/H; H#-3H;H/#2-#3H | CH2=CH-CH3 | |
| Бутен (Бутилен) | HC =C -C -C-H; H|#-3|H | CH2=CH-CH2-CH3 | |
| Этин (Ацетилен) | H-C%C-H | CH%CH | |
| Пропин (Метилацетилен) | H-C%C-C-H; H|#-3|H | CH%C-CH3 | |
| Бутин (Этилацетилен) | H-C%C-C -C-H; H|#-3|H | CH%C-CH2-CH3 |
Представленные здесь вещества тоже относятся к углеводородам. Если хорошенько присмотреться, то можно увидеть определённое сходство с веществами из первой таблицы. Названия формируются заменой буквы в конце названия: этан — этен — этин или пропан — пропен — пропин. Сходство не ограничивается названиями. Главное — одинаковое количество атомов углерода. А значит — одинаковое количество звеньев в цепи.
Различие кроется в наличии двойных и тройных связей. Углеводороды в первой таблице называются предельными. Это означает, что к ним больше ничего нельзя добавить. А во второй таблице представлены непредельные углеводороды. То есть, при определённых условиях к ним можно добавить по парочке атомов водорода.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Верхние названия, которые без скобок — это научные названия. А в скобках даны традиционные названия, которые тоже довольно часто употребляются как в научной литературе, так и в быту.
Видео:Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов. Оказывается, что цепочки могут быть замкнутыми. То есть, атомы углерода соединяются друг с другом циклически.
| Вещество | Развёрнутая формула | Упрощённая формула | Брутто-формула |
|---|---|---|---|
| Циклопропан | $slope(60)H`/C`/C:a`/H; H#CC:bH; H-#a-#b-H | H2C_(x1.4)CH2_q3CH2_q3 | |
| Циклобутан | H|C|C|H; H|C|C|H; H-#2-#6-H; H-#3-#7-H | H2C-CH2`|CH2`-H2C_#1 | |
| Циклопентан | C_(x1.1)C@:H2() @()_qC@H2()_qC@H2()_qC@H2()_q@H2() | H2C_(x1.4)CH2_qCH2_qCH2_qH2C_q | |
| Циклогексан | CC@:H2() @()|C@H2()`/C@H2()`C@H2()`|C@H2()/@H2() | $L(1.3)CH2CH2|CH2`/CH2`H2C`|H2C/ |
Видео:Составление формул органических соединений по названиюСкачать

Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы. Но может возникнуть вполне законный вопрос: зачем вообще нужны структурные формулы? Ведь брутто-формулы гораздо проще записывать. Может быть, достаточно было бы пользоваться только ими?
Но оказывается, что без структурных формул обойтись не получится. Например, если сравнить брутто-формулы из двух предыдущих таблиц, то мы увидим, что циклопропан имеет абсолютно тот же состав, что и пропен ( C3H6 ). А брутто-формула циклобутана совпадает с бутеном ( C4H8 ). Но это разные вещества! И разница заключается в структуре. То есть, имеет большое значение, в каком порядке элементы соединены друг с другом. А значит, именно структурные формулы позволяют точно описать нужное вещество.
В химии существует такое понятие как изомеры. Так называют разные вещества, которые имеют одинаковый состав. Это не редкость. И в этом нет ничего странного. Ведь бывают же совершенно разные слова, состоящие из одинаковых букв.
Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Брутто-формула | Бутан | H-C-C-C-C-H; H|#2|H; H|#3|H; H|#4|H; H|#5|H | CH3-CH2-CH2-CH3 | Метилпропан (Изобутан) | HCC/C/H; H|#2`/H; H|#4H; H|#3|C|H; H/#-3H | CH3-CH -CH3 |
|---|---|---|---|---|---|---|
| Вещество | Упрощённая формула | Брутто-формула |
|---|---|---|
| Пентан | CH3-CH2-CH2-CH2-CH3 | |
| 2-метилбутан (Изопентан) | CH3-CH -CH2-CH3 | |
| 2,2-диметилпропан (Неопентан) | CH3-C -CH3 |
А у вещества декан, имеющего формулу C10H22 , существует 75 изомеров. Но мы не будем их здесь рассматривать.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, а традиционное название просто учитывает количество атомов углерода в молекуле. Так получилось из-за того, что химики, которые только начинали исследовать углеводороды, первым делом научились определять состав веществ. То есть, сначала люди смогли получить лишь брутто-формулы. А из них невозможно понять, какова длина самой длинной цепочки. Поэтому названия учитывали общее число атомов углерода.
Затем наука дошла до того, что люди смогли исследовать структуру молекул, придумали структурные формулы и переименовали уже известные вещества в соответствии с новыми знаниями. Но старые названия уже успели прижиться и существуют до сих пор.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов. Это вещество называется бензол. Вот его формулы:
| Развёрнутая формула | Упрощённая формула | Скелетная формула | Брутто-формула |
|---|---|---|---|
| H|CC|C `//C `C `||C //H | H_(y.5)C\CH|CH`//C `HC`||HC/ | \|`//«||/ |
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного числа органических веществ.
И вот на примере бензола предлагаю ознакомиться с ещё одним очень важным способом записи структурных формул — скелетными формулами.
Как видно из таблицы, скелетная формула бензола представляет собой правильный шестиугольник без каких-либо букв, зато изображения химических связей выглядят одинаково.
В общем, правила составления скелетных формул отличаются от уже знакомых нам развёрнутых всего двумя особенностями:
- Буквы C не пишутся. Предполагается, что каждый угол изображаемой геометрической фигуры содержит атом углерода.
- Буквы H тоже не пишутся. Если в углу сходятся меньше четырёх линий, то это означает, что все оставшиеся заняты водородом.
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Поэтому в органической химии это самый популярный вид формул. И мне кажется, Вам тоже будет несложно к ним привыкнуть.
Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
| Вещество | Развёрнутая формула | Скелетная формула | Смешанный вариант | Брутто-формула |
|---|---|---|---|---|
| Нафталин | C/C \C |C `//C `C`|`\C `/C ||C C/`/|H | /\|`//«|`\`/||// | C10H8 | |
| Толуол | H|C|CC|C `//C `C `||C //H; H-#2-H | |\|`//«||/ | CH3|\|`//«||/ | |
| Кумол | HCC/C/H; H|#2|H; H|#4|H; H|#3|CC|C `//C `C `||C //H | |\|`//«||/ | H3C |\|`//«||/ |
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. Просто иногда внутри одной формулы удобно сочетать различные способы.
А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла.
Скелетные формулы существуют не только для циклических молекул. Понятно, что метан и этан имеют слишком мало узлов, поэтому для них не стоит пытаться использовать скелетные формулы. А вот какая-нибудь длинная молекула изображается довольно легко. Только не в виде прямой цепочки, а при помощи ломаной линии, ведь атомы углерода изображаются углами.
| Бутан | Бутен | Изобутан | Гексан |
| // | /// | |`|0/ | /// |
Видео:Химия | Молекулярные и ионные уравненияСкачать

Трехмерные изображения
Иногда плоского изображения становится недостаточно. Поэтому для изображения трехмерных структурных формул используют особое изображение для химических связей:
Видео:Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Формулы с окружностью
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра. Тут нет ничего необычного, ведь молекулы не стоят на одном месте. А вот дальше мы видим кружок вместо трёх двойных связей. Причём, я намеренно изобразил все атомы водорода в последней формуле. Чтобы было хорошо видно, что каждый угол фактически лишился одной чёрточки. Их заменил кружок. Он как бы означает, что все двойные связи равномерно распределены внутри кольца.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного, который внёс значительный вклад в исследование структуры бензола.
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Некоторые авторы категорически против. Но есть масса публикаций, где такая запись широко употребляется. Моя задача состоит в том, чтобы Вы узнали о существовании подобных формул и не удивлялись, увидев их.
Вот пара примеров записи уже для уже знакомых нам веществ:
| Нафталин: | /|`/«|_o«/|/_o | Толуол: | `/`-`/-_o-CH3 |
Видео:8 класс. Составление уравнений химических реакций.Скачать

Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода. Думаю, пора познакомиться с новым элементом — кислородом. Он обозначается латинской буквой O. Его валентнсть равна 2. То есть, каждая буква O в структурных формулах должна снабжаться двумя палочками.
Кислород — очень распространённый элемент на нашей планете. Он входит в состав большого количества органических и неорганических веществ. Но мы начнём знакомство с группы веществ, называемых спиртами:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Скелетная формула | Брутто-формула |
|---|---|---|---|---|
| Метанол (метиловый спирт) | H-C-O-H; H|#C|H | CH3-OH | OH | |
| Этанол (этиловый спирт) | H-C-C-O-H; H|#2|H; H|#3|H | CH3-CH2-OH | /OH | |
| 1-Пропанол (пропиловый спирт) | H-C-C-C-O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-OH | //OH | |
| 2-Пропанол (изопропиловый спирт) | H-C-C-C-H; H|#2|H; H|#3|O|H; H|#4|H | CH3-CH -CH3 | / |
Не правда ли, что в этом есть что-то знакомое? Метан — метанол, этан — этанол, пропан — пропанол.
Да, можно сказать, что спирт получается из углеводорода, если заменить один атом -H на группу -O-H (или -OH в упрощенных структурных формулах). Химики называют её: гидроксильная группа, по латинским названиям водорода и кислорода. А иногда она даже называется спиртовой группой.
Все спирты можно описать в виде обобщённой формулы -OH , где OH — гидроксильная группа, а R — остальная часть молекулы органического вещества.
Конечно же стоит упомянуть, что этанол — это тот самый спирт, который входит в состав алкогольных напитков. Другие представленные здесь спирты по запаху, цвету и даже вкусу довольно похожи на этиловый спирт. Но они очень вредны для здоровья человка. Например, один глоток метанола может оставить человека слепым на всю жизнь. А если выпить больше, то это можеть оказаться фатальным для жизни.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол. У них одинаковые брутто-формулы, хотя вещества это разные. Их молекулы отличаются номером углеродного атома, к которому крепится группа OH. Возможно, Вы спросите, почему у 1-пропанола гидроксильная группа присоединена к третьему, а не к первому атому углерода? Тут следует вспомнить, что молекулы не находятся в одном положении. Они постоянно крутятся. И вполне могут развернуться как угодно:
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу. Химики называют их одноатомные спирты. Но существуют вещества с различным количеством гидроксильных групп. Они соответственно называются двухатомные спирты, трёхатомные спирты и так далее.
В качестве примера трёхатомного спирта можно привести достаточно известное вещество — глицерин:
| Развёрнутая формула | Упрощённая формула | Скелетная формула | Брутто-формула |
|---|---|---|---|
| H-C-C-C-H; $slope(45)H`/O|#2|H; H`/O|#3|H; H`/O|#4|H | OH|CH2-CH -CH2`|OH | HO/ /OH |
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества — холестерина. Далеко не все знают, что он является одноатомным спиртом!
Видео:Видео №3. Как составить изомерыСкачать

Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет. Но химики знают причину — если к спирту присоединить ещё один атом кислорода, то получится кислота.
Посмотрим на формулы кислот, которые получаются из уже знакомых нам спиртов:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Скелетная формула | Брутто-формула |
|---|---|---|---|---|
| Метановая кислота (муравьиная кислота) | H/C`|O|OH | HCOOH | O//OH | |
| Этановая кислота (уксусная кислота) | H-C-C O-H; H|#C|H | CH3-COOH | /`|O|OH | |
| Пропановая кислота (метилуксусная кислота) | H-C-C-C O-H; H|#2|H; H|#3|H | CH3-CH2-COOH | /`|O|OH | |
| Бутановая кислота (масляная кислота) | H-C-C-C-C O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-COOH | //`|O|OH | |
| Обобщённая формула | -C O-H | -COOH или -CO2H | /`|O|OH |
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH), которая и придаёт таким веществам кислотные свойства.
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты. Обычно столовый уксус содержит от 3 до 15% уксусной кислоты, а остальное (по большей части) — вода. Употребление в пищу уксусной кислоты в неразбавленном виде представляет опасность для жизни.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В этом случае они называются: двухосновная, трёхосновная и т.д.
В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
| Щавелевая кислота | Молочная кислота | Яблочная кислота | Лимонная кислота |
| HOOC-COOH | H3C /COOH | HOOC/ COOH | HOOC/ /COOH |
| двухосновная карбоновая кислота | оксикарбоновая кислота | Двухосновная оксикарбоновая кислота | Трёхосновная оксикарбоновая кислота |
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Кстати, обратите внимание, что здесь встречаются кислоты, имеющие и гидроксильную группу, характерную для спиртов. Такие вещества называются оксикарбоновыми кислотами (или оксикислотами).
Внизу под каждой из кислот подписано, уточняющее название той группы органических веществ, к которой она относится.
Видео:Решение уравнений в несколько действий. Как объяснить ребенку решение уравнений?Скачать

Радикалы
Радикалы — это ещё одно понятие, которое оказало влияние на химические формулы. Само слово наверняка всем известно, но в химии радикалы не имеют ничего общего с политиками, бунтовщиками и прочими гражданами с активной позицией.
Здесь это всего лишь фрагменты молекул. И сейчас мы разберёмся, в чём их особенность и познакомимся с новым способом записи химических формул.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты — -OH и карбоновые кислоты — -COOH . Напомню, что -OH и -COOH — это функциональные группы. А вот R — это и есть радикал. Не зря он изображается в виде буквы R.
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода. Ну а если отнять два атома водорода, то получится двухвалентный радикал.
Радикалы в химии получили собственные названия. Некоторые из них получили даже латинские обозначения, похожие на обозначения элементов. И кроме того, иногда в формулах радикалы могут быть указаны в сокращённом виде, больше напоминающем брутто-формулы.
Всё это демонстрируется в следующей таблице.
| Название | Структурная формула | Обозначение | Краткая формула | Пример спирта | ||
|---|---|---|---|---|---|---|
| Метил | CH3- | Me | CH3 | -OH | CH3OH | |
| Этил | CH3-CH2- | Et | C2H5 | -OH | C2H5OH | |
| Пропил | CH3-CH2-CH2- | Pr | C3H7 | -OH | C3H7OH | |
| Изопропил | H3CCH(*`/H3C*)- | i-Pr | C3H7 | -OH | (CH3)2CHOH | |
| Фенил | `/`=`//-\- | Ph | C6H5 | -OH | C6H5OH | |
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов. Некоторые радикалы записываются в виде, напоминающем брутто-формулу, но функциональная группа записывается отдельно. Например, CH3-CH2-OH превращается в C2H5OH .
А для разветвлённых цепочек вроде изопропила применяются конструкции со скобочками.
Существует ещё такое явление, как свободные радикалы. Это радикалы, которые по каким-то причинам отделились от функциональных групп. При этом нарушается одно из тех правил, с которых мы начали изучение формул: число химических связей уже не соответствует валентности одного из атомов. Ну или можно сказать, что одна из связей становится незакрытой с одного конца. Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот.
Он обозначается латинской буквой N и имеет валентность, равную трём.
Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Скелетная формула | Брутто-формула |
|---|---|---|---|---|
| Аминометан (метиламин) | H-C-N H;H|#C|H | CH3-NH2 | NH2 | |
| Аминоэтан (этиламин) | H-C-C-N H;H|#C|H;H|#3|H | CH3-CH2-NH2 | /NH2 | |
| Диметиламин | H-C-N -C-H; H|#-3|H; H|#2|H | $L(1.3)H/N dCH3 | /N | |
| Аминобензол (Анилин) | HN |C\C |C `//C `C `||C / | NH2|C\CH|CH`//C `HC`||HC/ | NH2||`/«|/_o | |
| Триэтиламин | $slope(45)H-C-C/NC-C-H;H|#2|H; H|#3|H; H|#5|H;H|#6|H; #N`|C `|C `|H | CH3-CH2-N -CH2-CH3 | /N | |
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины. Функциональная группа -NH2 называется аминогруппой. Вот несколько обобщающих формул аминов:
| По числу замещённых атомов водорода | По числу аминогрупп в молекуле |
|---|---|
| Первичный амин -NH2 | Моноамин -NH2 |
| Вторичный амин -NH- | Диамин H2N—NH2 |
| Третичный амин -N — | Триамин H2N-(*`|NH2*)-NH2 |
В общем, никаких особых новшеств здесь нет. Если эти формулы Вам понятны, то можете смело заниматься дальнейшим изучением органической химии, используя какой-нибудь учебник или интернет.
Но мне бы хотелось ещё рассказать о формулах в неорганической химии. Вы убедитесь, как их легко будет понять после изучения строения органических молекул.
Видео:Решение биквадратных уравнений. 8 класс.Скачать

Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая. Конечно, неорганические молекулы обычно выглядят гораздо проще, потому что они не склонны к образованию таких сложных структур, как углеводороды. Но зато приходится изучать более сотни элементов, входящих в состав таблицы Менделеева. А элементы эти имеют склонность объединяться по химическим свойствам, но с многочисленными исключениями.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи — химические формулы. А с ними как раз всё относительно просто.
Наиболее часто в неорганической химии употребляются рациональные формулы. И мы сейчас разберёмся, чем же они отличаются от уже знакомых нам.
Для начала, познакомимся с ещё одним элементом — кальцием. Это тоже весьма распространённый элемент.
Обозначается он Ca и имеет валентность, равную двум. Посмотрим, какие соединения он образует с известными нам углеродом, кислородом и водородом.
| Вещество | Структурная формула | Рациональная формула | Брутто-формула |
|---|---|---|---|
| Оксид кальция | Ca=O | CaO | |
| Гидроксид кальция | H-O-Ca-O-H | Ca(OH)2 | |
| Карбонат кальция | $slope(45)Ca`/OC|O`|/O`#1 | CaCO3 | |
| Гидрокарбонат кальция | HO/`|O|O/CaO/`|O|OH | Ca(HCO3)2 | |
| Угольная кислота | H|OC|O`|/O`|H | H2CO3 |
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой. Но пока что не очень понятно, как они получаются. Чтобы понять смысл этих формул, нужно рассмотреть химические реакции, в которых участвуют вещества.
Кальций в чистом виде — это мягкий белый металл. В природе он не встречается. Но его вполне возможно купить в магазине химреактивов. Он обычно хранится в специальных баночках без доступа воздуха. Потому что на воздухе он вступает в реакцию с кислородом. Собственно, поэтому он и не встречается в природе.
Итак, реакция кальция с кислородом:
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. Думаю, что все слыхали про этот газ. Он образуется при дыхании людей и животных, сгорании угля и нефтепродуктов, при пожарах и извержениях вулканов. Поэтому он всегда присутствует в воздухе. Но ещё он довольно хорошо растворяется в воде, образуя угольную кислоту:
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой и превращается в малорастворимый карбонат кальция:
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы. Так же он входит в состав кораллов, раковин моллюсков, костей животных и т.д.
Но если карбонат кальция раскалить на очень сильном огне, то он превратится в оксид кальция и углекислый газ.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы. Так вот, рациональные формулы записываются так, чтобы были видны функциональные группы. В нашем случае это:
| OH | Гидроксильная группа |
| CO3 | Карбонат — соль угольной кислоты |
| HCO3 | Гидрокарбонат — кислая соль угольной кислоты |
Кроме того, отдельные элементы — Ca, H, O(в оксидах) — тоже являются самостоятельными группами.
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо. А после изучения функциональных групп, нам ничего не стоит разобраться, что же представляют собой эти ионы.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. Электроны — это частицы с отрицательным зарядом. Элемент с полным набором электронов имеет нулевой заряд. Если он отдал электрон, то его заряд становится положительным, а если принял — то отрицатеньным. Например, водород имеет всего один электрон, который он достаточно легко отдаёт, превращаясь в положительный ион. Для этого существует специальная запись в химических формулах:
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
Положительно заряженные ионы — катионы. Чаще всего это водород и металлы.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним — анион. Даже если формула не содержит никаких зарядов.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. Вот скелетная формула гидрокарбонат-аниона:
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы. Но есть ещё один вопрос, который стоит рассмотреть подробнее. Чем же всё-таки отличаются брутто-формулы от рациональных?
Мы знаем почему рациональная формула угольной кислоты записывается H2CO3 , а не как-то иначе. (Сначала идут два катиона водорода, а за ними карбонат-анион). Но почему брутто-формула записывается CH2O3 ?
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой, ведь в ней нет повторяющихся элементов. В отличие от NH4OH или Ca(OH)2 .
Но к брутто-формулам очень часто применяется дополнительное правило, определяющее порядок следования элементов. Правило довольно простое: сначала ставится углерод, затем водород, а дальше остальные элементы в алфавитном порядке.
Вот и выходит CH2O3 — углерод, водород, кислород. Это называется системой Хилла. Она используется практически во всех химических справочниках. И в этой статье тоже.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Немного о системе easyChem
Вместо заключения мне хотелось бы рассказать о системе easyChem. Она разработана для того, чтобы все те формулы, которые мы тут обсуждали, можно было легко вставить в текст. Собственно, все формулы в этой статье нарисованы при помощи easyChem.
Зачем вообще нужна какая-то система для вывода формул? Всё дело в том, что стандартный способ отображения информации в интернет-браузерах — это язык гипертекстовой разметки (HTML). Он ориентирован на обработку текстовой информации.
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. Даже некоторые упрощённые структурные формулы тоже могут быть записаны текстом, например спирт CH3-CH2-OH . Хотя для этого пришлось бы в HTML использовать такую запись: CH3-CH2-OH .
Это конечно создаёт некоторые трудности, но с ними можно смириться. Но как изобразить структурную формулу? В принципе, можно использовать моноширинный шрифт:
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул. Здесь не остаётся иного пути, кроме подключения растрового изображения. Растры хранятся в отдельных файлах. Браузеры могут подключать изображения в формате gif, png или jpeg.
Для создания таких файлов требуется графический редактор. Например, Фотошоп. Но я более 10 лет знаком с Фотошопом и могу сказать точно, что он очень плохо подходит для изображения химических формул.
Гораздо лучше с этой задачей справляются молекулярные редакторы. Но при большом количестве формул, каждая из которых хранится в отдельном файле, довольно легко в них запутаться.
Например, число формул в этой статье равно . Из них выведены виде графических изображений (остальные при помощи средств HTML).
Система easyChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Кроме того, брутто-формулы в этой статье вычисляются автоматически. Потому что easyChem работает в два этапа: сначала текстовое описание преобразуется в информационную структуру (граф), а затем с этой структурой можно выполнять различные действия. Среди них можно отметить следующие функции: вычисление молекулярной массы, преобразование в брутто-формулу, проверка на возможность вывода в виде текста, графическая и текстовая отрисовка.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Причём, мне не пришлось думать, какая из формул будет графической, а какая — текстовой.
Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
| Текстовое описание easyChem | Выводимый результат | Сгенерированная брутто-формула |
|---|---|---|
| (NH4)2CO3 | (NH4)2CO3 | |
| H-C-C-O-H; H|#2|H; H|#3|H | H-C-C-O-H; H|#2|H; H|#3|H | |
| CH3|\|`//«||/ | CH3|\|`//«||/ |
Описания из левого столбца автоматически превращаются в формулы во втором столбце.
В первой строчке описание рациональной формулы очень похоже на отображаемый результат. Разница только в том, что числовые коэффициенты выводятся подстрочником.
Во второй строке развёрнутая формула задана в виде трёх отдельных цепочек, разделённых символом ; Я думаю, нетрудно заметить, что текстовое описание во многом напоминает те действия, которые потребовались бы для изображения формулы карандашом на бумаге.
В третьей строке демонстрируется использование наклонных линий при помощи символов и /. Значок ` (обратный апостроф) означает, что линия проводится справа налево (или снизу вверх).
Здесь есть гораздо более подробная документация по использованию системы easyChem.
На этом разрешите закончить статью и пожелать удачи в изучении химии.
Видео:Сложные уравнения. Как решить сложное уравнение?Скачать

АЛГОРИТМ ПОСТРОЕНИЯ СТРУКТУРНОЙ СХЕМЫ
1. Вырачитт. член со старшей производной из дифференциального уравнения (1.3) и представить полученное соотношение с помощью сумматора, дифференцирующих и усилительных звеньев.
2. Все низшие производные получить как сигналы на соответствующих выходах последовательно соединенных интегрирующих звеньев.
3 Начальные условия (1.4) представить как постоянные во времени воздействия, приложенные на выходах интегрирующих звеньев.
Пример 1.1. Построить структурную схему системы, описываемой дифференциальным уравнением
с начальными условиями 
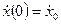
□ Выразим из уравнения член со старшей производной:
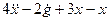
Изобразим схему получения сигнала 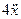
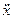
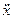
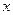
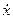
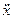
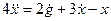
Для этого добавляем к прямой цепи соединение дифференцирующего и усилительного звеньев, которые из входного сигнала g позволяют получить нужный сигнал 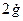
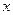
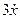
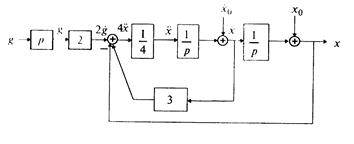
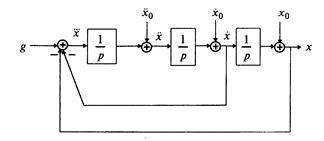
Пример 1.2. Построить структурную схему системы, описываемой дифференциальным уравнением
с начальными условиями 
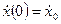
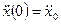
□ Выразим из уравнения член со старшей производной:
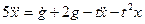
Согласно алгоритму получим структурную схему системы (рис. 1.10).
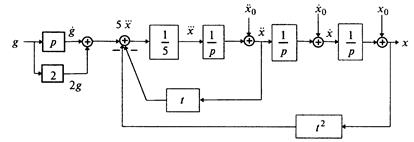
Пример 1.3. Построить структурную схему системы, описываемой дифференциальным уравнением
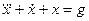
□ Выразим из уравнения член со старшей производной:
и с помощью алгоритма получим схему (рис. 1.11).
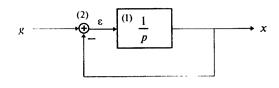
2. Составление дифференциального уравнения по структурной схеме. Для записи дифференциального уравнения следует обозначить на схеме все промежуточные сигналы, записать уравнения для каждого звена и для каждого сумматора и из полученной системы дифференциальных и алгебраических уравнений исключить промежуточные переменные кроме входного и выходного сигналов.
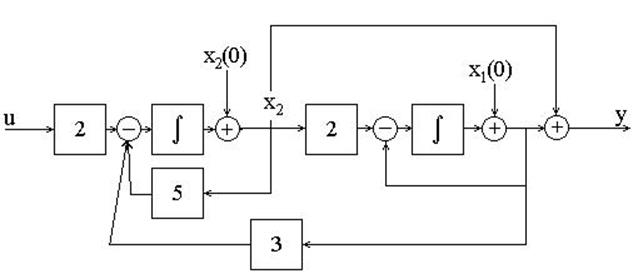
Пример 1.4. Составить дифференциальное уравнение по структурной схеме, изображенной на рис. 1 12.
□ Составим уравнения элементов схемы:
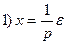
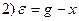
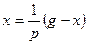
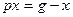
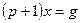
Дифференциальное уравнение системы имеет вид
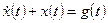
что совпадает с (1.10) при 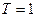
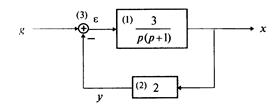
Пример 1.5. Составить дифференциальное уравнение по структурной схеме, представленной на рис. 1.13.
□ Составим уравнения элементов схемы:
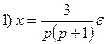
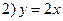
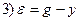
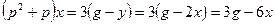
Переходя от операторной формы записи дифференциального уравнения к обычной, получаем
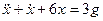
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Задачи и пример решения одной из них по теме «Структурный метод»
Страницы работы
Содержание работы
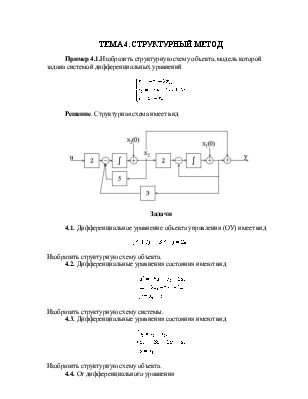
ТЕМА 4. СТРУКТУРНЫЙ МЕТОД
Пример 4.1.Изобразить структурную схему объекта, модель которой задана системой дифференциальных уравнений
Решение. Структурная схема имеет вид
4.1. Дифференциальное уравнение объекта управления (ОУ) имеет вид
Изобразить структурную схему объекта.
4.2. Дифференциальные уравнения состояния имеют вид
Изобразить структурную схему системы.
4.3. Дифференциальные уравнения состояния имеют вид
Изобразить структурную схему объекта.
4.4. От дифференциального уравнения
перейти к структурной схеме.
4.5. От дифференциального уравнения
описывающего объект, перейти к структурной схеме.
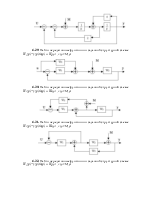
4.6. Изобразить структурную схему объекта, модель которого задана системой дифференциальных уравнений
4.7. Известна модель объекта в пространстве состояний
Изобразить структурную схему на интегрирующих элементах.
4.8. По известной передаточной функции объекта
записать дифференциальное уравнение и изобразить структурную схему.
4.9. Представить в виде структурной схемы модель ОУ, заданную системой дифференциальных уравнений
4.10. Представить в виде структурной схемы модель ОУ, заданную дифференциальным уравнением
4.11. Представить в виде структурной схемы модель ОУ, заданную дифференциальным уравнением
4.12. Перейти от передаточной функции к структурной схеме, содержащей только интеграторы, сумматоры и усилители
4.13. Перейти от передаточной функции W(p) к структурной схеме, содержащей только интеграторы, сумматоры и усилители, где
4.14. Структурная схема системы имеет вид
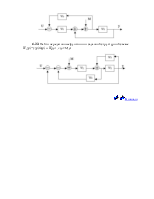
Определить передаточную функцию
4.15. Структурная схема системы имеет вид
Определить передаточную функцию системы.
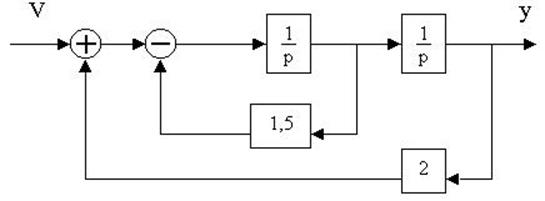
4.16. Определить W(p)=y(p)/u(p) по заданной структурной схеме и составить описание системы в пространстве состояний
4.17. По структурной схеме
определить W(p)=y(p)/u(p),составить описание в пространстве состояний.
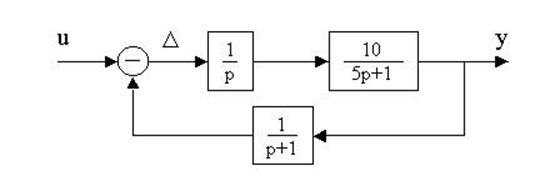
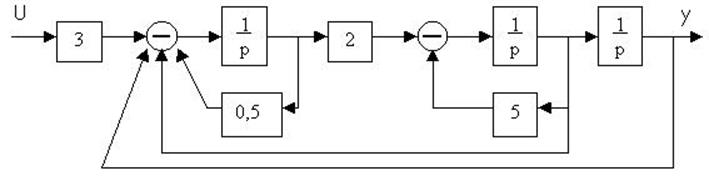
4.18. По структурной схеме определить передаточную функцию
4.19. Для заданной структурной схемы
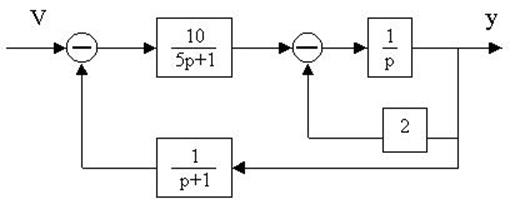
4.20. Структурная схема системы имеет вид
4.21.Структурная схема системы имеет вид
определить передаточную функцию W(p).
4.22.Структурная схема системы имеет вид
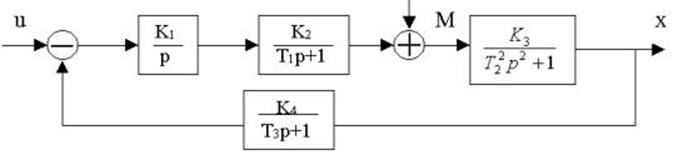
определить передаточную функцию W(p).
4.23.Структурная схема системы имеет вид
определить передаточную функцию W(p).
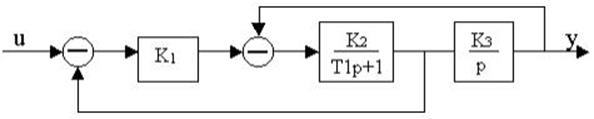
4.24.Структурная схема системы имеет вид
определить передаточную функцию W(p), записать дифференциальное уравнение относительно y, u.
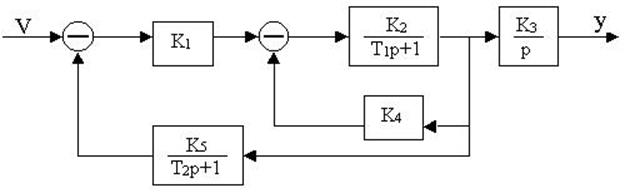
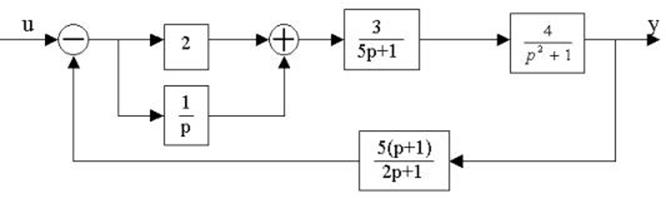
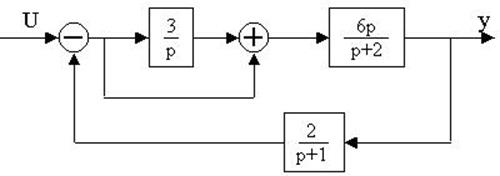
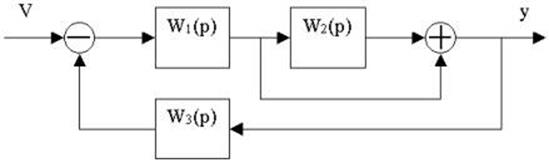
4.25.Структурная схема системы имеет вид
определить передаточную функцию W(p).
4.26. Для заданной структурной
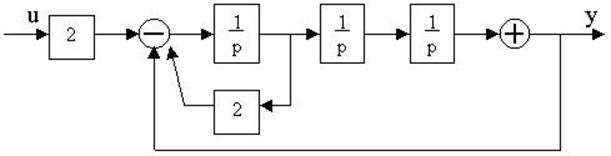
4.27. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
4.28. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
4.29. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
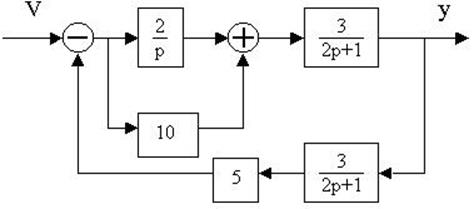
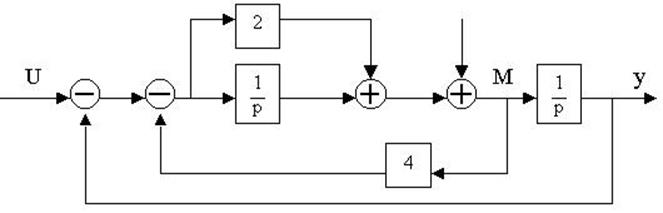
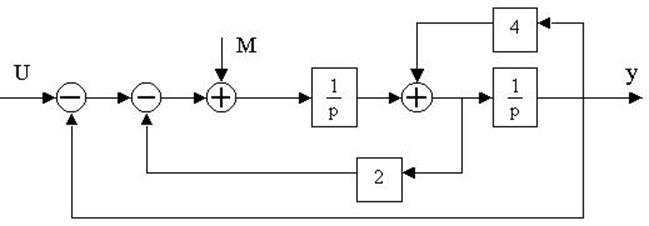
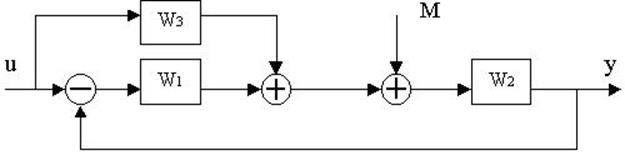
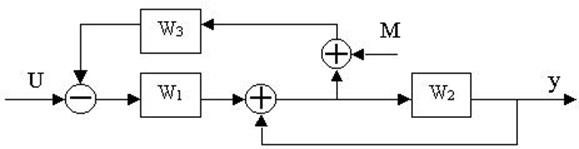
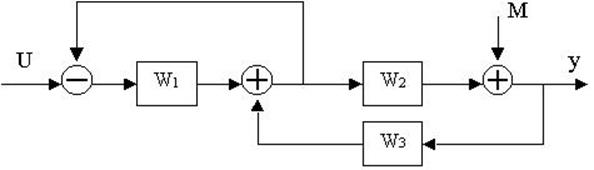
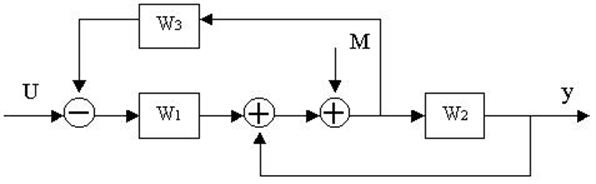
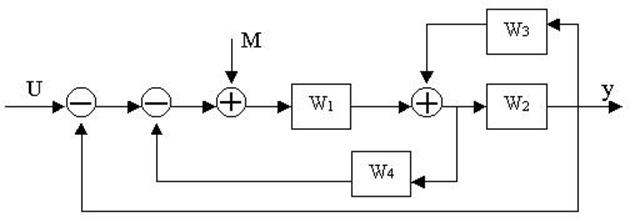
4.30. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
4.31. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
4.32. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)
4.33. Найти передаточные функции по заданной структурной схеме W1(p)=y(p)/u(p) и W2(p)=y(p)/М(p)

📺 Видео
КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

СЕКРЕТНЫЙ СПОСОБ — Как составлять химические уравнения? Химия 8 класс #shorts #youtubeshortsСкачать