Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
- Обратимый гидролиз солей
- Необратимый гидролиз
- Факторы, влияющие на степень гидролиза:
- Гидролиз солей
- Степень гидролиза
- Константа гидролиза
- 1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
- 2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
- 3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
- 4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
- Совместный гидролиз солей
- Влияние различных факторов на протекание гидролиза
- Что такое гидролиз солей
- Гидролиз по катиону
- Гидролиз по катиону и аниону
- Ступенчатый гидролиз
- 📹 Видео
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Видео:Гидролиз солей. 9 класс.Скачать

Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
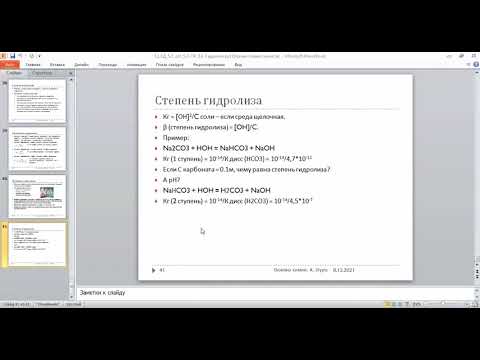
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
[H + ] = 10 -14 /[OH — ] моль/л
pH = -lg[H + ]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Что такое гидролиз солей
| Гидролиз соли — взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита |
В общем случае под гидролизом понимают обменное разложение веществ водой, как органических, так и неорганических. Из неорганических веществ чаще всего гидролизу подвергаются соли.
Количественно гидролиз соли характеризуется степенью гидролиза, который зависит от природы самой соли, концентрации раствора, температуры:
| Степень гидролиза (h) равна отношению числа гидролизованных молекул (n) к общему числу растворенных молекул (N) h=n/N |
Схема реакции гидролиза:
- XY — соль;
- HOH — молекула воды;
- XH — кислота;
- HOY — основание.
Скорость гидролиза растет с:
- повышением температуры;
- увеличением разведения раствора.
Реакция гидролиза, как правило, обратимая, при этом равновесие реакции можно смещать в ту или другую сторону, добавляя к раствору соли сильную кислоту, либо сильное основание.
Всего возможны 4 варианта гидролиза солей, в зависимости от способа образования соли:
- гидролиз по катиону — соль образована сильной кислотой и слабым основанием: NH4NO3, NH4Cl; ZnCl2; [Cu(NO3)2]; AlCl3;
- гидролиз по аниону — соль образована слабой кислотой и сильным основанием: KNO2, Na2CO3; Na2SO3; K2S; CH3COONa;
- гидролиз по катиону и аниону — соль образована слабой кислотой и слабым основанием: NH4CN; Al2S3; NH4NO2; CH3COONH4;
- соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
- сильные кислоты: HNO3, H2SO4, HCl, HBr, HI, HClO4, H2CrO4;
- слабые кислоты: HNO2, HF, HCN, H2SO3, H2CO3, H2S, CH3COOH;
- сильные основания: LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, Sr(OH)2;
- слабые основания: NH4OH, Fe(OH)2, Fe(OH)3, Cr(OH)3, Cu(OH)2, Zn(OH)2, Al(OH)3.
| Сильные основания | Слабые основания | ||
|---|---|---|---|
| Сильные кислоты | гидролиза нет pH=7 | гидролиз по катиону pH 7 | гидролиз по катиону и аниону pH≈7 |
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз по катиону
- NH4NO3 — нитрат аммония образован сильной кислотой и слабым основанием;
- NH4OH — слабое основание;
- HNO3 — сильная кислота.
Уравнение гидролиза по катиону в ионном виде:
В процессе гидролиза катион NH4 + связывает гидроксид-ионы [OH — ] воды (красный цвет), в результате чего появляется избыток катионов водорода [H + ] и раствор становится кислым [H + ]>[OH — ] (pH K + + NO2 — + H OH ↔ HNO2 + K + + OH —
При гидролизе солей по аниону все происходит с точностью, до наоборот — анион слабой кислоты NO2 — связывает катион водорода [H + ] (выделены синим цветом), в результате чего появляется избыток гидроксид ионов [OH — ], раствор становится щелочным [H + ] — ] (pH>7).
Видео:Гидролиз солей.ПримерыСкачать

Гидролиз по катиону и аниону
- NH4CN — цианид аммония образован слабой кислотой и слабым основанием;
- HCN — слабая кислота;
- NH4OH — слабое основание.
Уравнение гидролиза по аниону и катиону в ионном виде:
NH4 + + CN — + H OH ↔ NH4OH + HCN
Реакция раствора соли NH4CN слабощелочная, поскольку Kд(NH4OH)>Kд(HCN).
Кислотность раствора зависит от силы образующихся кислоты и основания. Гидролиз солей, образованных слабыми кислотами и основаниями, идет до конца, если в процессе реакции выпадает осадок или образуется газ.
Ионы солей, образованных сильными кислотами и основаниями, не образуют с ионами воды малодиссоциирующих соединений, поэтому не гидролизуются, раствор при этом остается нейтральным.
Соли, образованные двух(трех)основными кислотами и(или) двух(трех)кислотными основаниями гидролизуются ступенчато.
Видео:11 класс. Гидролиз солей.Скачать

Ступенчатый гидролиз
1) Соль образована слабой многоосновной кислотой и сильным основанием — кол-во ступеней такого гидролиза зависит от основности слабой кислоты.
В качестве примера разберем гидролиз карбоната калия K2CO3.
Соль образована слабой двухосновной кислотой (H2CO3) и сильным основанием (KOH), поэтому, ее гидролиз протекает по аниону (см. выше).
Поскольку кислота H2CO3 является двухосновной, то и гидролиз будет двухступенчатым.
Первая ступень гидролиза карбоната калия:
K2 CO3 + H OH ↔ KOH+K HCO3
Продуктами первой ступени гидролиза карбоната калия являются гидроксид калия (KOH) и кислая соль (KHCO3).
Сокращенное ионное уравнение первой ступени гидролиза:
Вторая ступень гидролиза карбоната калия:
K2 HCO3 + H OH ↔ KOH+ H2CO3
Продуктами второй ступени гидролиза карбоната калия является всё тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Сокращенное ионное уравнение второй ступени гидролиза:
Гидролиз второй ступени протекает в значительно меньшей степени, чем гидролиз первой ступени. Поскольку в процессе гидролиза увеличивается концентрация гидроксид-ионов, среда раствора получившейся соли K2CO3 является щелочной.
2) Соль образована сильной кислотой и слабым многокислотным основанием — кол-во степеней такого гидролиза определяется кислотностью слабого основания.
В качестве примера разберем гидролиз хлорида никеля NiCl2 (II).
Соль образована сильной кислотой (HCl) и слабым основанием (Ni(OH)2), поэтому, ее гидролиз протекает по катиону (см. выше).
Первая ступень гидролиза хлорида никеля в ходе которой катионы никеля связывают гидроксид-ионы воды:
Ni Cl2+H OH ↔ NiOH Cl+HCl
Продуктами первой ступени гидролиза хлорида никеля являются сильная кислота (HCl) и основная соль(NiOHCl).
Сокращенное ионное уравнение первой ступени гидролиза:
Вторая ступень гидролиза:
NiOH Cl+H OH ↔ Ni(OH)2 +HCl
Продукты второй ступени гидролиза хлорида никеля являются сильная кислота и слабое основание.
Сокращенное ионное уравнение второй ступени гидролиза:
Гидролиз второй ступени протекает в значительно меньшей степени, чем гидролиз первой ступени. Поскольку в процессе гидролиза увеличивается концентрация ионов водорода, среда получившегося раствора NiCl2 является кислой.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📹 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Константа гидролиза и pH водного раствора солиСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Степень гидролиза и как её рассчитатьСкачать

76. Гидролиз солей (часть 1)Скачать

Гидролиз солейСкачать

Гидролиз Разбор задачиСкачать