Ко второй аналитической группе относятся катионы Ag + , Pb 2+ , [Hg2] 2+ .
Эти элементы находятся в разных группах периодической системы Д.И. Менделеева. Они имеют либо законченные 18–электронные внешние слои, либо оболочки, содержащие 18+2 электронов в двух наружных слоях, что обуславливает одинаковое отношение их галогенид ионам.
Групповым реагентом на катионы II аналитической группы является 2моль/л раствор хлороводородной кислоты. Катионы Ag + , Pb 2+ , [Hg2] 2+ при взаимодействии с ней образуют труднорастворимые в воде и в разбавленных кислотах осадки белого цвета:
Pb 2+ + 2Cl — → PbCl2
Следует избегать избытка реагента и использования концентрированной хлороводородной кислоты, так как могут образовываться растворимые комплексные соединения:
Растворимость хлоридов различна. При 20 0 C : хлорид свинца – 11,0 г/л, хлорид серебра – 1,8·10 -3 г/л, хлорид ртути (I) — 2,0·10 -4 г/л. При увеличении температуры воды до 100 0 С растворимость PbCl2 увеличивается в 3 раза, в то время как растворимость AgCl и Hg2Cl2 практически остается прежней. Это свойство используется для отделения катионов Pb 2+ от катионов [Hg2] 2+ и Ag + .
Хлорид ртути (I) при взаимодействии с раствором гидроксида аммония образует амидохлорид ртути (I), который неустойчив и разлагается на малорастворимый амидохлорид ртути (II) и металлическую ртуть, которая придает осадку черный цвет:
Это позволяет отделить катион [Hg2] 2+ от катиона Ag + .
Хлорид серебра растворим под действием раствора гидроксида аммония с образованием комплексного соединения хлорида диамминсеребра (I):
Из выше изложенного следует, что наиболее растворимым является осадок хлорида свинца, вследствие чего он не полностью осаждается с этой группой катионов и частично остается в растворе.
Нитраты серебра, свинца и ртути (I) хорошо растворимы в воде. Растворимость сульфатов невелика и уменьшается в ряду Ag + — [Hg2] 2+ — Pb 2+ . Карбонаты и сульфиды плохо растворимы в воде. Гидроксид серебра неустойчив, ртути – не существует (только оксид), а гидроксид свинца амфотерен. Соли ртути (I) не устойчивы и склонны к реакциям диспропорционирования с выделением свободной ртути и образованием соответствующих соединений ртути (II).
Действие группового реагента HCl на катионы II аналитической группы (Ag + , Pb 2+ , [Hg2] 2+ ).
Хлороводородная кислота образует со всеми катионами II группы малорастворимые осадки белого цвета. Реакция HCl с катионами Ag + — ФАРМАКОПЕЙНАЯ. (Химизм реакции смотри выше, в общей характеристике группы).
Методика: Берут 3 пробирки. В первую помещают 3-4 капли раствора нитрата ртути (I), во вторую – 3-4 капли раствора нитрата серебра, в третью 3-4 капли раствора нитрата свинца. Во все три пробирки добавляют 3-4 капли 2моль/л раствора хлороводородной кислоты. Наблюдают образование белых осадков во всех трех пробирках. В первую и вторую пробирку добавляют (избыток) 6-8 капель раствора аммиака, в третью – 5 капель воды и нагревают.
Наблюдают за происходящими явлениями.
Аналитические реакции катиона (Ag + ).
Внимание! Соли серебра ядовиты! Работать осторожно!
1. Реакция с иодидом калия.
Иодид калия с катионом Ag + образует желтый осадок иодида серебра AgI, не растворимый в концентрированном растворе аммиака:
Методика: Помещают в пробирку 2-3 капли раствора нитрата серебра, добавляют 2-3 капли иодида калия или натрия. Наблюдают образование осадка желтого цвета.
2. Реакция с бромидом калия.
Бромид калия с катионами Ag + образует бледно- желтый осадок бромида серебра AgBr, который частично растворим в концентрированном растворе аммиака:
Методика: Помещают в пробирку 2-3 капли нитрата серебра, добавляют 2-3 капли бромида калия. Наблюдают образование осадка бледно-желтого цвета.
3. Реакция с хроматом калия.
Хромат калия с катионами Ag + в нейтральной или слабоуксусной среде образует осадок Ag2CrO4 кирпично –красного цвета:
Осадок растворяется в концентрированном растворе аммиака, в аммиачной , сильнокислой средах осадок не образуется.
Ионы Pb 2+ , Ba 2+ и др. дающие осадки с CrO4 2- , мешают проведению данной реакции.
Методика: В пробирку помещают 2-3 капли раствора нитрата серебра и добавляют 1-2 капли раствора хромата калия. Наблюдают за образованием осадка. Проверяют растворимость осадка в уксусной кислоте и концентрированном растворе аммиака.
Аналитические реакции катиона [Hg2] 2+ .
Внимание! Все соли ртути ядовиты, требуют осторожного обращения!
Легко образуют амальгамы, не допускать попадания на золотые украшения!
1. Восстановление [Hg2] 2+ до Hg хлоридом олова (П).
При действии на раствор соли ртути (I) раствором хлорида олова (II) вначале образуется белый осадок Hg2Cl2 , который при стоянии постепенно темнеет вследствие восстановления ионов [Hg2] 2+ до металлической ртути
Hg2Cl2 + Sn 2+ +2Cl — → 2Hg + Sn 4+ + 4Cl —
Ионы ртути (II) мешают определению, так как дают аналогичный эффект.
Методика: В пробирку помещают 2- 3 капли раствора нитрата ртути (I), добавляют 2-3 капли раствора хлорида олова (II). Выделяется белый осадок, который постепенно темнеет.
2. Восстановление [Hg2] 2+ ионов металлической медью.
Методика: На очищенную наждаком медную пластинку наносят каплю раствора нитрата ртути (I). Через некоторое время появляется серое пятно амальгамы, которое после удаления раствора и протирания поверхности фильтровальной бумагой остановится блестящим:
[Hg2] 2+ + Cu → Cu 2+ + 2 Hg
Соли ртути (II) дают аналогичный эффект.
3. Реакция с иодидом калия.
Иодид калия образует с катионами ртути (I) осадок Hg2I2:
Осадок растворим в избытке реактива с образованием тетраиодогидраргират (II) калия и черного осадка металлической ртути:
Методика: В пробирку помещают 2-3 капли раствора нитрата ртути (I) и добавляют 2-3 капли раствора иодида калия. Выделяется грязно-зеленый осадок Hg2I2. К полученному осадку добавляют избыток реактива. Наблюдают за происходящими явлениями.
4. Реакция с хроматом калия.
Хромат калия K2CrO4 образуют с катионами [Hg2] 2+ красный осадок хромата ртути (I), растворимый в азотной кислоте:
Методика: в пробирку помещают 2-3 капли раствора нитрата ртути (I) Hg2(NO3)2. Добавляют 2-3 капли хромата калия. Выпадает осадок красного цвета.
5. Реакция с раствором гидроксида аммония.
Нитрат ртути (I) реагирует с раствором гидроксида аммония с образованием темного осадка смеси металлической ртути и [OHg2NH2]NO3
Методика: К 2-3 каплям раствора нитрата ртути (I) помещают в пробирку, добавляют 6 капель раствора гидроксида аммония. Выпадает осадок черного цвета.
Аналитические реакции катиона Pb 2+ .
1. Реакция с серной кислотой или растворимыми сульфатами.
Серная кислота или растворимые сульфаты осаждают катионы свинца в виде белого осадка сульфата свинца. Осадок растворяется при нагревании в растворах гидроксидов щелочных металлов с образованием гидроксокомплексов:
Сульфат свинца так же растворим в 30 % растворе ацетата аммония:
Методика: В пробирку помещают 5 капель раствора нитрата свинца, добавляют равный объем раствора сульфата натрия или сульфата калия, выпадает белый осадок. Разделяют осадок на 2 части. К одной добавляют гидроксид натрия или калия, к другой – 30 % раствор ацетата аммония. Осадок в обоих случаях растворяется.
2. Реакция с хроматом калия.
Хромат калия с катионами свинца образует желтый кристаллический осадок PbCrO4, растворимый в гидроксидах щелочных металлов, но не растворимый в уксусной кислоте:
Методика: В пробирку помещают 2-3 капли раствора соли свинца, добавляют 3 капли раствора хромата калия. Выпадает желтый кристаллический осадок. Проверяют его растворимость в уксусной кислоте и гидроксиде натрия или калия.
3. Реакция с иодидом калия или натрия, реакция «золотого дождя», (ФАРМАКОПЕЙНАЯ).
Иодид натрия или калия с катионами свинца образует кристаллический осадок PbI2 желтого цвета, растворимый в избытке реактива с образованием комплексного соединения тетраиодоплюмбат (II) калия:
Pb 2+ + 2 I — → PbI2
Иодид свинца растворим в горячей воде и в уксусной кислоте. Растворимость осадка в горячей воде используют как дополнительную реакцию обнаружения катионов свинца, так как при охлаждении раствора осадок иодида свинца выпадает в виде золотистых чешуек. Реакция специфична.
Методика: В пробирку помещают 3-5 капель раствора соли нитрата свинца, добавляют 3 капли раствора иодида калия или натрия. Выпадает осадок желтого цвета. Прибавляет несколько капель воды и нагревают. Осадок растворяется. Быстро охлаждают пробирку под струей водопроводной холодной воды. Вновь выделяется осадок в виде блестящих золотистых кристаллов.
Видео:Качественные реакции на катионы. 9 класс.Скачать

Разделение ионов серебра, ртути и свинца
Используя окись алюминия в качестве носителя и иодид калия в качестве осадителя, можно разделить ионы серебра, ртути н свинца в виде иодндов.
Аппаратура и реактивы
Хроматографическая колонка, заполненная окисью алюминия с иодидом калия (0,5 мг-экв на 1 г носителя).
Нитраты серебра, ртути(II), свинца, 0,01%-ные растворы.
Выполнение опыта. Хроматографическую колонку закрепить в пробке и вставить в склянку Бунзена, соединенную с водоструйным насосом. Подготовить смесь, содержащую по 1 мл растворов нитратов серебра, ртути (II) и свинца и 20 мл воды. Пропустить смесь через колонку п промыть водой. Образуются окрашенные зоны: верхняя — желтый иодид серебра, средняя — оранжевый иодид ртути и нижняя — желтый иодид свинца.
Видео:Качественные реакции на катионы II аналитической группы. Кузьмич Е.ССкачать
Групповые реакции катионов по кислотно-основному методу
Например
1. Обнаружение 

 , , | (3) |
 . . | (4) |
2. Обнаружение 
 . . | (5) |
Мешающим ионом является 
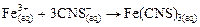 . . | (6) |
Красная окраска раствора «забивает» синий цвет и обнаружение 

§ Маскировка комплексообразованием заключается в переводе 
 | (7) |
или оксалатных комплексов
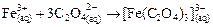 , , | (8) |
которые не мешают определению кобальта с тиоцианатом.
§ Маскировка восстановлением 

 . . | (9) |
Систематический анализ применяют, если анализируемый раствор является сложным по качественному составу и дробный анализ невозможен из-за наличия большого количества мешающих ионов. В этом случае применяют систематический метод анализа.
Систематический метод качественного анализа основан на том, что сначала с помощью групповых реагентов разделяют смесь ионов на группы и подгруппы, а затем в пределах этих подгрупп обнаруживают каждый ион с использованием качественных реакций. В зависимости от вида групповых реагентов различают различные методы систематического анализа: сероводородный, кислотно-основной, аммиачно-фосфорный и другие.
Для студенческого практикума предлагается использовать, как более простой и наглядный, систематический анализ катионов кислотно-основным методом. При этом состав анализируемых растворов упрощен и ограничен наиболее часто встречающимися элементами, содержащимися в полиметаллических рудах цветных металлов, продуктах их обогащения, соответствующих полупродуктах, отходах производств, сточных и рудничных водах, характерных для предприятий, работающих по профилю специальностей Санкт-Петербургского государственного горного института. Поэтому в настоящем руководстве рассмотрены растворы, которые содержат только следующие катионы: 







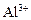










1. Систематический анализ катионов
В качестве групповых реагентов кислотно-основного метода анализа применяют соляную и серную кислоты, щелочи и гидроксид аммония. Кислотно-основной метод анализа основан на выделении шести аналитических групп:
I группа содержит 


II группа содержит 


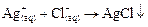 . . | (10) |
По этому принципу группа называется хлоридной.
III группа содержит 

 . . | (11) |
По этому признаку группа называется сульфатной. Сульфат кальция более растворим, чем сульфат бария и для уменьшения его растворимости добавляют при нагревании этиловый спирт или ацетон.
IV группа содержит 


При действии избытка щелочи на ионы Zn 2+ , Al 3+ , Cr 3+ образуются гидроксокомплексы этих металлов:
 | (12) |
где n = 4 или 6, Ме — Zn, Al, Cr.
При недостатке щелочи при рН = 5-11 образуются осадки гидроксидов этих металлов:
 , , | (13) |
которые растворяют при добавлении щелочи:
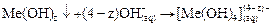 . . | (14) |
Хром (III) обычно в ходе анализа окисляют пероксидом водорода в щелочной среде до хромата, в котором хром шестивалентен:
 . . | (15) |
Действием гидроксида натрия достигается разделение катионов IV и V групп. Элементы IV группы в щелочной среде остаются в растворе в виде гидроксокомплексов, а катионы V группы выпадают в осадок с образованием соответствующих гидроксидов.
V группа содержит 


 . . | (16) |
С помощью гидроксида аммония достигается также разделение катионов IV и VI групп.
Примечание: гидроксид магния осаждают в сильнощелочной среде при рН>11,5, что требует добавления раствора 
VI группа содержит 




 . . | (17) |
Схема разделения анализируемого раствора на выделенные группы катионов в соответствии с их составом и групповыми реакциями приведена на рис. 1. Чтение и понимание такого рода схем является особенно полезным для студентов металлургических, обогатительных и экологических специальностей, технологическую основу которых составляют различные процессы разделения компонентов (минералов, ионов и т.д.).
Групповые реакции катионов по кислотно-основному методу
Систематический анализ применяют, если анализируемый раствор является сложным по качественному составу и дробный анализ невозможен из-за наличия большого количества мешающих ионов. В этом случае применяют систематический метод анализа. Систематический метод качественного анализа основан на том, что сначала с помощью групповых реагентов разделяют смесь ионов на группы и подгруппы, а затем в пределах этих подгрупп обнаруживают каждый ион с использованием качественных реакций.
I группа содержит 


II группа содержит 


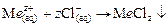
Ход анализа: В одну пробирку отобрать несколько капель соли серебра, во вторую – свинца (II), в третью – ртути (I). К каждой пробирке прилить 1-2 капли соляной кислоты. Наблюдать образование осадков хлоридов металлов.
К пробирке, содержащей осадок хлорида свинца прилить немного горячей воды. Произойдет растворение осадка. Реакция позволяет отделить катионы свинца от ионов ртути и серебра.
К пробирке, содержащей осадок хлорида серебра добавить избыток аммиака. Произойдет растворение осадка хлорида серебра за счет образования растворимого аммиачного комплекса серебра [Ag(NH3)2] + . Данная реакция позволяет отделить ионы серебра от ионов свинца и ртути.
III группа содержит 


Ход анализа: В пробирку отобрать несколько капель соли кальция и прилить 1-2 капли серной кислоты. Без добавления ацетона осадок сульфата кальция не образуется. Добавить ацетон, хорошо перемешать – начнется выпадение осадка CaSO4. В другую пробирку отобрать несколько капель соли бария, прилить 1-2 капли серной кислоты и наблюдать образование кристаллического осадка сульфата бария.
IV группа содержит 




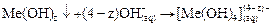
Ход анализа. В три пробирки отобрать соль алюминия, соль цинка и соль хрома соответственно. В каждую пробирку осторожно прибавлять разбавленную щелочь до образования осадка гидроксида металла. Полученные осадки растворить при добавлении нескольких капель крепкого раствора щелочи.
Хром (III) обычно в ходе анализа окисляют пероксидом водорода в щелочной среде до хромата, в котором хром шестивалентен:
Действием гидроксида натрия достигается разделение катионов IV и V групп. Элементы IV группы в щелочной среде остаются в растворе в виде гидроксокомплексов, а катионы V группы выпадают в осадок с образованием соответствующих гидроксидов.
Ход анализа. В пробирку налить по 2-3 капли солей железа и хрома. Добавить избыток крепкого раствора щелочи и отфильтровать. Наблюдать разделение железа (III) – в осадке – и хрома (III) – в фильтрате, в окрашенном в зеленый цвет растворе.
V группа содержит 



Ход анализа. В три пробирки налить по 2-3 капли соли железа (III) марганца (II) и магния соответственно. К каждой пробирке добавить несколько капель гидроксида аммония. Наблюдать образование осадков гидроксидов металлов. Примечание: гидроксид магния осаждают в сильнощелочной среде при рН>11,5, что требует добавления раствора 
VI группа содержит 





Ход анализа. В разные пробирки отобрать по несколько капель солей никеля, меди, кадмия, кобальта, ртути (II). В каждую пробирку налить избыток гидроксида аммония. Наблюдать образование аммиачных комплексов указанных металлов. Отметить цвет образующихся аммиакатов.
С помощью гидроксида аммония достигается также разделение катионов IV и VI групп.
В пробирку отобрать по 2-3 капли растворов солей железа и меди. Добавить избыток аммиака. Отфильтровать.
В пробирку прилить по 2-3 капли растворов солей меди и магния. Добавить избыток аммиака, а затем – несколько капель щелочи. Образуется белый осадок гидроксида магния, хорошо заметный на синем фоне раствора аммиаката меди.
2. Качественные аналитические реакции катионов
2.1. первая аналитическая группа катионов
2.1.1. Катион 
Определяется по обменной реакции с дигидроантимонатом калия, образующим с водным раствором соли натрия в нейтральной среде (pH
7) белый кристаллический осадок дигидроантимоната натрия:
 . . | (18) |
Примечание: при рН 2+ от Al 3+ , который с K4[Fe(CN)6] осадка не образует.
Ход анализа. К нескольким каплям соли цинка добавить гексацианоферрат (II) калия до выпадения белого осадка.
В. В отсутствие солей кобальта, никеля и железа, цинк определяют по реакции с тетрароданомеркуриатом аммония (NH4)2[Hg(CNS)4], приводящей к образованию белого осадка тетрароданомеркуриата цинка:
 . . | (32) |
Примечание. Данную реакцию ведут в слабокислой среде, т.к. осадок Zn[Hg(CNS)4] в сильных кислотах растворим, а под действием щелочей применяемый реагент (NH4)2[Hg(CNS)4] разлагается с образованием желтого осадка HgO.
Ход анализа. К нескольким каплям соли цинка добавить тетрароданомеркуриат аммония до выпадения белого осадка.
2.4.2.Катион
Растворы солей хрома (III) имеют зеленую окраску. Растворы солей хрома (VI), в щелочных средах представленные хроматами, окрашены в желтый цвет, а в более кислых средах, представленные дихроматами, имеют оранжевую окраску.

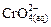
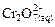
А. Определение Cr (III) основано на предварительном его окислении пероксидом водорода в щелочной среде до хроматов:
 | (33) |
с последующей его идентификацией по реакции с хлоридом бария (или нитратом свинца (II)), приводящей к образованию желтого осадка хромата бария (свинца):
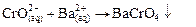 или или | (34) |
 | (35) |
Ход анализа. К 2-3 каплям раствора соли хрома (III) добавить щелочь до полного растворения образующегося осадка гидроксида хрома (III), а затем 5-7 капель 30 % раствора пероксида водорода и кипятить до исчезновения мелких пузырьков. Желтый цвет полученного раствора свидетельствует о полном окислении хрома (III). К полученному желтому раствору добавить раствор соли бария или свинца до выпадения желтого осадка хромата.
При наличии в растворе сульфат-ионов, проверка раствора на наличие в нем ионов хрома может быть осуществлена следующими двумя способами (Б и В):
Б. Перевод хромат-ионов в дихромат-ионы в кислой среде по реакции:
 . . | (36) |
Образующийся по реакции дихромат калия имеет оранжевую окраску. В избытке добавляемой кислоты, т.е. в сильнокислых растворах, возможен переход окраски из оранжевой в красную за счет образования полихроматов: 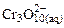
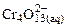
Ход анализа. К полученному по реакциям (33) желтому раствору хромата калия добавить по каплям раствор серной кислоты до перехода окраски в оранжевую и красную.
В. После образования дихромата по реакциям (33) и (36) в кислой среде его переводят в надхромовую кислоту перекисью водорода в присутствии амилового спирта:
 | (37) |
Надхромовая кислота имеет синий цвет. В водных растворах быстро разлагается с образованием зеленого раствора хрома (III), поэтому соответствующую реакцию проводят в присутствии амилового спирта, в котором раствор надхромовой кислоты значительно устойчивее.
Ход анализа. К 2-3 каплям полученного по реакциям (33) и (36) раствора дихромата добавить 5-6 капель пероксида водорода (3 %), 2 мл амилового спирта и избыточное количество раствора 20 % серной кислоты. После интенсивного перемешивания верхний слой амилового спирта окрасится в синий цвет.
2.4.3.Катион
Характерным и очень чувствительным реактивом обнаружения алюминия является алюминон (ауринтрикарбонат аммония) — сложное органическое соединение, образующее с 
 . . | (38) |
Реакция протекает только при pH»5 в среде ацетатного буферного раствора ( 
Ход анализа. К 2 мл исходного раствора соли алюминия добавить по каплям уксусную кислоту и ацетат натрия в соотношении 1:2. Перемешать и проверить рН. Точно значение рН = 5 устанавливают добавлением уксусной кислоты (при рН>5) или ацетата натрия (при рН 2+ с гексацианоферратом (II) калия. При рН£7 образуется красно-бурый осадок гексацианоферрата (II) меди:
 . . | (45) |
Осадок не растворим в разбавленных кислотах, но растворяется в аммиаке и разлагается при действии щелочей.
2.6.2.Катион
Никель определяется по реакции с диметилглиоксимом в аммиачной среде (рН»8-10), с которым он образует малиновый осадок внутрикомплексной соли — диметилглиоксимата натрия
 | (46) |
Диметилглиоксим (реактив Чугаева) является двухдентатным лигандом со структурной формулой:
 |
имеющим два донорных атома азота. Реактив очень чувствителен к иону 
Ход анализа. К 2-3 каплям раствора соли никеля добавить 1-2 капли раствора диметилглиоксима и несколько капель разбавленного раствора гидроксида аммония до рН»8-10.
2.6.3. Катион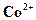

 . . | (47) |
Ход анализа. К 2-3 каплям раствора соли кобальта (II) добавить 1-2 капли ацетатного буфера (pH»5), избыток тетрароданомеркурата аммония, 1-2 капли раствора сульфата цинка и перемешать. Примечание. Выпадение осадка может происходить через некоторое время после смешивания реактивов.
2.6.4.Катион
Определяется по реакции с сероводородом при рН=0,5-0,8 с образованием желтого осадка сульфида кадмия, в разбавленных растворах образуется коллоидный раствор также желтого цвета
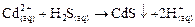 . . | (48) |
Ход анализа. К нескольким каплям соли кадмия добавить сероводородную воду до образования желтого осадка или коллоидного раствора того же цвета.
2.6.5.Катион 
Способом обнаружения 
 | (49) |
с образованием медно-ртутной амальгамы (светлое пятно).
Ход анализа. Медную пластину предварительно обработать азотной кислотой для удаления пассивирующей пленки оксида меди, промыть водой и протереть фильтровальной бумагой. На подготовленную медную пластину капнуть раствор нитрата ртути (II) и наблюдать образование светлого металлического пятна.
3. Краткие указания по технике выполнения
Для усвоения методики кислотно-основного метода систематического анализа и приобретения необходимой лабораторной практики студентам в индивидуальном порядке предлагается выполнение четырех аналитических работ, методические указания, по которым приведены в разделах 3-6.
Каждая аналитическая работа выполняется по приведенной схеме анализа и соответствующему ее описанию. Для выполнения анализа отбирается часть (1/3 или 1/2) предложенной задачи, что соответствует
2/3 пробирки. Другая часть задачи остается в качестве резервной.
Любая химическая реакция осуществляется в пробирке при перемешивании стеклянной палочкой. В редких случаях реакцию проводят непосредственно в фильтровальной воронке с бумажным фильтром. В последнем случае перемешивание должно быть особо осторожным, предупреждающим повреждение бумажного фильтра. При необходимости нагрева реакционной смеси или ее кипячения эти операции проводят в пробирках на песчаной бане с использованием специальных держателей.
Операции фильтрования проводят на бумажных фильтрах марки «синяя лента». Сбор фильтрата осуществляют в пробирку. При необходимости сбора осадка, его осуществляют переносом осадка с бумажного фильтра в сухую пробирку. В отдельных случаях, главным образом, в операциях разделения отдельных аналитических групп, требуется промывка осадка на фильтре дистиллированной водой. Операцию промывки проводят на фильтре основной операции, но промывные воды собирают в отдельную пробирку и не используют.
В операциях разделения отдельных аналитических групп требуется проверка полноты осаждения. Полнота осаждения контролируется путем добавления небольших количеств используемого группового реагента к полученному фильтрату. Если имеет место повторное выпадение осадка, его отфильтровывают на первичном фильтре, содержащем основной осадок, и повторно проверяют полноту осаждения. Операцию повторяют до полного осаждения.
Любая качественная аналитическая реакция является «капельной», т.е. для ее выполнения достаточный объем пробы составляет несколько капель (обычно от 2-х до 5-ти). При проведении этих реакций следует использовать указания раздела 2 и сведения таблицы приложения.
Во многих случаях при осуществлении реакций требуется контроль рН, который осуществляют с помощью универсального бумажного индикатора. Техника измерения рН предусматривает нанесение капли анализируемого раствора стеклянной палочкой на бумагу-индикатор. Величину рН определяют по цветовой гамме индикатора.
📸 Видео
Катионы 1 аналитической группыСкачать

Химия, 12-й класс, Реакции идентификации катионов (I-III)Скачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Аналитическая химия Первая группа катионовСкачать

катионыСкачать

Химия, 12-й класс, Анализ смеси катионовСкачать

Катионы 4-ой аналитической группы (кислотно-основная классификация)Скачать

Катионы 2 аналитической группыСкачать

Катионы 3 аналитической группыСкачать

Качественные реакции на катионы I аналитической группы. Кузьмич Е.ССкачать

Химия, 12-й класс, Аналитические группы катионовСкачать

Контрольный анализ смеси катионов І, ІІ, ІІІ аналитических групп. Кузьмич Е.ССкачать

Отливаю свинцовые заготовки 2.Скачать

Качественный анализ на анионыСкачать

Очистка серебра от примесей / Purification of silver from impuritiesСкачать

#Как отделить #цинк от #свинца #How to separate #zinc from leadСкачать

Cвинцевание. Пористый свинец .Скачать

ЗОЛОТО ИЗ СВИНЦА! СЕКРЕТНАЯ ТЕХНОЛОГИЯ! НАСТОЯЩАЯ АЛХИМИЯ!!!Скачать