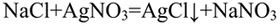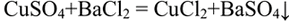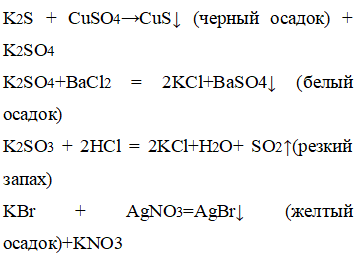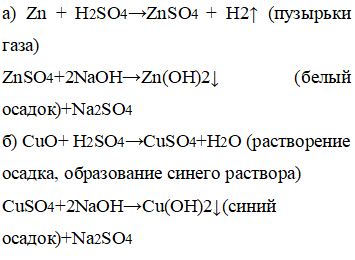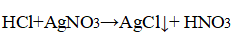- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Нитрат меди: количественные и качественные характеристики
- Вопросы к параграфу 22 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 22. Практическая работа №4
- Решение экспериментальных задач по теме “Кислород и сера”
- 1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
- 2. Дан раствор сульфата меди (II). Получите из него раствор хлорида меди(II).
- 3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
- 4. Проделайте опыты но осуществлению следующих превращений:
- а) цинк→сульфат цинка→гидроксид цинка
- б) оксид меди(II)→сульфат меди(II)→гидроксид меди(II)
- 5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
- 6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
- 💥 Видео
Видео:Получение нитрата меди(Cu(NO3)2)Скачать

We are checking your browser. gomolog.ru
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701f91d819d0c795 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие нитрата с медью и серной кислотойСкачать

Нитрат меди: количественные и качественные характеристики
Термин «нитрат» в химии означает соль всем известной азотной кислоты, которая содержит отрицательно заряженную часть NO3. В минералогии и сельском хозяйстве до сих пор весьма часто употребляется другое обозначение нитратов – «селитры», однако и здесь это название постепенно вытесняется научно более обоснованным.
Рассматривая основные химические свойства нитратов, стоит, в первую очередь, отметить, что образуются они при взаимодействии азотной кислоты с оксидами, солями и, чаще всего, с металлами. В условиях комнатной температуры практически все нитраты обладают высокой устойчивостью, а вот при повышении температуры до 200-6000°С они начинают плавиться, постепенно разлагаясь на составляющие элементы.
Кстати, по тому, на какие элементы разлагаются нитраты, можно судить о том, какое место у них в электрохимическом ряду напряжений металлов. В частности, все нитраты, которые при разложении дают нитриты и молекулы кислорода, содержат в себе металлы, находящиеся левее магния (например, литий, барий, алюминий, кобальт). Те же нитраты, которые, разлагаясь, образуют оксиды азота и металла, а также кислород располагаются в электрохимическом ряду в промежутке от магния до меди.
Нитрат меди ведет себя по-особому: при его разложении кислород не выделяется, а образуется двухвалентный оксид меди и диоксид азота. А, например, раствор нитрата серебра, разлагаясь при температуре «всего лишь» 1700°С, выделяет не только чистый кислород с четырехвалентным оксидом азота, но и непосредственно молекулы серебра.
Также стоит отметить, что абсолютно все нитраты являются сильнейшими окислителями, причем именно в твердом состоянии. А вот в растворе они свои окислительные свойства теряют, отличаясь, тем самым, от той же азотной кислоты.
Уже с древнейших времен люди заметили, что соли азотной кислоты и, в первую очередь, нитраты являются отличными удобрениями, которые обладают способностью восстанавливать плодородность почвы. Позднее значительная часть нитратов стала использоваться при создании взрывчатки и лекарственных препаратов.
Особая роль среди всех нитратов принадлежит нитрату меди.
Нитрат меди (Cu(NO3)2) представляет собой сложное неорганическое вещество, по своему строению и химическим свойствам относящееся к солям меди и азотной кислоты. По своим физическим свойствам нитрат меди является твердым веществом с кристаллической решеткой, прекрасно растворяющимся в воде и ряде других растворах (например, в этаноле, аммиачной жидкости, этилацетате). В то же время, как и ряд других солей азотной кислоты, нитрат меди хорошо поглощает влагу, образуя специфические кристаллы темно-синего цвета, которые расплываются в воздухе с высокой относительной влажностью.
Химические свойства данного нитрата связаны, с одной стороны, с тем, что молярная масса меди – величина постоянная и равняется 64 г/моль, а с другой, — со способностью нитрата меди впитывать влагу, изменяя тем самым и свое название (нитрат – тригидрат – гексагидрат), и свои свойства. Так, например, безводный гидрат меди разлагается при температуре в 1700°С, а тригидрат – уже при 1200°С.
Молярная масса меди имеет значение и в том, что основным способом получения безводного нитрата меди является синтез молекул меди и четырехвалентного оксида меди. При этом следует иметь в виду, что нитрат меди является достаточно токсичным веществом, поэтому и его производство, и его хранение должны осуществляться в соответствии со всеми основными требованиями правил техники безопасности. В частности, необходимо опасаться того, чтобы это вещество не попало на слизистые оболочки или на кожу человека, так как в этом случае наблюдается раздражение, которое может вызвать различные заболевания.
Кстати, практически все нитраты вызывают те или иные поражения кожного покрова. Например, тот же раствор нитрата серебра при соприкосновении с кожей человека вызывает появление черных пятен, а если продержать его достаточно долго, то это может закончиться ожогом.
Видео:Смесь, содержащую 19 г нитрата меди (II) и 17 г AgNO3, в течение 3860 с подвергли электролизу токомСкачать

Вопросы к параграфу 22 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Термическое разложение нитрата меди | Cu(NO3)2 = CuO + 2NO2 + O2Скачать

§ 22. Практическая работа №4
Решение экспериментальных задач по теме “Кислород и сера”
1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
Поместили лакмус и нитрат серебра в три пробирки с растворами
В пробирке, где находилась серная кислота, лакмус окрасился в красный цвет. в пробирке. где находился хлорид натрия, после добавления нитрата серебра выпал белый осадок.
Серная кислота при взаимодействии с лакмусом окрашивает его в красный цвет (кислота закисляет среду, остальные две соли образованы сильными основаниями и сильными кислотами→не гидролизируются и дают нейтральную среду→лакмус не меняет цвет.)
Качественная реакция на хлориды — выпадение белого осадка хлорида серебра:
В пробирке. где лакмус не поменял цвет. находится сульфат натрия.
2. Дан раствор сульфата меди (II). Получите из него раствор хлорида меди(II).
Поместили к раствору сульфата меди раствор хлорида бария.
Сульфат бария выпадает в осадок.
Качественной реакцией а сульфаты является выпадение осадка сульфата бария. Одновременно таким способом можно получить и хлорид меди:
3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
Добавили к сульфиду калия сульфат меди, к сульфату калия добавили хлорид бария, к сульфиту калия – соляную кислоту, к бромату калия – нитрат серебра.
В пробирке с сульфидом калия выпал черный осадок, с сульфатом калия – белый осадок, с бромидом калия – желтый осадок, с сульфитом калия – появился резкий запах.
С помощью качественных реакции можно определить каждый представленный анион:
4. Проделайте опыты но осуществлению следующих превращений:
а) цинк→сульфат цинка→гидроксид цинка
б) оксид меди(II)→сульфат меди(II)→гидроксид меди(II)
а) К цинку добавили серную кислоту, а далее гидроксид натрия.
б) К оксиду меди добавили серную кислоту, а далее гидроксид натрия.
а) Вследствие добавления кислоты образовались пузырьки газа, вследствие добавления щелочи образовался белый осадок.
б) Вследствие добавления кислоты образовался синий раствор, вследствие добавления щелочи образовался синий осадок.
5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
Добавили к цинку, нитрату стронция, хлориду натрия, хлориду кальция и хлориду меди серную кислоту.
При взаимодействии серной кислоты с цинком образовались пузырьки газа (окислитель-восстановительная реакция — цинк и водород изменяют свои степени окисления), с нитратом стронция — выпал белый осадок, с хлоридами натрия и меди — реакции нет.
Реакция с серной кислотой идёт с металлами, стоящими в электрохимическом ряду до водорода, с солями, если в результате реакции выпадает осадок и вытесняет летучие кислоты из солей.
6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
Добавили к соляной и серной кислоте лакмус; поместили к соляной кислоте нитрат серебра, к серной кислоте добавили хлорид бария.
Лакмус окрасился в красный цвет; после добавления реагентов выпали белые осадки. Тот факт, что лакмус окрасился в красный, говорит о том, что в составе веществ присутствует H+.
Появление осадка хлорида серебра говорит о наличии в составе соляной кислоты хлорид-аниона:
Появление осадка сульфата бария говорит о наличии в составе серной кислоты сульфат-аниона:
💥 Видео
Термическое разложение Cu(NO3)2Скачать

Химия. 9 класс. Качественный анализ состава неорганического соединения /16.10.2020/Скачать

Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O | Реакция меди и азотной кислотыСкачать

Электролиз раствора соли нитрата меди Cu(NO3)2 | Схема электролиза солиСкачать

Лабораторный опыт №3 «Определение катионов Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Cu2+ по окраш плам». 9 клСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Получение Тетраамминокупрохлората - [Cu(NH3)4]ClO3.Скачать
![Получение Тетраамминокупрохлората - [Cu(NH3)4]ClO3.](https://i.ytimg.com/vi/u8M1lMmm4l0/0.jpg)
Нитрат уранила UO2(NO3)2. Тест собранных частичек.Скачать

Получение нитрита из нитрата / Transformation of nitrate into nitriteСкачать

Растворение нитрата аммония. Химический опытСкачать

ЦИТРАТ МЕДИ - ПолучениеСкачать

Лабораторная работа по ионообменной хроматографииСкачать

Нитрат и сульфат меди, откуда белая муть в растворе.Скачать

Практическое занятие #11 . Качественный анализ анионов всех трех группСкачать