При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Разложение на множители что значит и как раскладывать на простые множители число, корни, трехчлен, квадратное уравнение, примеры и решения, правило и алгоритм
- Термины и понятия
- Вынесение коэффициента
- Формулы умножения
- Метод группировки
- Выделение квадрата
- Неприводимые множители
- Использование онлайн-калькуляторов
- Как решать химические уравнения — схемы и примеры решения для разных реакций
- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта
Видео:Реакции разложения. Как понять?Скачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение солей
Видео:Математика| Разложение квадратного трехчлена на множители.Скачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:7. Вычисление определителей 3, 4 порядков. Разложение определителя по элементам строки (столбца)Скачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Решение квадратных уравнений. Метод разложения на множители. 8 класс.Скачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Квадратный Трехчлен / Разложение квадратного трехчлена на множители, Как решать Квадратные УравненияСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Разложение перманганата калия
Видео:Разложение квадратного трехчлена на множители. 8 класс.Скачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:Произведение многочленов. Разложение многочлена на множители способом группировки. 7 класс.Скачать

Разложение на множители что значит и как раскладывать на простые множители число, корни, трехчлен, квадратное уравнение, примеры и решения, правило и алгоритм
При решении математических уравнений часто приходится преобразовывать равенства для упрощения выражений. Делается это с помощью разложения на множители. Приводить к простому виду можно как многочлены, так и одночлены, при этом необязательно знать даже формулы. Для решения сложных заданий можно воспользоваться онлайн-калькулятором. Пользоваться им несложно, главное, иметь чёткое условие задачи и доступ к интернету.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Термины и понятия
Под разложением в математике понимается операция, которую выполняют для превращения сложного неудобного для вычисления примера в простой. В учебниках и литературе такое преобразование выражений называется тождественным, то есть без изменения сути задания.
Из слова «множители» можно понять, что в превращении используется умножение. Зная, как разложить полином на простые числа, можно быстро решать задачи на действия с корнями и сложными дробями. Например, выражение (3*h*y + 9*y — 8*h — 24) * (3*h — 8) после упрощения примет вид: h + 3 — и быстро решается в уме.
В математике все алгебраические выражения могут быть:
Числа часто записывают в так называемом стандартном виде. Например, 296,8 = 2,968 * 102. То есть используется формула приведения: a * 10r, где 1≤а Простое разложение
На уроках математики ученикам предлагают разложить на простые множители числа с помощью столбика (двух колонок). Делается это по следующему алгоритму. Исходное число проверяют на возможность деления без остатка на два. Если делится, то рисуют две колонки, в правую вписывают двойку, а в левую число, получившееся после деления на него исходного. В обратном случае вместо двойки используют цифру три. Далее действия повторяют для числа, находящегося уже в правой колонке. Выполняют деление до тех пор, пока в левой колонке не останется единица. Например, число 1176 можно разложить следующим образом:
1176 | 2 (1176 / 2 = 588).
588 | 2 (588 / 2 = 294).
294 | 2 (294 / 2 = 147).
147 | 2 (147 / 3 = 49).
1176 = 2 * 2 * 2 * 3 * 7 * 7 = 23 * 3 * 72.
Для того чтобы понять алгоритм, лучше рассмотреть ещё несколько интересных примеров:
- 7140 = 2 • 2 • 3 • 5 • 7 • 17 = 2 2 • 3 • 5 • 7 • 17;
- 5544 = 2 • 2 • 2 • 3 • 3 • 7 • 11 = 2 3 • 32 • 7 • 11;
- 4104 = 2 • 2 • 2 • 3 • 3 • 3 • 19 = 2 3 • 33 • 19;
- 546 = 2 • 3 • 7 • 13;
- 510 = 2 • 3 • 5 • 17;
- 495 = 3 • 3 • 5 • 11 = 3 2 • 5 • 11;
- 224 = 2 • 2 • 2 • 2 • 2 • 7 = 2 5 • 7;
- 208 = 2 • 2 • 2 • 2 • 13 = 2 4 • 13;
- 156 = 2 • 2 • 3 • 13 = 2 2 • 3 • 13;
- 126 = 2 • 3 • 3 • 7 = 2 • 3 2 • 7;
- 118 = 2 • 59.
Используя метод, можно представить любое число как произведение простых множителей, но с условием, что изначально оно будет кратным двум или трём. В ином же случае простые множители подобрать не получится, как, например, для числа 247, которое можно заменить произведением чисел 13 и 19.
Видео:Теорема Безу и разложение многочлена на множителиСкачать

Вынесение коэффициента
Это довольно простой способ разложения многочлена. Выполняют его с помощью перестановки общего множителя за скобку, в которой остаётся сумма выражения. То есть для этого метода необходимо представить искомое в виде произведения нескольких полиномов.
Чтобы выделить общий множитель, следует выполнить:
- для численного выражения — найти число, на которое можно будет разделить без остатка любой коэффициент одночлена;
- для выражения с неизвестным — определить неопределённое число, повторяющееся в каждом одночлене, и вынести его за скобку в наименьшей степени;
- рассчитать многочлен, стоящий в скобках.
Например, пусть дано выражение: 3у2 — 3y + 6 r*y. Согласно правилу, необходимо найти число, на которое без остатка можно разделить каждый из трёх коэффициентов многочлена. Для рассматриваемого примера это будет цифра 3.
Затем определить буквенный множитель, имеющийся в каждом члене выражения. Найденную цифру и повторяющееся неизвестное с наименьшей степенью записать за скобкой. Теперь нужно каждый одночлен разделить на вынесенное значение, а полученный результат записать в скобках: 3y * (y — 1 + 2r). Для проверки правильности действий нужно просто раскрыть скобки путём умножения каждого члена на вынесенный множитель.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Формулы умножения
Довольно часто для упрощения расчётов используют формулы сокращённого умножения. Всего существует семь выражений, которые необходимо выучить. Найти их можно в таблицах любого учебника по алгебре за седьмой класс. Смысл этих теорем в следующем:
Все эти формулы умножения можно использовать также в обратную сторону, то есть собирать многочлен. Например, для решения примеров типа: «квадратный трёхчлен разложен на множители, найдите а». Если понять смысл этих формул, то запомнить их наизусть будет довольно легко.
Видео:КАК РЕШАТЬ КУБИЧЕСКИЕ УРАВНЕНИЯ | Разбираем на конкретном примереСкачать

Метод группировки
Пожалуй, самый распространённый способ разложения на множители. Его удобно применять для упрощения квадратных уравнений без поиска корней. Разложение этим методом выполняют в следующей последовательности действий:
- выбирают повторяющиеся неизвестные и записывают друг за другом одночлены с одинаковыми множителями;
- в каждой группе находят одинаковый множитель и переносят его за скобку;
- находят общий полином и отделяют его скобками.
Выполнять группировку можно по-разному, но в итоге обязательно должен остаться общий многочлен. Например, выражение 48 * h * e 2 + 32 * h * q — 15 * e 2 — 10 * q2 возможно решить двумя способами.
Для того чтобы вынести многочлен за скобку, может понадобиться инвертировать все знаки. Следует помнить, что при выносе минуса у всех одночленов, оставшихся под скобкой, знак изменится на противоположный.
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Выделение квадрата
По сути, выделение общего квадрата соответствует преобразованию, при котором трёхчлен представляют в виде (k + e)2 или (k — e)2. Метод используется для решения биквадратных уравнений. Для выделения полного квадрата при разложении многочлена на множители применяют две формулы:
Например, нужно упростить дробь: (k4 + 4 * e4) / (k4 + 2 * e2 + 2 * k * e). Необходимо разложить числитель, используя формулы для полного квадрата: (k4 + 4 * e4) = (k4 + 4 * e2 * k2 + 4 * e 4). Значит, если отнять от многочлена 4 * k2 * e2, то получится уравнение: (k2 + 2 * e2) * 2 − 4 * k2 * e2. Используя формулу умножения квадратов, верно будет записать: (k2 + 2 e 2 − 2 * k * e) * (k2 + 2 e 2 + 2 * k * e).
Заменив полученным выражением числитель, можно будет его часть взаимно сократить со знаменателем. В итоге получится простое выражение: h2 + 2 * e2 − 2 * h * e.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Неприводимые множители
Решая различные задачи, можно столкнуться со сложными выражениями, которые, как кажется, разложить нельзя. Например, (2 * p2 — 5 * p — 3)/(3 * p — 9). В числителе дроби находится квадратный трёхчлен, который на самом деле можно разложить. Для того чтобы его можно было упростить, используется формула: ar2 + br + p = a (r — r1) * (r — r2), где r1 и r2 корни выражения.
Чтобы найти решения для линейного уравнения, необходимо определить дискриминант. То есть нужно из задачи отделить числитель, найти его решения и подставить найденные значения в формулу разложения.
Для рассматриваемого примера дискриминант квадратного уравнения будет равняться: Д = 25 — 4*2 (-3) = 49. Отсюда p1 = (5 + 7)/4 = 3, p2 = (5 — 7)/4 = -½. Подставив полученные корни в формулу, можно запись: 2 * (p — 3) * (p + ½).
Теперь вместо числителя нужно подставить полученное разложение: (2*p2 — 5*p — 3)/(3*p — 9) = 2*(p — 3) * (p + ½)/3 * (p — 3) = (2 *p + 1)/3.
Использование онлайн-калькуляторов
Порой, для решения сложных заданий нужно затратить много времени. При этом всегда существует риск допустить ошибку при расчётах. Чтобы этого избежать или проверить свой ответ, можно воспользоваться сайтами, предлагающие онлайн-калькуляторы. Использовать их сможет даже пользователь, совершенно не понимающий методов, используемых для упрощения выражений.
Расчёт обычно занимает менее 30 секунд. Приложений для упрощений уравнений достаточно много. Написаны они на Паскале или javascript. Появление ошибки при вычислении невозможно. Нередко на этих сайтах ещё и содержится информация о способах упрощения полиномов.
Для того чтобы получить ответ, необходимо будет с помощью браузера зайти на сайт онлайн-калькулятора и заполнить предлагаемые им поля. После того как упрощаемое выражение будет вписано, следует нажать кнопку «Рассчитать» или «Упростить выражение» и получить ответ с пошаговым решением.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
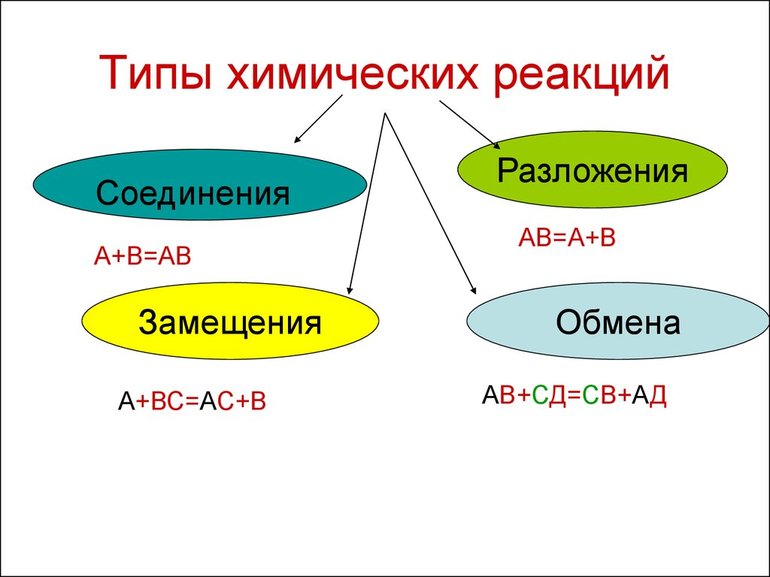
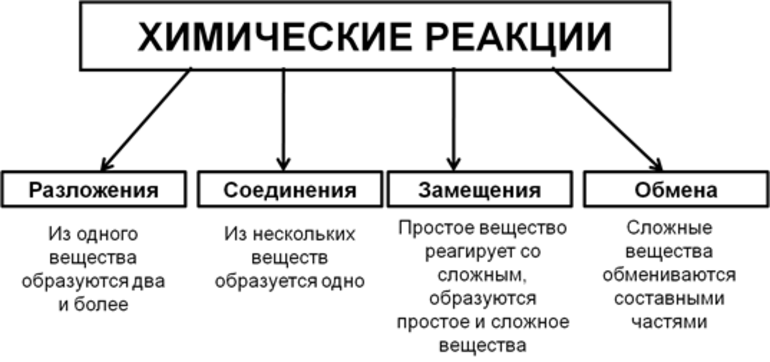
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
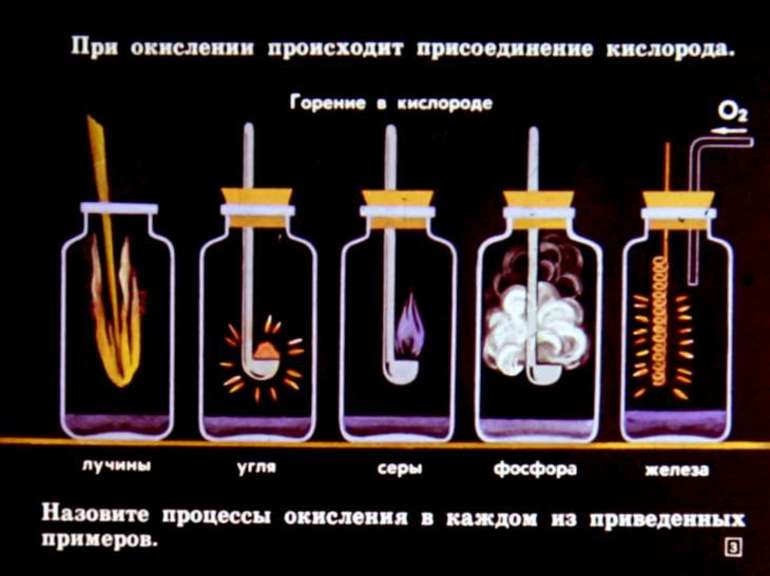
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
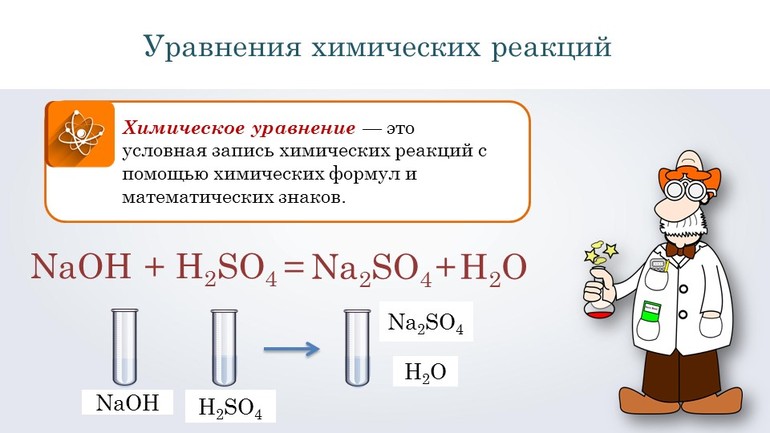
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.