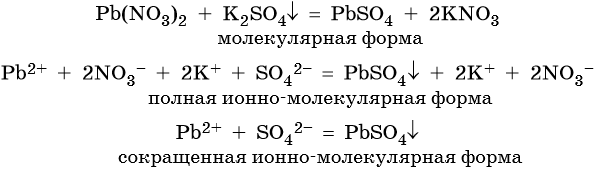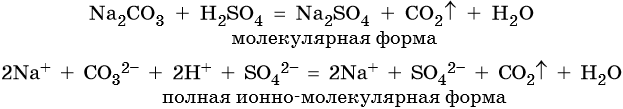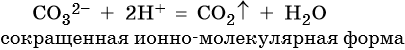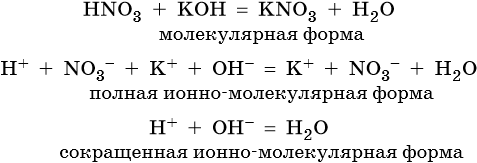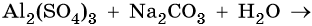Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Обменные реакции
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращенной ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой).
При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
- Записывают в левой части уравнения все формулы веществ, вступивших в реакцию в молекулярной или ионной форме.
- Руководствуясь знаниями физико-химических свойств реагентов и таблицами растворимости веществ, составляют формулы продуктов реакции.
- Проверяют число атомов каждого элемента в обеих частях уравнения и определяют необходимые стехиометрические коэффициенты перед формулами.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциирующие соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
Пример 3. Реакция между азотной кислотой и едким кали. В результате данной реакции образуется малодиссоциированное соединение — вода, и в растворе остаются катионы калия и нитрат-ионы:
Иногда в ходе обменных реакций образуются вещества, для которых в таблице растворимости приведены символы «–» (в водной среде разлагается или не существует) или «?» — нет достоверных сведений о существовании соединения. Это означает, что данное соединение водой разлагается на кислоту и основание.
Так, например, сульфид алюминия разлагается водой на Al(OH)3 и H2S, карбонат хрома (III) Cr2(CO3)3 разлагается на Cr(OH)3 и CO2 и т.д.
Пример 4. Реакция между водными растворами сульфата алюминия и карбоната натрия:
Теоретически в результате этой реакции должны образоваться сульфат натрия и карбонат алюминия. Однако последний в водном растворе не существует, а разлагается на Al(OH)3 и CO2. Следовательно, реакция пройдет следующим образом:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Урок химии в 8-м классе «Реакции обмена»
Разделы: Химия
Тип урока: Урок изучения нового материала.
Основная цель урока: Развитие знаний учащихся о химических реакциях при формировании представлений о реакции обмена.
Задачи урока
- Образовательная: ввести основное понятие-реакция обмена, сформировать понятие реакции нейтрализации, как частного случая реакции обмена. Продолжить формирование умения записывать уравнения и предвидеть продукты реакций обмена. Научить сравнивать конкретные уравнения реакций и узнавать тот или иной тип реакций. Дать первоначальное понятие об условиях течения реакций между растворами (правило Бертолле). Продолжить отработку навыков и умений в составлении формул веществ, схем химических реакций.
- Воспитательная: воспитывать чувство ответственности за свои действия в процессе обучения, при проведении лабораторных опытов, соблюдение правил техники безопасности при работе с химическими веществами.
- Развивающая: развивать химический язык, культуру речи, взаимоотношения. Способствовать развитию умений анализировать и обобщать, делать выводы в процессе беседы, демонстрации эксперимента, лабораторного опыта, развивать умения работать с таблицей растворимости, работать в парах, развивать умения применять имеющиеся знания в новой ситуации посредством составления уравнений.
Оборудование и реактивы: держатель для пробирок, CuO, растворы HCl, H2SO4, CuSO4, NaOH, Na2SO4, BaCl2, KCl, фенолфталеин, компьютер, проектор, ПСХЭ, таблица растворимости; на партах учеников инструктаж по технике безопасности и р-ры HNO3 и Na2CO3.
Ход урока
1. Организационный момент.
2. Подготовка к основному этапу усвоения учебного материала.
2.1. Проверка домашнего задания: (3 ученика у доски)
Закончите уравнения реакций, укажите тип реакции.
А) Li + O2 → ? Б) HgO →? В) Zn + CuSO4 →
2.2. Фронтальный опрос:
- Изучению какой темы мы посвятили последние несколько уроков?
- Что такое химическая реакция?
- По каким признакам можно судить, что происходит химическая реакция?
- Назовите условия, необходимые для возникновения химических реакций.
- Какие типы химических реакций вы знаете?
- Какая реакция называется реакцией соединения? Разложения? Замещения?
Далее слушаем ответы учеников у доски.
Затем учитель предлагает определить типы химической реакции (на слайде записаны):
Идет обсуждение.
Вопрос: Как вы думаете, к какому типу относится последняя химическая реакция?
Ученики затрудняются определить тип 4 реакции.
Учитель: Это-наша новая тема, то есть эта реакция является реакцией обмена, о которой мы сегодня узнаем.
Ученики в тетрадях записывают тему урока:»Реакции обмена».
3. Усвоение новых знаний и способов действий.
Учитель: Ребята, давайте попробуем самостоятельно вывести определение реакции обмена. Запись в тетрадь: Реакции обмена-это реакции, протекающие между двумя сложными веществами, в результате чего они обмениваются своими составными частями.
3.1. а) Демонстрация опыта (NaOH и HCl).
Беседа с классом:
- Какая химическая связь в NaOH?
- Какие частицы образуются в растворах гидроксида натрия и соляной кислоты?
(В р-ре гидроксида натрия Na + и OH — , а в растворе соляной кислоты H + и Cl — ). - Какие это ионы по составу? По заряду?
(Na + , Cl — и H + -простые, а ОН — -сложный; Na + и H + -катионы, а ОН — и Cl — -анионы).
Запись уравнения реакции
Na + OH — + H + Cl — = Na + Cl — + H + OH —
(Н2О)
Вопрос классу:
1)Какая среда в растворе гидроксида натрия? (Ответ:щелочная).
2)Какая среда в растворе кислоты? (Ответ: кислотная).
3)Какая среда в воде? (Ответ: нейтральная).
щелочная +кислотная =нейтральная
среда среда среда
( ОН — + Н + = Н2О )
Учитель: Ребята, а какое еще можно дать определение реакции обмена, если реакция протекает между веществами в растворе?
Вывод: Тип реакции-реакция обмена (обмен ионами).
Вид реакции-реакция нейтрализации.
(Ученики сами формулируют понятия).
3.2. б) Демонстрация реакции между нерастворимым основанием и кислотой:
гидроксидом меди (II) и соляной кислотой.
Учитель перед учениками выставляет проблему:
Мы рассмотрели реакцию растворимого основания с кислотой. А будет ли реакция протекать между нерастворимым основанием и кислотой? И будет ли она относится к реакции нейтрализации?
1) Получение нерастворимого основания Cu(OH)2
Запись уравнения реакции учеником:
СuSO4 + 2 NaOH = Na2SO4 + Cu(OH)2 ↓
2) Демонстрация реакции между нерастворимым основанием и кислотой:
гидроксидом меди (II) и соляной кислотой.
На доске ученик записывает уравнение реакции
Cu(OH)2+2HCl=CuCl2+2H2O
Ученики рассуждают и приходят к выводу, что реакция между нерастворимым основанием и кислотой не является реакцией нейтрализации, но нейтрализовать кислотой нерастворимое основание можно.
3.3.Учитель: Назовите в каких классах соединений мы встречаем ионную связь?
(Ответ: ионная связь в солях и основаниях).
Учитель перед учениками выставляет новую проблему.
Вопрос: А будет ли протекать реакция, т.е. обмен ионами а) между солями?
б) солью и кислотой?
Демонстрация:
А) Na2SO4 и BaCl2 Б) Н2SO4 и BaCl2
Уравнения записывают ученики. Работают с таблицей растворимости.
3.4. Лабораторный опыт.
Инструктаж по ТБ
Ученики проводят реакцию между Na2CO3 и HNO3
Записывают уравнение реакции, работают с таблицей растворимости, рассуждают.
Подводится итог этой части урока. Ученики делают вывод: реакции обмена протекают между сложными веществами, т.е. между основаниями и кислотами, солями и щелочами, солями и кислотами, между солями.
3.5. Учитель перед классом ставит проблемный вопрос:
Будет ли протекать реакция между оксидами металлов и кислотами?
Демонстрируется взаимодействие оксида меди(II) с раствором серной кислоты при нагревании.
Ученик на доске записывает уравнение реакции:
CuO + Н2SO4 = CuSO4 + H2O
3.6. Условия течения реакций между растворами до конца.
Эта часть урока дается только на предмет возможности протекания реакций между растворами до конца.
Учитель перед классом ставит проблемный вопрос:
Все ли реакции, протекающие в растворах между двумя сложными веществами, будут протекать до конца?
Правило Бертолле (слайд). Газ, осадок, вода.
3.7. Демонстрация опыта: NaOH и KCl
NaOH + KCl ≠ NaCl + KOH
Ученики фиксируют, что нет признаков реакции, записывают уравнение реакции, работают с таблицей растворимости, делают вывод, что данная реакция не идет до конца, т.к. не происходит связывания ионов.
4. Закрепление и применение полученных знаний.
5. Рефлексия.
Учитель задает вопрос: Что нового вы узнали на уроке?
6. Подведение итогов занятия.
Подведем итоги нашего урока-точно сформулируем понятия:
- Реакция обмена
- Реакция нейтрализации
- Условия течения реакции между растворами до конца
7. Домашнее задание:
Учебник: О.С.Габриелян. Химия 8 класс. Дрофа 2007.
§32, № 3 (а), № 4(в,г,д), №6(задача).
🎦 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции ионного обмена. 9 класс.Скачать

Реакции обменаСкачать

Реакции ионного обмена. 9 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции ионного обменаСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

ЛАЙФХАК по Химии — Реакция Ионного Обмена #shorts #youtubeshortsСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Как отличить реакции обмена от реакций замещенияСкачать

Реакции обмена. Как понятьСкачать

8 класс. Составление уравнений химических реакций.Скачать

Химия | Молекулярные и ионные уравненияСкачать